紫薯花色苷稳定性及热降解动力学研究
邓兰婷,刘 过,薛 蕊,杨 涛,向明泉,周 榕
(怀化学院生物与食品工程学院,湖南怀化 408000)
花色苷是一种天然的水溶性色素,广泛存在于植物体的根、茎、叶中,属于类黄酮类物质。自然界中紫薯、茄子、紫玉米、辣椒、黑枸杞、桑葚、紫甘蓝、越橘、黑豆等植物之所以拥有独特的颜色就是因为花色苷的作用,同时花色苷在调节代谢紊乱、预防心血管疾病、抗肿瘤、抗癌、保护视力、保护肝脏等方面具有重要的作用[1]。
花色苷是花色素以糖苷键与糖基结合而成的,具有C6-C3-C6基本骨架结构,花色素母核为二苯基色原稀,基本结构为3,5,7 -三羟基-2 -苯基苯并吡喃[2-3]。其结构不稳定,在食品加工过程中容易受到pH 值、温度、光照、糖、金属离子等因素的影响[4],且不同植物或同一植物的不同品种所含的花色苷的稳定性也存在一定差异,与花色苷的种类及浓度有一定的关系[5-6]。
紫薯,也称黑薯、紫心甘薯,果肉呈紫色至深紫色。近年来,由于其较高的营养价值和丰富的花色苷含量受到广泛的关注[7]。研究紫薯花色苷的热稳定性,并探究几种常见的食品添加物(如柠檬酸、抗坏血酸、葡萄糖、蔗糖、氯化钠、苯甲酸钠)对其热稳定性的影响,以期为紫薯花色苷的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫薯,购自怀化佳惠超市。
乙醇、氯化钾、盐酸、醋酸钠、醋酸、柠檬酸、抗环血酸、氯化钠、苯甲酸钠、葡萄糖、蔗糖,国药集团化学试剂有限公司提供。
1.2 仪器与设备
WGL-625B 型鼓风干燥箱、DK-98-II 型恒温水浴锅,天津市泰斯特仪器有限公司产品;PHS-3C 型酸度计,上海仪电科学仪器股份有限公司产品;离心机,Eppendorf 公司产品;UV-2204 型紫外可见分光光度计,上海析谱仪器有限公司产品;YRE-5299 型旋转蒸发器,巩义予华仪器有限公司产品。
1.3 试验方法
1.3.1 紫薯预处理
选取新鲜、无损伤的紫薯清洗去皮,切成约1 cm的薄片,于60 ℃条件下干燥24 h;粉碎,过60 目筛,4 ℃条件下保存。
1.3.2 紫薯花色苷的提取
称取紫薯粉2 g 于锥形瓶中,加入体积分数为60%的乙醇溶液80 mL,充分振荡,于60 ℃水浴中加热100 min,于4 ℃条件下以转速10 000 r/min 离心10 min。取上清液,用旋转蒸发器于40 ℃浓缩至乙醇蒸发,再用水定容至50 mL,即得花色苷水溶液,于4 ℃条件下储存备用[8]。
1.3.3 花色苷含量的测定
采用pH 值示差法测定花色苷的含量[9]。取2 支比色管,各取0.5 mL 待测液,再分别加入pH 值1.0(0.2 mol/L KCl∶0.2 mol/L HCl=25∶67)、pH 值4.5(0.2 mol/L NaAc∶0.2 mol/L HAc=1∶1)的缓冲液至10 mL,振荡后黑暗处静置1 h,分别测其波长521 nm和700 nm 处的吸光度。按下式计算花色苷含量。
式中:C——花色苷质量浓度,mg/mL;
F——稀释倍数;
Mr——花色苷(以矢车菊-3 -葡萄糖苷计)相对分子质量,449.2 g/mol;
26 900——矢车菊-3 -葡萄糖苷摩尔消光系数。
1.3.4 热降解动力学分析
式中:Ct——t 时刻紫薯花色苷的质量浓度,mg/mL;
C0——初始时紫薯花色苷的质量浓度,mg/mL。
利用Origin 进行一级动力学拟合,以ln(Ct/C0)纵坐标,时间t 为横坐标作图。
式中:K——速率常数,h-1;
t——加热时间,h。
利用阿伦尼乌斯公式计算活化能。
式中:K0——频率因子,h-1;
Ea——活化能,kJ/mol;
R——气体常数,8.314 J/mol·K;
T——绝对温度。
式中:Q10——温度系数,表示温度每升高10 ℃,反应速率增大的比例数;
K1——温度在T1下的降解速率,h-1;
K2——温度在T2下的降解速率,h-1。
2 结果与分析
2.1 不同温度对紫薯花色苷稳定性的影响
中性紫薯花色苷溶液分别置于70,80,90 ℃水浴锅中,避光加热9 h,每隔1 h 测定花色苷含量,计算残留率。花色苷随着加热时间的延长不断发生降解,而且温度越高,降解速率越快,这与蓝莓、桑葚等花色苷热稳定性结果一致[10-11]。70,80,90℃下加热9 h 花色苷的残留率分别为38.6%,32.8%,19.5%。
紫薯花色苷在不同温度下加热残留率随时间的变化见图1,紫薯花色苷不同加热温度下的降解动学参数见表1。
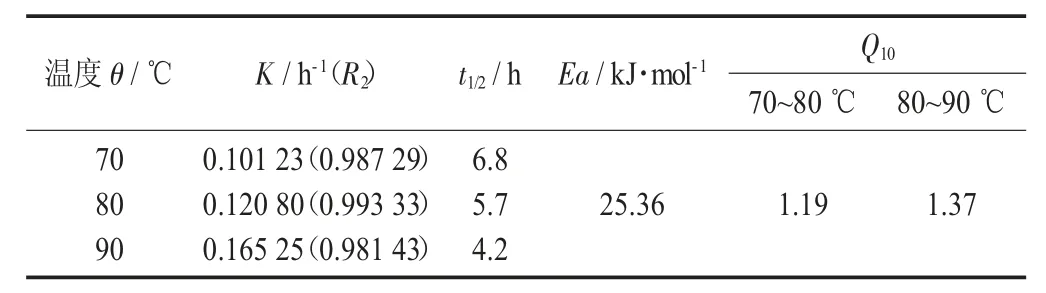
表1 紫薯花色苷不同加热温度下的降解动学参数
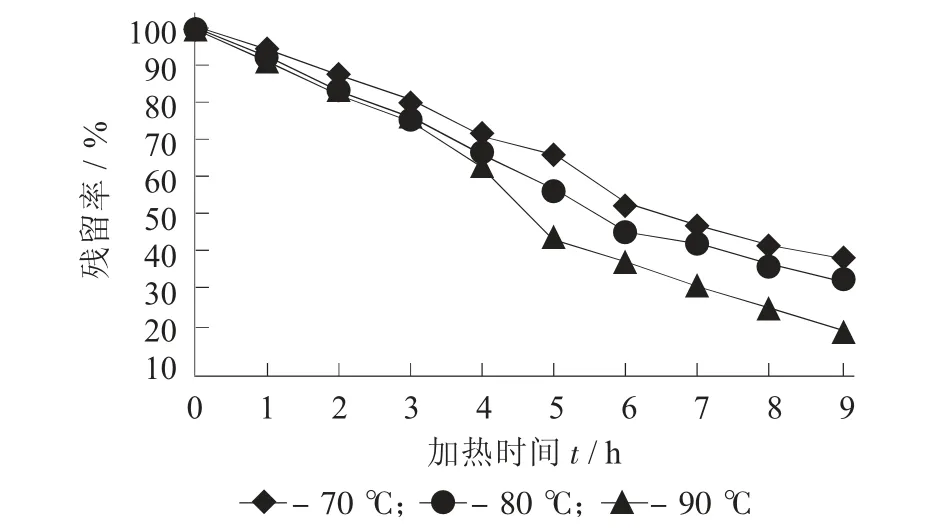
图1 紫薯花色苷在不同温度下加热残留率随时间的变化
对紫薯花色苷含量随加热时间的变化进行一级动力学拟合(见表1)。紫薯花色苷的热稳定性符合一级动力学(R2>0.9),70,80,90 ℃下的降解速率K 分别为0.101 23,0.120 80,0.165 25 h-1,即降解速率随着温度的升高而增大,半衰期则随着温度的升高而减小,90 ℃时紫薯花色苷的半衰期仅4.2 h,可能是因为高温下花色苷的糖基发生了水解,也可能是高温时花色苷的构型发生了变化,所以长时间高温处理容易使花色苷发生降解,花色苷的加工和贮藏应保持在低温条件下[12]。Q10随着温度的升高而增大,表明高温时紫薯花色苷的降解速率比低温时增加更大的比例。反应的活化能为25.36 kJ/mol,与酸性条件下紫薯花色苷的热降解活化能相比偏低[13]。活化能表示一个反应发生所需要的最小能量,活化能越小则表示花色苷越容易降解,所以在中性条件下紫薯花色苷比在酸性条件下更容易发生热降解。与不同来源的花色苷相比,蓝莓花色苷在中性时的活化能为46.38 kJ/mol[10],比紫薯花色苷高,而薰衣草花色苷仅为2.80 kJ/mol[14],比紫薯花色苷还要小,可能是因为不同来源的花色苷在组成上存在较大差异,所以热稳定性差异也比较大。
2.2 柠檬酸对紫薯花色苷热稳定性的影响
在10 mL 花色苷溶液中分别加入0,0.01,0.03,0.05 g 柠檬酸,在90 ℃条件下持续加热9 h,每隔1 h 测定其花色苷含量,并进行一级动力学拟合。
不同添加量柠檬酸对紫薯花色苷残留率的影响见图2,不同添加量柠檬酸下紫薯花色苷的降解动学参数见表2。
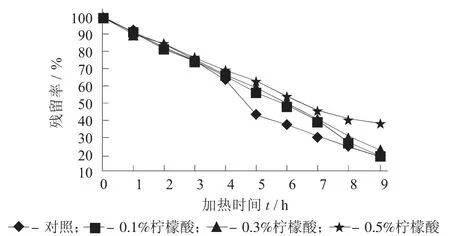
图2 不同添加量柠檬酸对紫薯花色苷残留率的影响
由图2 及表2 可知,与对照相比,随着柠檬酸添加量的增加,紫薯花色苷的残留率逐渐增高,降解速率逐渐降低,半衰期逐渐增大。当添加3%的柠檬酸时,残留率为对照组的2.0 倍,降解速率为0.104 56 h-1,半衰期为6.6 h,与对照组相比增加了2.4 h。由此可知,柠檬酸对花色苷有一定的护色作用,且随着柠檬酸添加量越高,护色作用越强。与张镜等人[15]对阴香花色苷及孙健等人[16]对红毛丹果皮色素的研究结果是相似的。对柠檬酸的护色作用可能与柠檬酸改变了花色苷的pH 值有关,较低的pH值条件下,初始系统与自身势力学平衡之间的距离较短,所以花色苷降解更不容易发生[17]。
2.3 抗坏血酸对紫薯花色苷热稳定性的影响
在10 mL 花色苷溶液中分别加入0,0.01,0.03,0.05 g 抗坏血酸,于90 ℃条件下持续加热9 h,每隔1 h 测定其花色苷含量,并进行一级动力学拟合。
不同添加量抗坏血酸对紫薯花色苷残留率的影响见图3,不同添加量抗坏血酸下紫薯花色苷的降解动学参数见表3。
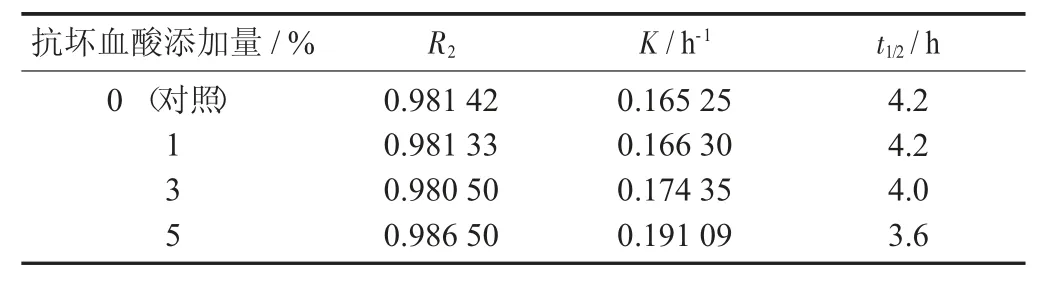
表3 不同添加量抗坏血酸下紫薯花色苷的降解动学参数
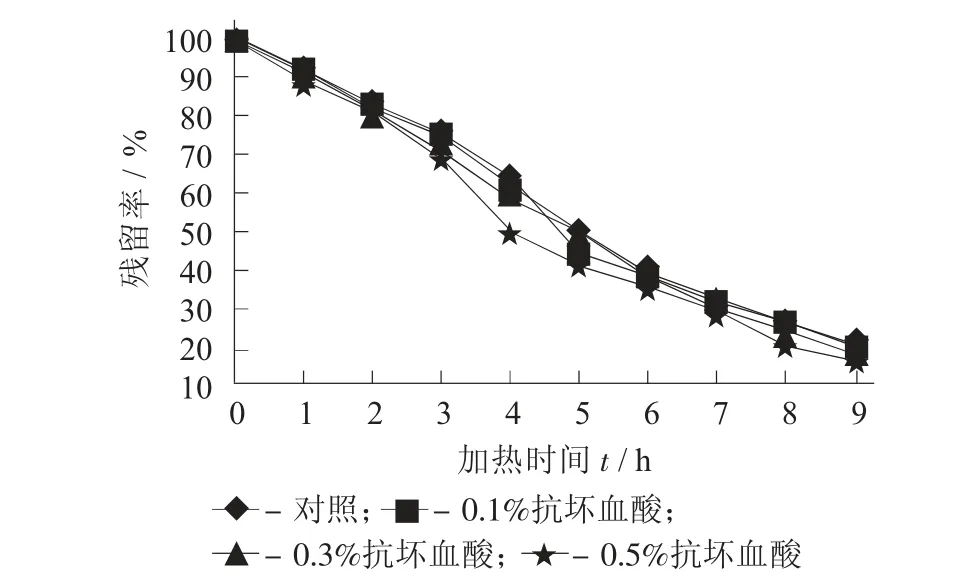
图3 不同添加量抗坏血酸对紫薯花色苷残留率的影响
由图3 及表3 可知,结果表明低添加量的抗坏血酸(0.1%)对紫薯花色苷的热稳定性基本没有影响,半衰期与对照结一样为4.2 h,而随着抗坏血酸添加量的增加,紫薯花色苷降解速率逐渐增加。当添加0.5%的抗坏血酸时,花色苷的降解速率为0.191 09 h-1,比对照增加了15.6%,此时半衰期为3.6 h。因此,与柠檬酸不同,抗坏血酸不但没有护色作用,反而会加快紫薯花色苷的降解。一方面,可能是因为抗坏血酸是一种弱酸,加入抗坏血酸后对花色苷溶液的pH 值影响不大,所以不能通过降低pH 值来提高花色苷的稳定性;另一方面,抗坏血酸是一种抗氧化剂,且有还原性,可能是其还原性促进了紫薯花色苷的降解。关于抗坏血酸对花色苷稳定性的影响近些年也有一些研究,但结果存在矛盾性。李颖畅等人[18]研究抗坏血酸对蓝莓花色苷的影响时发现其会使花色苷稳定性下降,但王丽霞等人[19]却发现其对玫瑰茄花色苷有增色作用,所以抗坏血酸的具体作用还需要进一步研究。
2.4 葡萄糖对紫薯花色苷热稳定性的影响
在10 mL 花色苷溶液中分别加入0,0.01,0.03,0.05 g 葡萄糖,在90 ℃条件下持续加热9 h,每隔1 h 测定其花色苷含量,并进行一级动力学拟合。
不同添加量葡萄糖对紫薯花色苷残留率的影响见图4,不同添加量葡萄糖下紫薯花色苷的降解动学参数见表4。
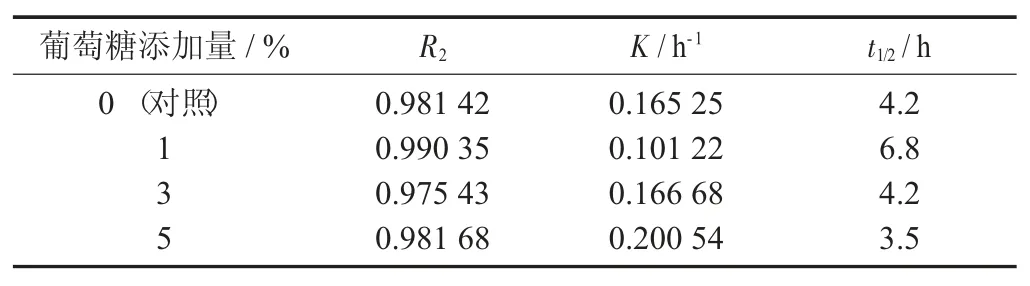
表4 不同添加量葡萄糖下紫薯花色苷的降解动学参数
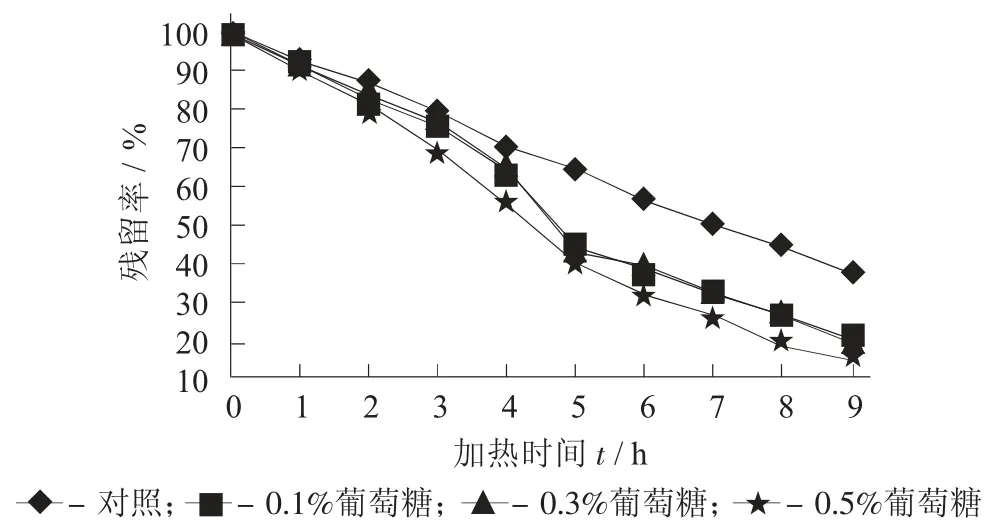
图4 不同添加量葡萄糖对紫薯花色苷残留率的影响
由图4 及表4 可知,0.1%葡萄糖的添加量能提高花色苷的稳定性,花色苷的降解速率由0.165 25 h-1减至0.101 22 h-1,半衰期t1/2由4.2 h 增加为6.8 h。但是当继续增加葡萄糖时,花色苷的稳定性反而有所下降,当添加量为0.3%葡萄糖时,与对照无显著性差异;当增加至0.5%时,花色苷最终残留率仅为13.8%,半衰期t1/2为3.5 h。张镜等人[15]、李紫薇等人[20]、Roidoung S 等人[21]也发现了相似的促降解作用。
2.5 蔗糖对紫薯花色苷热稳定性的影响
在10 mL 花色苷溶液中分别加入0,0.01,0.03,0.05 g 蔗糖,于90 ℃条件下持续加热9 h,每隔1 h测定其花色苷含量,并进行一级动力学拟合。
不同添加量蔗糖对紫薯花色苷残留率的影响见图5,不同添加量蔗糖下紫薯花色苷的降解动学参数见表5。
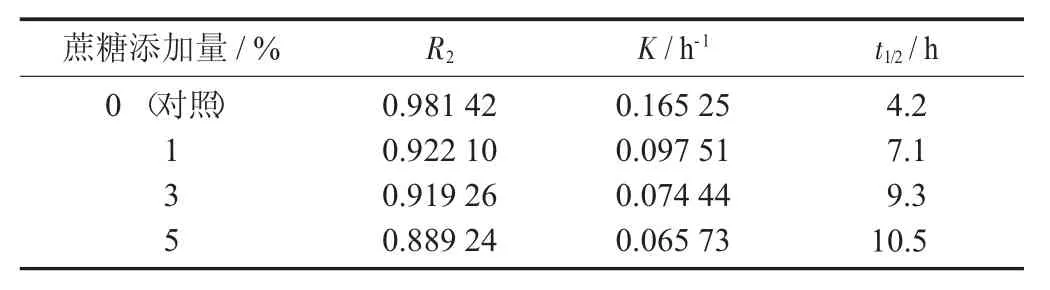
表5 不同添加量蔗糖下紫薯花色苷的降解动学参数
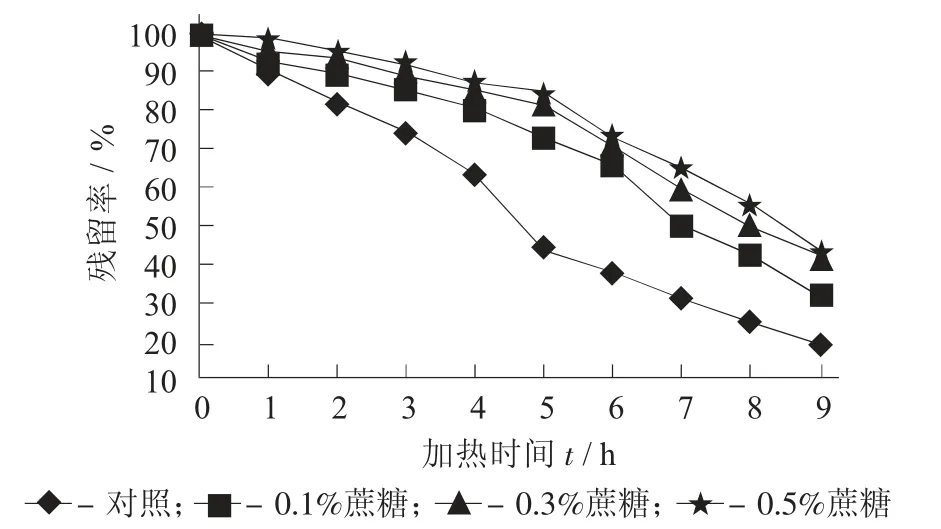
图5 不同添加量蔗糖对紫薯花色苷残留率的影响
由图5 及表5 可知,蔗糖对紫薯花色苷有很好的护色作用,能显著提高花色苷的热稳定性。0.1%,0.3%,0.5%蔗糖条件下紫薯花色苷的半衰期t1/2分别为7.1,9.3,10.5 h,与对照组相比,均有显著的提高。蔗糖对阴香花色苷[15]、牡丹花色苷[22]、玫瑰茄花色苷[19]也有一致的结果。可能是蔗糖降低花色苷的水分活度,从而提高了花色苷的稳定性。
2.6 氯化钠对紫薯花色苷热稳定性的影响
不同添加量氯化钠对紫薯花色苷残留率的影响见图6,不同添加量氯化钠下紫薯花色苷的降解动学参数见表6。
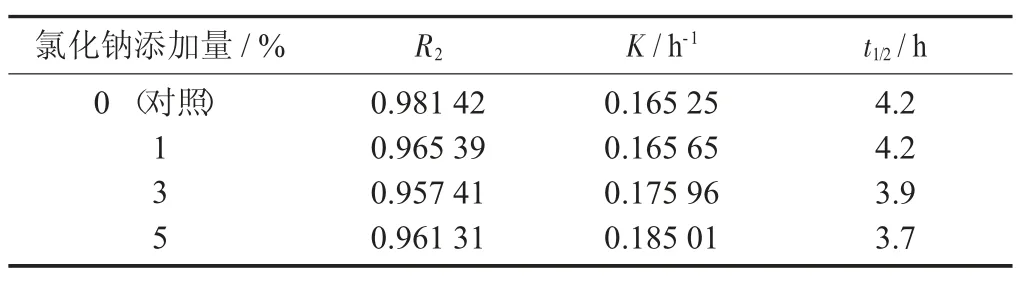
表6 不同添加量氯化钠下紫薯花色苷的降解动学参数
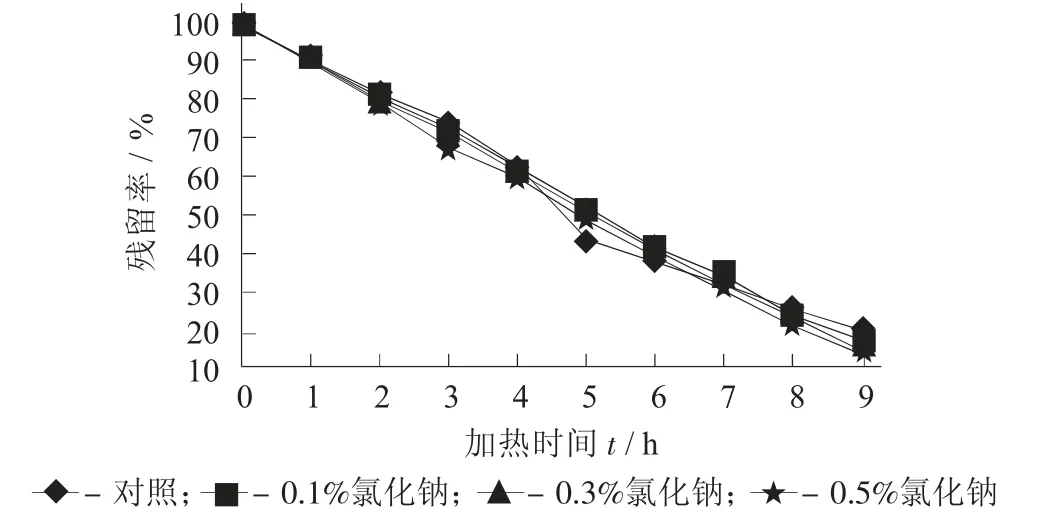
图6 不同添加量氯化钠对紫薯花色苷残留率的影响
由图6 及表6 可知,同为90 ℃加热的条件下,添加量为0.1%,0.3%,0.5%氯化钠时,紫薯花色苷的保存率随着氯化钠添加量的增加而降低,半衰期t1/2分别为4.2,3.9,3.7 h。当添加量为0.1%时,与对照无显著性差异,添加量增加后,降解速率增大,但增幅不大。由此可知,氯化钠可促进花色苷的降解,但影响较小。张唯[23]的研究表明氯化钠对玫瑰花色苷的稳定性无显著性影响。
2.7 苯甲酸钠对花色苷热降解动力学的影响
在10 mL 花色苷溶液中分别加入0,0.01,0.03,0.05 g 苯甲酸钠,于90 ℃条件下持续加热9 h,每隔1 h 测定其花色苷含量,并进行一级动力学拟合。
不同添加量苯甲酸钠对紫薯花色苷残留率的影响见图7,不同添加量苯甲酸钠下紫薯花色苷的降解动学参数见表7。
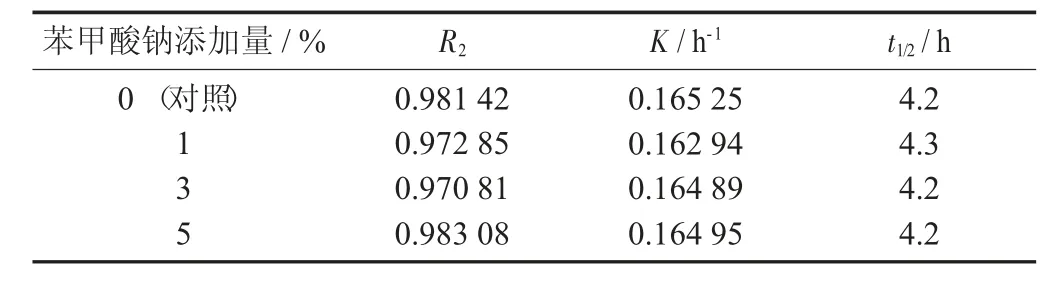
表7 不同添加量苯甲酸钠对紫薯花色苷残留率的影响
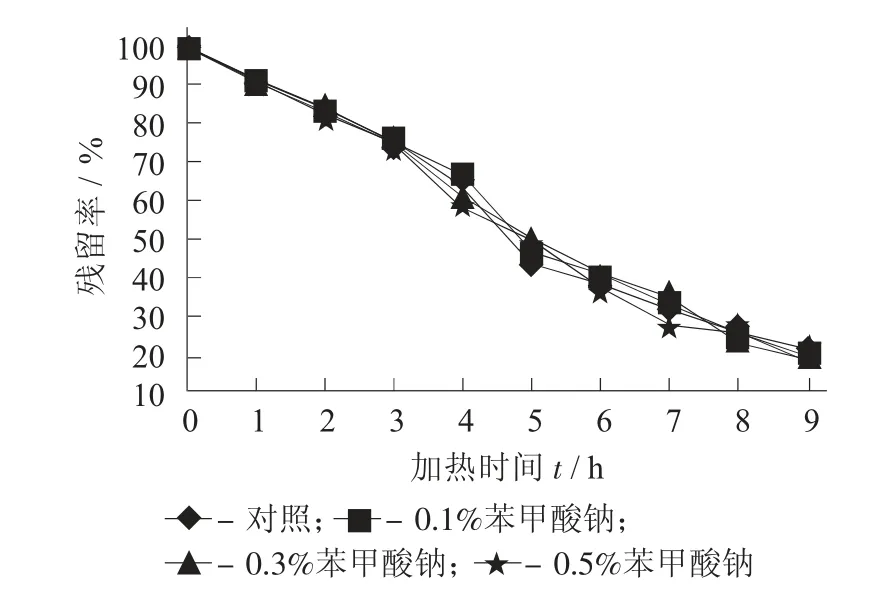
图7 不同添加量苯甲酸钠下紫薯花色苷的降解动学参数数
由图7 及表7 可知,从降解速率和半衰期可看出,苯甲酸钠对紫薯花色苷的稳定性无显著性影响。苯甲酸钠是食品中常用的防腐剂,对其他花色苷的影响时已有一些报道,董立健等人[24]的研究则表明苯甲酸钠会提高蓝莓花色苷的稳定性。
3 结论
紫薯花色苷的热降解符合一级反应动力学,花色苷的半衰期随着温度的升高而缩短;当在花色苷溶液中添加柠檬酸、抗坏血酸、葡萄糖、蔗糖、氯化钠、苯甲酸钠等食品中常用添加物时,柠檬酸、蔗糖、低添加量葡萄糖能提高花色苷的稳定性,而抗坏血酸、氯化钠及高添加量的葡萄糖会降低花色苷的稳定性;苯甲酸钠对紫薯花色苷的影响不显著。柠檬酸和蔗糖添加量越大对紫薯花色苷的护色作用越好,但蔗糖的护色作用比柠檬酸强。当添加0.5%蔗糖时,紫薯花色苷的半衰期为10.5 h,延长了6.3 h,而添加0.5%柠檬酸半衰期仅延长了2.4 h。抗坏血酸和氯化钠在低添加量时对紫薯花色苷的影响不明显,增加添加量(0.3%以上)则会促进花色苷的降解。同为糖,葡萄糖和蔗糖对紫薯花色苷的作用效果不同,从花色苷的稳定性来看,蔗糖更有利于花色苷的保存。不同添加物对花色苷稳定性的影响是一个复杂的过程,具体的影响机理还需要进一步研究。在食品加工过程中,可通过不同的影响来选择不同的添加剂及其添加量。

