不同pH 值溶剂对昭通乌天麻多糖提取率及抗氧化能力研究
李俊杰,黄 艳,亢凯杰,张帮磊, 李 浪,2
(1.昭通学院化学化工学院,云南昭通 657000;2.云南省高校高原特色功能食品研究重点实验室,云南昭通 657000;3.昭通学院云南食品安全昭通研究院,云南昭通 657000)
天麻是一种具有药用价值的兰科非自养型生物,可入药,也可作为食品食用,并且具有较高的食用价值[1]。天麻在2018 年被列入药食同源的中药材,主要药用成分为天麻素、多糖、多酚、皂苷等活性成分。Wei L 等人[2]发现,天麻具有镇定催眠、抗衰老、抗氧化等作用。陈小银等人[3]发现天麻素可抑制海马体兴奋性氨基酸神经递质受体Glu 的表达的作用和活化海马抑制性神经递质受体GABA 的活性与表达,从而抑制癫痫的发生。Jie W等人[4]通过试验证实了天麻具有降低高血压及缓解高血压引起的头晕、头痛、疲劳、腰膝乏力等症状。天麻如此广泛的功能性,除了天麻素外离不开天麻多糖的贡献,张双奇等人[5]对天麻多糖的抗氧化作用进行了研究,结果表明天麻多糖具有较强的抗氧化的作用。另外,多糖还具有抗衰老的作用[6],缪化春等人[7]发现天麻多糖具有降血压、降血糖等功能。近期研究发现,天麻多糖也是天麻中最主要的生物活性成分之一,且还具有增强免疫力[8]、抗肿瘤[9]、抗氧化[10]等功能。而抗氧化的关键在于清除自由基能力,自由基在人体生命的过程中是各类化学反应的主要中间产物,一旦人体内形成过量的自由基而未能有效清除,这些自由基就会威胁机体内的生命大分子物质及各类细胞器,最常见的原因便是由于过量的自由基产生加快机体的老化[10-11]。因此,想要降低过量的自由基产生所造成的损害,寻找有效低毒的抗氧化剂是至关重要的第一步,该研究重点对昭通乌天麻多糖的羟基自由基、DPPH 自由基等的清除能力进行探究,为今后天麻多糖的抗氧化能力的研究提供了基础,对昭通的经济发展有着巨大的贡献,也为带动昭通地区经济发展有一定的贡献。
1 材料与方法
1.1 材料与仪器
干乌天麻,产自昭通彝良小草坝;苯酚、浓硫酸、乙酸铅、Tris-HCl 缓冲溶液、DPPH-乙醇溶液、邻苯三酚、水杨酸纳-乙醇溶液、硫酸亚铁、过氧化氢、冰乙酸、氯化钠、氢氧化钠、盐酸、维C 标准品(纯度≥99%),天津风船化学试剂有限公司提供;葡萄糖标准品(纯度≥99%),上海源叶生物科技有限公司提供。
UV-2700 型分光光度计,SHIMADZU 岛津公司产品;YRE-2000A 型旋转蒸发仪,巩义市予华仪器有限责任公司产品;pHS-3E 型精密pH 计,上海虹益仪器仪表有限公司产品;PT-3502C 型全波长酶标分析仪,北京普天新桥技术有限公司产品。
1.2 试验方法
1.2.1 天麻多糖的提取
参考文献[12]中方法稍作修改。采用热水浸提法提取天麻多糖,通过配制不同pH 值的缓冲溶液,在95 ℃热水中提取天麻多糖。操作中采用水提法,按照料液比为1∶20,pH 值分别为2,4,6,8,10进行提取,提取时间为30 min,重复提取1 次,合并滤液后浓缩,并用乙酸铅除去蛋白成分,用85%乙醇进行醇沉、过滤,经冷冻、干燥得到天麻粗多糖。
1.2.2 多糖含量测定
参考文献[13-14]中方法稍作修改。
1.2.3 乙醇分级沉淀
参考文献[15-16]中方法进行乙醇分级沉淀。向装有已知体积的多糖浓缩液中加入乙醇使整个溶液中乙醇体积分数达55%,沉淀12 h,过滤,得到55%乙醇醇沉的天麻多糖;继续向滤液中加入乙醇,直至乙醇体积分数为65%,沉淀12 h,过滤,得到65%乙醇醇沉的天麻多糖。类推上述操作,得到75%,85%的乙醇醇沉的天麻多糖。
1.2.4 天麻多糖的分离
参考文献[17-18]中方法稍作修改,采用DEAE-52 纤维素作为层析柱的填料,将上述天麻粗多糖离心后取上清液,用0.45 μm 的水系过滤器过滤。滤液沿着玻璃层析柱的内壁缓慢加入DEAE-52 纤维素层析柱中,分别用浓度为0.1,0.2,0.4 mol/L 的NaCl溶液梯度洗脱,控制流速为1 mL/min,每支试管接5 mL 的洗脱液,采用苯酚-硫酸法进行显色跟踪,当加入长时间收集液的颜色和加入蒸馏水的样色一致时,即可判断为无糖,换下一梯度的洗脱剂继续进行再次洗脱,当最终的颜色变化不明显时,可以停止洗脱。
1.2.5 天麻多糖抗氧化能力测定
羟自由基清除能力的测定参考文献[19]中方法进行,DPPH 自由基抑制率的测定参考文献[20]中方法稍作修改进行。
2 结果与分析
2.1 不同pH 值溶剂对天麻粗多糖提取率的影响
不同pH 值对天麻多糖提取率变化见图1。
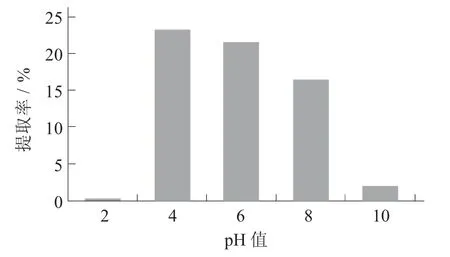
图1 不同pH 值对天麻多糖提取率变化
由图1 可知,在pH 值为4 时天麻多糖的提取率达到最高,为23.36%;当pH 值为2 时多糖提取率则最低,说明在适当的弱酸性条件下能够增加天麻多糖的提取率;在pH 值为2 时提取率却比pH 值为4 时大大降低,可能是强酸性条件下有可能会引起多糖中的糖苷键断裂,从而引起多糖水解,使其提取率降低。同理,pH 值为10 时提取率比pH 值为6时的提取率降低,也可能是因为强碱性条件下引起多糖中的糖苷键断裂,多糖发生水解而导致提取率降低。
2.2 不同体积分数乙醇醇沉对天麻粗多糖提取率的影响
pH 值为4 的不同体积分数乙醇醇沉天麻多糖提取率见图2。

图2 pH 值为4 的不同体积分数乙醇醇沉天麻多糖提取率
由图2 可知,通过配制不同体积分数的乙醇醇沉得出的多糖提取率不同。其中,85%的乙醇醇沉得到的天麻多糖提取率最高,55 %乙醇醇沉得到的多糖提取率最低,可知乙醇醇沉多糖得率随着乙醇体积分数的增加而增加。
2.3 不同体积分数乙醇醇沉的天麻粗多糖的抗氧化能力研究
不同乙醇体积分数醇沉多糖对羟基自由基的抑制率见图3,不同体积分数乙醇醇沉多糖对DPPH 自由基的抑制率见图4。

图3 不同乙醇体积分数醇沉多糖对羟基自由基的抑制率

图4 不同体积分数乙醇醇沉多糖对DPPH 自由基的抑制率
由图3 和图4 可知,不同体积分数乙醇醇沉多糖对羟基自由基均有抑制率,多糖质量浓度越高抑制效果越好,同一组多糖在不同体积分数下羟基自由基抑制率差异性明显。通过85%乙醇醇沉所得多糖对羟基自由基的抑制效果最好,当多糖质量浓度达到0.20 mg/mL 时抑制率为69.56%,55%乙醇醇沉所得多糖对羟基自由基的抑制率最低,为61.73%。由图4 可知,不同体积分数乙醇醇沉多糖对DPPH 自由基的抑制率随着多糖质量浓度升高而升高。醇沉液体积分数为75%时多糖对DPPH 自由基的抑制率最高,当多糖质量浓度达到0.20 mg/mL 时抑制率为42.16%。
2.4 天麻多糖的分离纯化
天麻粗多糖的分离见图5。

图5 天麻粗多糖的分离
由图5 可知,0.1 mol/L 的氯化钠溶液在第92 管时显色无糖,进行下一浓度梯度的洗脱,0.2 mol/L 的氯化钠溶液在第150 管时显色无糖,可进行下一浓度梯度的洗脱,0.4 mol/L 的氯化钠在193 管时显色无糖。从图5 中的洗脱曲线中可看出,所测得的吸光度有2 个峰值,分别在第7 管和第76 管出现峰值,由于前面洗脱出的含有淀粉等杂质,不能确定为纯的多糖,所以弃去前一个峰值。收集第55~79 管的洗脱液,合并洗脱液,浓缩后测定多糖的抗氧化值,为多糖的功能特性研究奠定基础。
2.5 不同pH 值条件提取的天麻多糖组分的抗氧化能力研究
不同pH 值条件提取的天麻多糖抗氧化能力见图6。
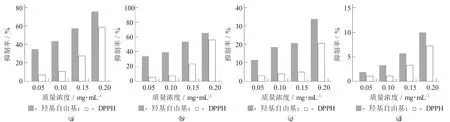
图6 不同pH 值条件提取的天麻多糖抗氧化能力
图6(a)~图6(d)分别代表pH 值为4,6,8,10 时提取的天麻粗多糖按照上述分离方法得出的多糖组分对羟基自由基和DPPH 自由基均有抑制率。由此可知,天麻多糖对羟基自由基和DPPH 自由基的抑制率随着质量浓度的升高而升高,且天麻多糖对羟基自由基的抑制率高于对DPPH 自由基。提取液pH 值为4 时提取的0.02 mg/mL 天麻多糖羟基自由基清除率最高,达75.61%;随着提取液pH 值的升高,所提取的多糖羟基自由基抑制率越低,当提取液值pH 值为10 时,羟基自由基清除率为9.95%。提取液pH 值为4 和6 时,0.02 mg/mL 天麻多糖对DPPH 自由基抑制率相当;而提取液pH 值为8 和10时,0.02 mg/mL天麻多糖对DPPH 自由基抑制率分别为20.56%和7.22%,远低于酸性提取液所提取的多糖组。
3 结论
通过配制不同pH 值缓冲溶剂提取天麻多糖,对粗多糖进行除蛋白处理,然后通过DEAE-52 纤维素为填料进行初步分离,并以羟自由基的清除能力和DPPH 自由基抑制率为考查指标探究各处理组天麻多糖的抗氧化能力。结果表明,pH 值为4 的缓冲液提取的天麻粗多糖的提取率最高,为23.6%;提取率随着pH 值的升高呈现出一个先升高后降低的趋势,此pH 值条件下通过85%乙醇醇沉所得多糖对羟基自由基的抑制效果最好,当多糖质量浓度达到0.20 mg/mL时抑制率为69.56%,醇沉液体积分数为75%时多糖对DPPH 自由基的抑制率最高,当多糖质量浓度达到0.20 mg/mL 时抑制率为42.16%。将不同pH 值条件下提取的天麻粗多糖进行分离纯化,发现提取液pH 值为4时0.02 mg/mL 天麻多糖羟基自由基清除率最高达75.61%,酸性条件下无论是粗多糖还是分离出的多糖组分,其对羟基自由基抑制率和DPPH 自由基抑制率均高于碱性提取液所提取的多糖组。王庆等人[21]发现,超声辅助和酶法提取的天麻多糖的抗氧化活性远高于其他提取方法。陈琛等人[22]对天麻多糖的分离纯化后测定其活性,得出对DPPH 自由基的清除率为44.50%,对羟自由基清除率为39.50%,与研究结果相似。综上所述,不同pH 值和不同醇沉液体积分数不仅对天麻多糖提取率影响较大,且还影响其抗氧化能力,选择合适pH 值的提取液更有利于高活性天麻多糖的制备,研究对高活性天麻多糖的提取及应用具有一定的指导意义。

