基于GC-MS研究OPFRs对PC12细胞代谢的影响
孙梦瑶 赵亚菲 王少敏 刘宏民


摘 要:基于气相色谱质谱(gas chromatography-mass spectrometry,GC-MS)研究了4种有机磷阻燃剂(organophosphate flame retardants,OPFRs)对神经细胞PC12代谢的影响.首先将PC12细胞分别暴露于4种不同浓度的阻燃剂中,利用噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法选出对细胞存活率影响较小的浓度.然后在该浓度下培养细胞并提取代谢物,利用GC-MS对细胞内的代谢物进行非靶向代谢组学分析.接着采用SIMCA软件对定量后的代谢数据进行OPLS-DA分析,找出细胞中受到OPFRs影响的关键代谢物,并利用生物信息学方法分析这些关键代谢物所涉及的重要代谢通路.该研究共鉴定出PC12细胞中的38种小分子代谢物.经过多元统计分析发现4种OPFRs均影响PC12细胞的代谢表型.OPFRs在100 μmol/L和1 000 μmol/L浓度下,对PC12细胞表现出显著的细胞毒性.其中糖代谢和氨基酸代谢是受影响的主要代谢通路.
关键词:有机磷阻燃剂;代谢组学;气相色谱质谱;PC12细胞
中图分类号:R114 文献标志码:A文章编号:1000-2367(2024)02-0096-08
有机磷阻燃剂(organophosphate flame retardants,OPFRs)是一类含有有机磷元素的新型添加剂,具有热稳定性,能够阻止聚合物材料引燃或者抑制火焰传播,其已被作为禁用溴化阻燃剂的替代品而广泛使用[1-2].与传统阻燃剂一样,OPFRs并非通过化学骨架与外源材料结合,主要是通过物理手段加入外源材料,此外大多数OPFRs具有半挥发性,因此很容易进入环境介质中[3].环境中的这些污染物可以通过室内灰尘吸入、皮肤吸收、手口接触的方式进入人体,对机体产生不同程度的损伤,威胁人类健康[4-5].因此对这些环境污染物毒性的研究具有重要意义.本文研究目的是探究4种OPFRs(磷酸三苯酯(triphenyl phosphate,TPHP)、甲苯磷酸二苯酯(cresyl diphenyl phosphate,CDP)、间苯二酚双(二苯基)磷酸酯(resorcinol bis(diphenyl phosphate),RDP)和磷酸三烯丙酯(triallyl phosphate,TAP))对神经细胞PC12代谢的影响.
芳基OPFRs具有发育、生殖和内分泌毒性,以及潜在的神经毒性[6].TPHP、CDP和RDP均为芳基OPFRs.有研究表明TPHP有内分泌扰乱作用和发育毒性[7],对呼吸道细胞也有明显的损伤作用[8];CDP会破坏DNA和线粒体,导致细胞周期停滞[9];RDP的分子结构是以TPHP为基础的,分子量和含磷量比TPHP高,导致其挥发性比TPHP低,热稳定性比TPHP高,因此RDP极有可能会产生生物积累效应[6].TAP可以作为反应型阻燃剂,添加到不饱和聚酯树脂和高压锂离子电池的电解液中,起到阻燃和改善相关性能的双重作用[10-11].目前,对于TPHP和CDP神经毒性的研究比较少,而RDP和TAP对PC12细胞毒性的研究则未见报道.
代谢组学目前已经成为对不同类型生物组织中的代谢物进行定性和定量分析的前沿方法,通过生成来自生物代谢物的小分子轮廓,直观反映出复杂生化反应网络的结果[12].近年来,科学界积极探索代谢组学的功能表征,并将该方法用于解决环境毒理学方面的问题[13].同时,由于气相色谱质谱(gas chromatography-mass spectrometry,GC-MS)技术的稳健性和重现性,以及成熟的代谢物数据库,其被认为是代谢组学研究最高效的平台之一[14].
本研究以PC12细胞作为OPFRs神经毒性探究的体外模型,对暴露于OPFRs的细胞提取物进行了基于GC-MS技术的代谢组学分析.研究结果可为新污染物对人类的健康风险提供科学依据.
1 材料与方法
1.1 试剂与仪器
TPHP(CAS:115-86-6,纯度98%)购自阿拉丁(上海)有限公司;CDP(CAS:26444-49-5,纯度93%)购自北京百灵威科技有限公司;代谢物对照品(分析纯)和RDP(CAS:57583-54-7,纯度98%)均购自上海麦克林生化科技有限公司;TAP(CAS:1623-19-4,纯度98%)购自上海毕得医药科技股份有限公司.溶解上述化学品所需的二甲基亚砜(DMSO)购自北京索莱宝科技有限公司.高糖培养基(hyClone)、胎牛血清(cell-Box)、青霉素-链霉素溶液购自碧云天生物技术有限公司.甲醇、甲基叔丁基醚、吡啶和甲氧胺盐酸盐均购自美国默克公司,噻唑蓝(methyl thiazolyl tetrazolium,MTT,纯度98%)和硅烷化试剂三甲基氰硅烷均购自天津希恩思生化科技有限公司.实验用水均为Milli-Q超纯水机制备的超纯水.Trace ISQTM气质联用仪(EI离子源)和LabServ K3 Touch酶标仪均为美国Thermo Scientific公司生产.
1.2 细胞培养
PC12细胞由郑州大学药学院提供,在本实验室进行传代培养.细胞培养在由胎牛血清(体积分数为10%),青霉素/链霉素双抗混合液(体积分数为1%)和高糖培养基(体积分数为89%)配制而成的完全培养基中进行.细胞接種时用直径6 cm的培养皿,并将培养皿置于环境适宜的培养箱(37 ℃、体积分数5%的CO2)中培养.观察细胞生长至密度90%左右可进行传代,胰酶消化50 s左右.
1.3 MTT分析
使用MTT比色法,评估4种有机磷阻燃剂对PC12细胞活力的影响.将从培养皿中收集的细胞以5 000个/孔的密度接种在96孔板中,每孔有100 μL细胞悬液,在培养箱中培养24 h.待细胞贴壁后,去除旧培养液,对细胞进行48 h的OPFRs暴毒处理.随后向每个孔中加入20 μL的MTT溶液(终质量浓度0.5 g/L).待孵育4 h后,加入100 μL的三联液(SDS-HCl-异丁醇溶液)溶解与活细胞数成正比的甲臜晶体.6 h后,使用酶标仪在570 nm处测量吸光度.
1.4 细胞样品前处理
细胞接种:将对数生长期状态良好的PC12细胞以105个/孔的密度接种于消毒后的培养皿中,培养过夜.
暴毒处理:细胞贴壁后,弃去旧培养液.在1.3节分析基础上,用10 μmol/L的OPFRs对细胞进行48 h的暴毒处理.随后,取出细胞培养皿置于冰上,除去培养液,用4 ℃预冷的生理盐水洗涤细胞3次,立即移入超低温冰箱(-80 ℃)抑制细胞代谢.
代谢物的萃取:从超低温冰箱取出细胞,用细胞刮刀分3次获取约300 μL的细胞悬液于1.5 mL的EP管中,随后进行3次冻融循环(-80 ℃ 存放60 min,37 ℃融化30 min).细胞破碎后,加入90 μL的内标溶液,600 μL的萃取溶液(甲醇和甲基叔丁基醚体积比9∶1混合),涡旋混匀后,4 ℃静置1 h沉淀蛋白及萃取代谢物.接着4 ℃,12 000 r/min,低温离心10 min.离心后,取上层代谢物溶液于衍生瓶中,37 ℃下氮气吹干.
代谢物的衍生:采用本实验室开发的肟化和硅烷化两步衍生法[15].衍生后的样品转入色谱瓶中供GC-MS分析使用.
1.5 数据处理
将GC-MS获得的谱图和原始数据导入AMDIS数据处理软件进行解卷积,使用NIST数据库和标准物质鉴定代谢物.对代谢物的特征离子峰进行面积积分,并根据每个样本的内标面积对所得数据归一化处理,得到代谢物的相对浓度.使用SIMCA-P14.1软件对处理后的数据进行分析,采用OPLS-DA模型对数据降维处理,获得样品的分类和聚集信息以及VIP值,然后选择SPSS 22.0软件中的独立样本t检验对数据进行差异分析.
2 结 果
2.1 MTT法测定OPFRs的细胞毒性
利用MTT法测定了4种OPFRs分别在0.1~1 000 μmol/L浓度下对PC12细胞的毒性效应,如图1所示.结果表明4种OPFRs在1 000 μmol/L和100 μmol/L浓度下,表现出显著的细胞毒性,而在10 μmol/L、1 μmol/L和0.1 μmol/L浓度下细胞毒性差异均不显著.因此选定10 μmol/L作为进一步细胞代谢组学实验的暴露浓度.
2.2 PC12细胞中代谢物的鉴定
经过GC-MS分析后,得到细胞内代谢物的总离子流图,见附录图S1.经鉴定得到38种胞内代谢物.
2.3 GC-MS数据的多元统计分析
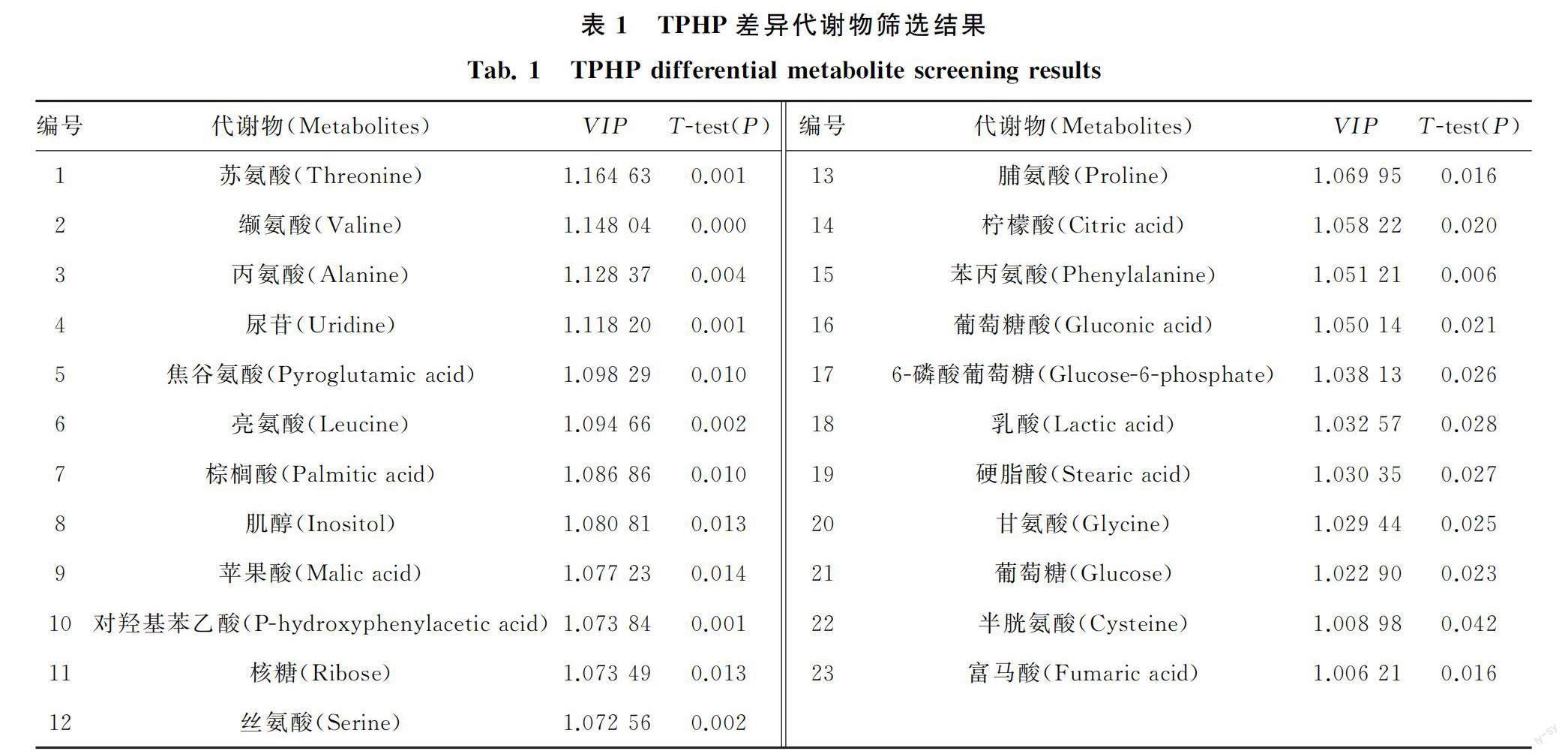
为了分析4种OPFRs对PC12细胞的影响,使用GC-MS对分别暴露于4种OPFRs的细胞进行了非靶向代谢组学分析.得到的数据通过SIMCA软件进行OPLS-DA处理.OPLS-DA模型可以缩小组内差异并最大化区分组间差异[16].该模型的预测参数R2X和R2Y表示对X和Y的解释率,数值越趋近于1表示分析模型越稳定可靠,Q2表示模型的预测能力,在代谢组学的数据分析中,认为Q2>0.5时模型效果较好[17].由图2中OPLS-DA得分图可见,4种OPFRs处理组和对照组的细胞代谢数据集之间均存在显著差异,其中TPHP和CDP处理组和对照组的组间差异显著,RDP和TAP处理组和对照组的组间差异相对较小.由与其对应的S-plot图可见,OPFRs处理组中的VIP值大于等于1(VIP≥1)的代谢物的含量表现出广泛的下调,其中TPHP、CDP和RDP使得PC12细胞中的肌醇、柠檬酸、富马酸、苹果酸和苏氨酸等关键代谢物(重要代谢途径的主要代谢物)的含量降低;TAP在使肌醇、甘氨酸、丙氨酸、苏氨酸等关键代谢物的含量降低的同时,也使柠檬酸、脯氨酸和谷氨酸等关键代谢物的含量升高.
2.4 差异表达代谢物的筛选与分析
根据OPLS-DA模型的结果筛选组间差异表达的代谢物,通过VIP值和独立样本t检验的P值相结合进行筛选,将VIP>1且P>0.05的代谢物作为潜在的生物标志物进行进一步的分析.4种OPFRs的差异表达代谢物信息见表1至表4.
2.5 代谢通路分析
将筛选出的差异表达代谢物通过MetaboAnalyst5.0(https://www.metaboanalyst.ca/)在线进行分析,根据路径富集分析中的P值和路径拓扑分析中的路径影响值显示出所有匹配的代谢通路.本文采用了KEGG数据库,如图3所示,选取主要代谢途径,分析其潜在的作用机制.
3 讨论与结论
由表1至表4可见,4种阻燃剂均使PC12细胞中的肌醇含量下降,从而对磷酸肌醇代谢途径产生了影响.肌醇具有抗氧化功能,可以修复线粒体突变,对神经细胞有一定的保护作用[16].其中结构相近的TPHP、CDP和RDP均对三羧酸(TCA)循环产生了影响,表现为柠檬酸、富马酸和苹果酸的浓度下降.TCA循环在线粒体中发生,是连接细胞合成代谢和分解代谢间的重要桥梁[18].同时乙醛酸和二羧酸代谢途径有助于能量代谢过程中的TCA循环[19],在本研究中这2条代谢通路间存在共同被影响的代谢物柠檬酸.SHARMA等[20]指出TCA循環通过整合中枢代谢物的信号以调节与衰老相关的代谢功能障碍,所以推测有机磷阻燃剂可能促使细胞衰老从而影响细胞的活性和功能,然而其具体机理仍需进一步探究.
TPHP、RDP和TAP处理组与对照组相比,甘氨酸、丝氨酸和苏氨酸代谢通路受到显著干扰.每组中的甘氨酸和苏氨酸的含量都有不同程度的下降.苏氨酸是人体必需的氨基酸,通过膜转运蛋白与甘氨酸和丝氨酸连接,同时,苏氨酸具有促进细胞免疫防御的功能[21].这3种氨基酸还是合成蛋白质、核酸和脂质的必须前体[22].TPHP处理组影响最大的代谢途径为苯丙氨酸、酪氨酸和色氨酸生物合成.苯丙氨酸和色氨酸都是必需氨基酸,苯丙氨酸可以通过苯丙氨酸羟化酶转化为酪氨酸[23].酪氨酸与能量代谢和免疫有关,色氨酸与多种保护功能相关,包括调节氧化应激、免疫反应和炎症[19].在TAP處理组中,丙氨酸、天冬氨酸和谷氨酸代谢;谷氨酰胺、谷氨酸和谷胱甘肽代谢以及精氨酸和脯氨酸代谢均受到影响.与对照组相比,TAP处理组的谷氨酸、脯氨酸和柠檬酸浓度升高.其中,谷氨酸不仅是人体内重要的氨基酸,也是哺乳动物神经系统中含量最多的神经递质,还具有促氧化作用,过高浓度的谷氨酸通过胱氨酸-谷氨酸逆向转运体抑制细胞对胱氨酸的摄取,导致谷胱甘肽水平降低和活性氧积累[24].谷胱甘肽是一种由谷氨酸、甘氨酸和半胱氨酸组成的三肽,作为自由基清除剂,在细胞防御氧化攻击中起关键作用[25].本研究中,用于合成谷胱甘肽的甘氨酸浓度降低,表明PC12细胞的氧化还原状态不平衡.此外有研究表明精氨酸和脯氨酸代谢与多种人类疾病的炎症密切相关,如痛风[26]和肌萎缩侧索硬化症[27],所以该代谢通路的改变也应当被重视.
总之,本工作利用GC-MS代谢组学技术,分析了PC12细胞在4种OPFRs暴露下的代谢表型变化.研究共鉴定出38种小分子代谢物,通过OPLS-DA分析,分别找出了相关的差异表达代谢物,通过对这些差异表达代谢物进行生物信息学分析,发现OPFRs可以影响PC12细胞的TCA循环、磷酸肌醇代谢以及各种氨基酸代谢途径.实验获得的结果有助于揭示磷系阻燃剂的神经毒性.
附录见电子版(DOI:10.16366/j.cnki.1000-2367.2023.07.18.0004).
参 考 文 献
[1] 陈世存,陶芳,丁锦建,等.新型有机磷阻燃剂环境污染物的研究进展[J].环境化学,2021,40(4):949-963.
CHEN S C,TAO F,DING J J,et al.Research progress of emerging organophosphate flame retardants environmental pollutants[J].Environmental Chemistry,2021,40(4):949-963.
[2]杨吉双,张庆合,苏立强.食品中有机磷酸酯阻燃剂检测技术的研究进展[J].色谱,2020,38(12):1369-1380.
YANG J S,ZHANG Q H,SU L Q.Advances in the development of detection techniques for organophosphate ester flame retardants in food[J].Chinese Journal of Chromatography,2020,38(12):1369-1380.
[3]HUANG J N,YE L J,FANG M L,et al.Industrial production of organophosphate flame retardants(OPFRs):big knowledge gaps need to be filled?[J].Bulletin of Environmental Contamination and Toxicology,2022,108(5):809-818.
[4]HOU R,XU Y P,WANG Z J.Review of OPFRs in animals and humans:absorption,bioaccumulation,metabolism,and internal exposure research[J].Chemosphere,2016,153:78-90.
[5]范瑞芳,王丛丛.双酚A暴露致神经细胞凋亡和炎症性死亡的研究进展[J].河南师范大学学报(自然科学版),2022,50(1):12-22.
FAN R F,WANG C C.Research progress of bisphenol A-induced neuronal apoptosis and inflammatory death[J].Journal of Henan Normal University(Natural Science Edition),2022,50(1):12-22.
[6]VAN DER VEEN I,DE BOER J.Phosphorus flame retardants:properties,production,environmental occurrence,toxicity and analysis[J].Chemosphere,2012,88(10):1119-1153.
[7]OLIVERI A N,ORTIZ E,LEVIN E D.Developmental exposure to an organophosphate flame retardant alters later behavioral responses to dopamine antagonism in zebrafish larvae[J].Neurotoxicology and Teratology,2018,67:25-30.
[8]CHEN J Y,LI G Y,YU H,et al.The respiratory cytotoxicity of typical organophosphorus flame retardants on five different respiratory tract cells:which are the most sensitive one?[J].Environmental Pollution,2022,307:119564.
[9]YUAN S W,HAN Y N,MA M,et al.Aryl-phosphorus-containing flame retardants induce oxidative stress,the p53-dependent DNA damage response and mitochondrial impairment in A549 cells[J].Environmental Pollution,2019,250:58-67.
[10]WAZARKAR K,KATHALEWAR M,SABNIS A.Flammability behavior of unsaturated polyesters modified with novel phosphorous containing flame retardants[J].Polymer Composites,2017,38(7):1483-1491.
[11]XIA J,MADEC L,MA L,et al.Study of triallyl phosphate as an electrolyte additive for high voltage lithium-ion cells[J].Journal of Power Sources,2015,295:203-211.
[12]LIU X J,LOCASALE J W.Metabolomics:a primer[J].Trends in Biochemical Sciences,2017,42(4):274-284.
[13]HU L L,LIU J J,ZHANG W H,et al.Functional metabolomics decipher biochemical functions and associated mechanisms underlie small-molecule metabolism[J].Mass Spectrometry Reviews,2020,39(5/6):417-433.
[14]BEALE D J,PINU F R,KOUREMENOS K A,et al.Review of recent developments in GC-MS approaches to metabolomics-based research[J].Metabolomics,2018,14(11):152.
[15]DAI M,MA T,NIU Y,et al.Analysis of low-molecular-weight metabolites in stomach cancer cells by a simplified and inexpensive GC/MS metabolomics method[J].Analytical and Bioanalytical Chemistry,2020,412(12):2981-2991.
[16]YANG W Q,ZHAO F,FANG Y J,et al.1H-nuclear magnetic resonance metabolomics revealing the intrinsic relationships between neurochemical alterations and neurobehavioral and neuropathological abnormalities in rats exposed to tris(2-chloroethyl)phosphate[J].Chemosphere,2018,200:649-659.
[17]张明铭,林源,王中奇,等.基于代谢组学分析Opg基因敲除小鼠骨骼肌萎缩的初步机制[J].解放军医学杂志,2023,48(5):560-569.
ZHANG M M,LIN Y,WANG Z Q,et al.Analysis on the mechanism of skeletal muscle atrophy in Opg gene knockout mice based on metabolomics[J].Medical Journal of Chinese PLA,2023,48(5):560-569.
[18]李易澤,黄敏.代谢调控肿瘤微环境固有免疫应答机制研究进展[J].药学学报,2022,57(9):2622-2641.
LI Y Z,HUANG M.Metabolic regulation of innate immunity in cancer[J].Acta Pharmaceutica Sinica,2022,57(9):2622-2641.
[19]SONG Y Q,HU T T,GAO H,et al.Altered metabolic profiles and biomarkers associated with astragaloside IV-mediated protection against cisplatin-induced acute kidney injury in rats:an HPLC-TOF/MS-based untargeted metabolomics study[J].Biochemical Pharmacology,2021,183:114299.
[20]SHARMA R,RAMANATHAN A.The aging metabolome—biomarkers to hub metabolites[J].PROTEOMICS,2020,20(5/6):1800407.
[21]MALINOVSKY A V.Reason for indispensability of threonine in humans and other mammals in comparative aspect[J].Biochemistry(Moscow),2017,82(9):1055-1060.
[22]WANG H,MCNEIL Y R,YEO T W,et al.Simultaneous determination of multiple amino acids in plasma in critical illness by high performance liquid chromatography with ultraviolet and fluorescence detection[J].Journal of Chromatography B,2013,940:53-58.
[23]CHOU Y J,KOBER K M,YEH K H,et al.A pilot study of metabolomic pathways associated with fatigue in patients with colorectal cancer receiving chemotherapy[J].European Journal of Oncology Nursing,2022,56:102096.
[24]GREENWOOD S M,CONNOLLY C N.Dendritic and mitochondrial changes during glutamate excitotoxicity[J].Neuropharmacology,2007,53(8):891-898.
[25]GRIFFITH O W.Biologic and pharmacologic regulation of mammalian glutathione synthesis[J].Free Radical Biology and Medicine,1999,27(9/10):922-935.
[26]SHEN X,WANG C,LIANG N N,et al.Serum metabolomics identifies dysregulated pathways and potential metabolic biomarkers for hyperuricemia and gout[J].Arthritis & Rheumatology,2021,73(9):1738-1748.
[27]PATIN F,CORCIA P,VOURCH P,et al.Omics to explore amyotrophic lateral sclerosis evolution:the central role of arginine and proline metabolism[J].Molecular Neurobiology,2017,54(7):5361-5374.
Research on the effects of OPFRs on the metabolism of
PC12 cells based on GC-MS
Sun Mengyaoa, Zhao Yafeib, Wang Shaominb, Liu Hongminc
(a. School of Ecology and Environment; b. College of Chemistry; c. Collaborative Innovation Center of New Drug Research
and Safety Evaluation of Henan Province, Zhengzhou University, Zhengzhou 450001, China)
Abstract: This research explored the effects of four organophosphorus flame retardants(OPFRs) on the metabolism of nerve cells(PC12) bases on gas chromatography-mass spectrometry(GC-MS). Firstly, PC12 cells were exposed to various concentrations of four flame retardants, and the concentration that had minimal effect on cell viability was determined by methyl thiazolyl tetrazolium(MTT) colorimetry. Then, the cells were cultured at this concentration, and metabolites were extracted and analyzed by using GC-MS for non-targeted metabolomics. Subsequently, SIMCA software was utilized to perform OPLS-DA analysis on the quantitative metabolic data to discover the significant metabolites impacted by OPFRs in cells. Finally, bioinformatics methods were employed to dissect the pertinent metabolic pathways linked to these key metabolites. A total of 38 small-molecule metabolites were identified in PC12 cells. Multivariate statistical analysis showed that all the four OPFRs affected the metabolic phenotype in PC12 cells. OPFRs showed significant cytotoxicity against PC12 cells at 100 μmol/L and 1 000 μmol/L concentrations. Carbohydrate metabolism and amino acid metabolism were mainly affected in cells.
Keywords: organophosphate flame retardants; metabolomics; GC-MS; PC12 cells
[責任编校 赵晓华 陈留院]

