首批HEK293细胞DNA含量测定国家标准品的制备
王光裕,杨靖清,魏长龙,周泽鑫,杨志行,黄钰,周勇
1.中国食品药品检定研究院药品监管科学全国重点实验室,北京 100050;2.广州派真生物技术有限公司,广东 广州 510670;3.湖州申科生物技术有限公司,浙江 湖州 313000;4.武昌首义学院,湖北 武汉 430064
随着生物医药技术的飞速发展,越来越多的哺乳动物细胞,尤其是连续传代细胞系用于生产疫苗和治疗性生物制品。常用的生产用细胞包括中国仓鼠卵巢细胞(CHO 细胞)、非洲绿猴肾细胞(Vero 细胞)、小鼠骨髓瘤细胞(NS0 细胞)以及HEK293 细胞等,这些传代细胞作为宿主,可能传递与肿瘤或病毒相关的基因,并导致癌变或其他病理变化,存在安全性问题,因此,对其残余DNA 含量需进行严格控制[1]。前期中国食品药品检定研究院已制备并发布了E.coli、CHO 细胞、Vero 细胞以及NS0 细胞DNA 标准品用于宿主DNA 的含量测定,为促进行业同类物质的定值统一发挥了积极作用[2-5]。
近年基因治疗药物发展较快,其中许多以腺相关病毒(adenovirus-associated virus,AAV)为载体的基因治疗药物所用的宿主细胞为HEK293细胞[6],由于以三质粒-HEK293 细胞系统制备的AAV 产品,其产毒过程并非病毒天然的包装方式,病毒衣壳会包裹较多的宿主DNA 片段,因此,对制品中残余宿主DNA 进行检测并制定合理的限度标准显得格外重要,国家药品审评中心与美国FDA 在相关指南文件中建议将宿主残留DNA 控制在10 ng/剂以下[7-8],为了对残余HEK293 细胞DNA 进行准确定量,需建立统一的定量标准物质。基于此,市面上已有多个厂家采用荧光定量PCR 技术,开发了相应的检测试剂盒,但由于各试剂盒中所用的DNA 标准品来源不一,采用不同试剂盒对同一产品进行检测时,定值结果差异较大,不同产品以及同一产品不同批次之间的宿主DNA 定量结果难以比较。为此,本研究研制了1 批HEK293 细胞DNA 含量测定用国家标准品,以期为行业内HEK293 细胞残余DNA 的测定提供支持。
1 材料与方法
1.1 细胞 HEK293细胞来自ATCC(CRL-1573)。
1.2 主要试剂及仪器 基因组DNA提取试剂购自德国QIAGEN 公司(Genomic-tip 500/G);TE 缓冲液(pH 8.0,10 mmol/L)由广州派真生物技术有限公司配制(000002-02);Human残留DNA 检测试剂盒购自中国湖州申科生物技术有限公司(SK030207H100);CF40 细胞工厂购自飞凡应用生物科技(广州)有限公司;紫外可见分光光度计购自日本岛津公司(UV-2700);荧光定量PCR仪分别购自瑞士罗氏公司(Light-Cycler 480)和美国Applied Biosystems 公司(QuantStudio™7 Flex)。
1.3 标准品的制备 取2 支HEK293 细胞种子,复苏后传代5次,转移至3个CF40细胞工厂,当汇合率达85%以上时,将细胞消化并合并到无菌离心杯中。4 ℃,1 500×g离心10 min,弃上清,用预冷的PBS 以相同条件清洗3次,将细胞密度调整为1.1×107个/mL,按10 mL/管分装于50 mL离心管中。
采用Genomic-tip 500/G 试剂盒提取每管细胞DNA,每10 mL 细胞悬液加入10 mL Buffer C1 和30 mL蒸馏水,上下颠倒混匀后冰上放置10 min;4 ℃,1 300×g离心15 min,弃上清,加入2 mL Buffer C1和6 mL蒸馏水,于混匀仪上涡旋,再次4 ℃,1 300×g离心15 min,弃上清,加入10 mL Buffer G2,涡旋30 s 后至完全混匀;加入0.2 mL蛋白酶K,50 ℃孵育60 min,同时将纯化柱放置在管上,加入10 mL Buffer QBT 进行平衡。将孵育结束的裂解液涡旋10 s后,4 ℃,5 000×g离心10 min,将上清转移至纯化柱中至液体完全流出,用15 mL Buffer QC 清洗2 次后,将纯化柱置于干净的离心管中,加入50 ℃预热的15 mL Bu-ffer QF 洗脱DNA。将洗脱液加入10.5 mL异丙醇,上下颠倒后进行DNA沉淀,4 ℃,5 000×g离心15 min,弃上清,加入4 mL 70%乙醇,涡旋后4 ℃,5 000×g离心15 min,弃上清,在洁净工作台中风干10 min;加入TE 缓冲液,55 ℃孵育2 h 溶解DNA。采用紫外分光光度计测定纯化DNA 的浓度和纯度[9],将其中A260/A280在1.8 ~2.0 之间、DNA 浓度大于200 ng/μL 以及经DNA凝胶电泳检测电泳条带单一的管进行合并。
将所有符合要求的DNA 母液混合,3 200 ×g离心5 min,取上清,用TE 缓冲液稀释至浓度约为100 ng/μL,按160 μL/支分装于0.5 mL 无菌可立螺帽管(带O 型垫圈)中,分装量按照2 000 支计划。标准品制备完成后按100支/盒包装,-80 ℃保存。
1.4 标准品的检定 取9 个分装盒中各1 支样品,首先采用紫外分光光度法测定A260和A280值,其中A260值应在0.3 ~0.6 之间;采用A260和A280的比值评估纯度,其比值应在1.8 ~2.0 之间;通过A260值计算含量,依照《中国药典》三部(2020 版)通则3704“外源性DNA 残留量测定法”中公式[10],即:DNA 浓度(μg/mL)=稀释倍数×50×A260,管间浓度相对标准偏差(relative standard deviation,RSD)应小于3.00%。随后进行0.7%琼脂糖凝胶电泳,每个样品电泳条带应保持单一。
1.5 标准品的协作标定 组织5家不同实验室,采用紫外分光光度法对制备的标准品进行协作标定。每家实验室至少测定5 份样品,每个样品测定3 次A260和A280值。其中A260值应在0.3 ~0.6 之间;A260/A280应在1.8 ~2.0 之间;通过A260值计算含量,即:DNA浓度(μg/mL)=稀释倍数×50×A260。
将每家实验室测得的实际浓度汇总,结果统一保留至小数点后2 位,带入1.4 项中公式进行计算,将计算后的原始浓度结果经Jarque-Bera检验进行统计分析,并求出加权均值、RSD、可信区间、参考值范围及平均可信限率。
1.6 标准品的稳定性分析 将制备的标准品分别于不同温度(-80、-20、4、25、37 ℃)下储存2、6、8 周后,分别进行紫外浓度测定及DNA凝胶电泳纯度分析。
1.7 标准品的适用性分析 分别使用罗氏和Applied Biosystems 荧光定量PCR 仪对制备的HEK293细胞DNA 国家标准品进行荧光定量PCR 检测,确定线性范围和定量限。用TE 缓冲液将DNA 标准品稀释至300 pg/μL 作为起始浓度,再进行4 次10 倍稀释至0.03 pg/μL,共5个稀释度,每个稀释度设3个复孔,以其为模板进行荧光定量PCR 反应,引物探针及反应mix均采用湖州申科生物技术有限公司试剂盒,反应总体积30 μL,其中模板上样量10 μL。扩增程序如下:95 ℃10 min;95 ℃15 s,60 ℃1 min,共40个循环。每个循环在60 ℃退火时采集信号。
1.8 数据采集及分析 标准品制备过程中质量评价、协作标定和适用性验证结果作图采用GraphPad Prism 5.01 软件;协作标定数据统计分析采用PTP/RMP软件(版本号:BMV V1.0;2021-1030)。
2 结果
2.1 标准品的质量 抽提的110 管HEK293 细胞基因组DNA 浓度和A260/A280见图1,筛选DNA 浓度大于200 ng/μL 且A260/A280在1.8 ~2.0 之间的管,共得到104 管。0.7%琼脂糖凝胶电泳分析显示,各条带均一,见图2。
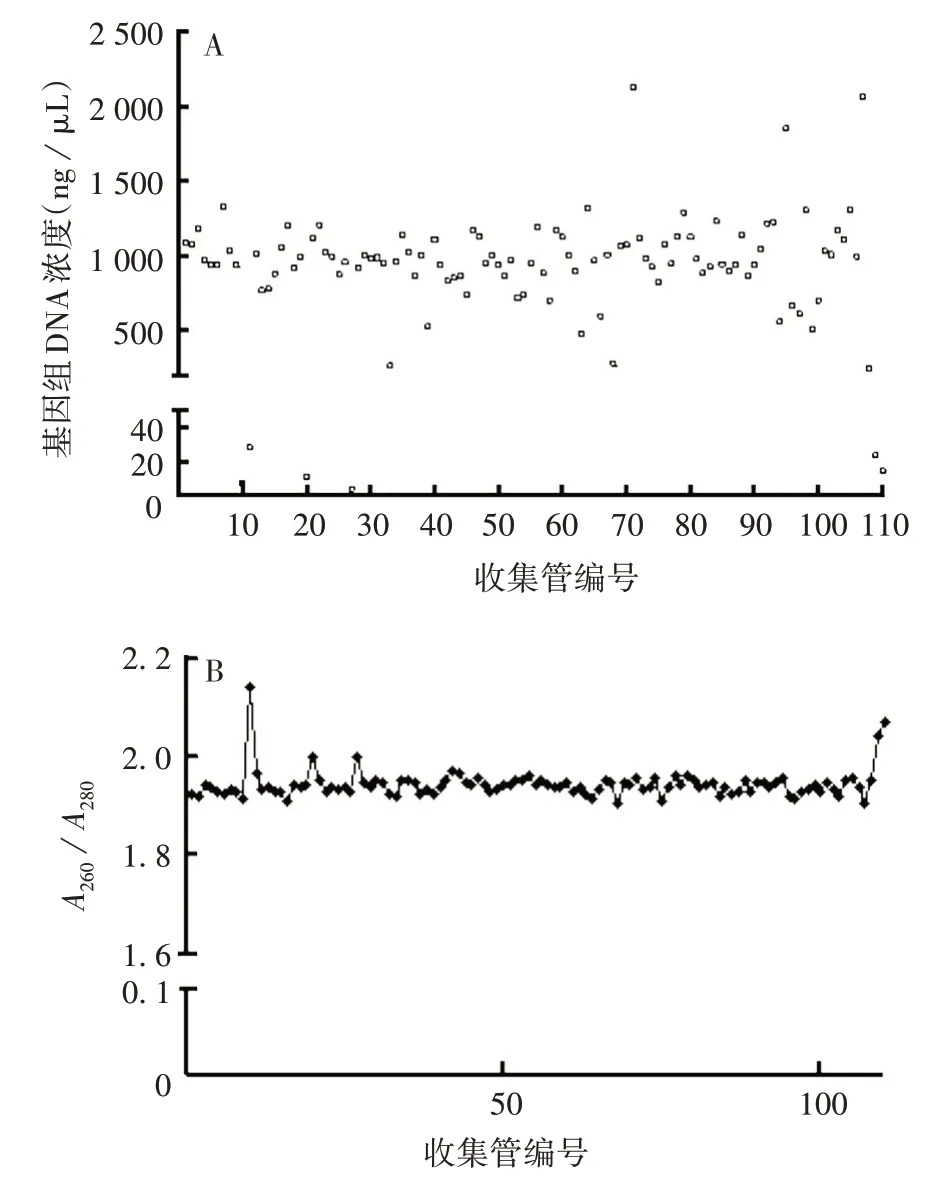
图1 紫外分光光度法测定HEK293细胞DNA 浓度(A)及A260/A280(B)结果Fig.1 Determination of DNA concentration(A)and A260/A280(B)in HEK293 cells using UV spectrophotometry

图2 抽提的HEK293细胞DNA琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis results of DNA extracted from HEK293 cells
2.2 标准品的检定 不同分装盒中的9 支样品紫外浓度的RSD为1.6%,纯度(A260/A280)的RSD为0.6%,见表1。9支样品电泳条带均一,见图3。
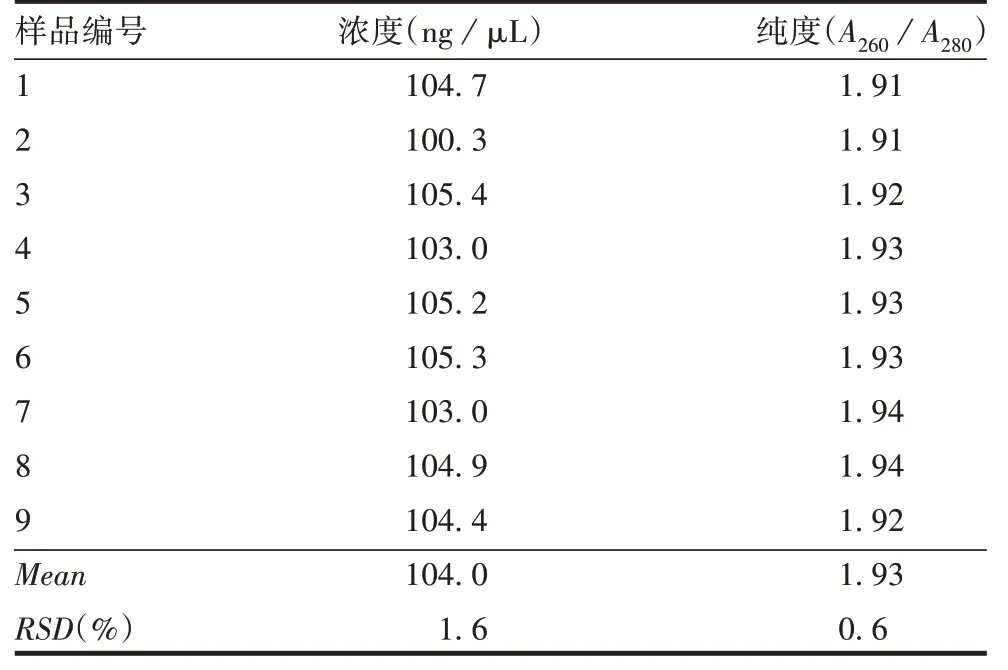
表1 HEK293细胞DNA浓度与纯度检定结果Tab.1 HEK293 cell DNA concentration and purity results

图3 HEK293细胞DNA琼脂糖凝胶电泳检定结果Fig.3 DNA agarose gel electrophoresis results of HEK293 cells
2.3 标准品的协作标定 共得到78 个有效浓度结果,见表2。经Jarque-Bera检验,P>0.05,具备正态性,在PTP/RMP 软件中计算其加权平均值为104.8 ng/μL,RSD为4.2%,均数的95%可信区间为103.8 ~105.8 ng/μL。单次测定的95%参考值范围为96.0 ~113.6 ng/μL,平均可信限率(%)=t(77)0.05× 标准误/均数× 100% = 1.0%。5 家实验室协作标定结果分析见图4。

表2 HEK293 细胞DNA 含量测定国家标准品协作标定结果(ng/μL)Tab.2 Collaborative calibration results of national reference standard for HEK293 cell DNA content determination(ng/μL)

图4 HEK293 细胞DNA 含量测定国家标准品协作标定结果分布图Fig.4 Distribution diagram of collaborative calibration results of national reference standard for HEK293 cell DNA content determination
2.4 标准品的稳定性 凝胶电泳法纯度检测结果显示,在4 个温度条件下保存8 周,基因组DNA 未发生明显降解,见图5。但随着温度升高与保存时间的延长,标准品DNA 浓度呈升高趋势,即使-20 ℃保存,8 周后测定结果也出现偏高的情况,而-80 ℃保存样品含量测定结果稳定,见表3。因此推荐保存条件为-80 ℃。

表3 不同温度保存条件下浓度测定结果(ng/μL)Tab.3 Content determination results under different temperature storage conditions(ng/μL)
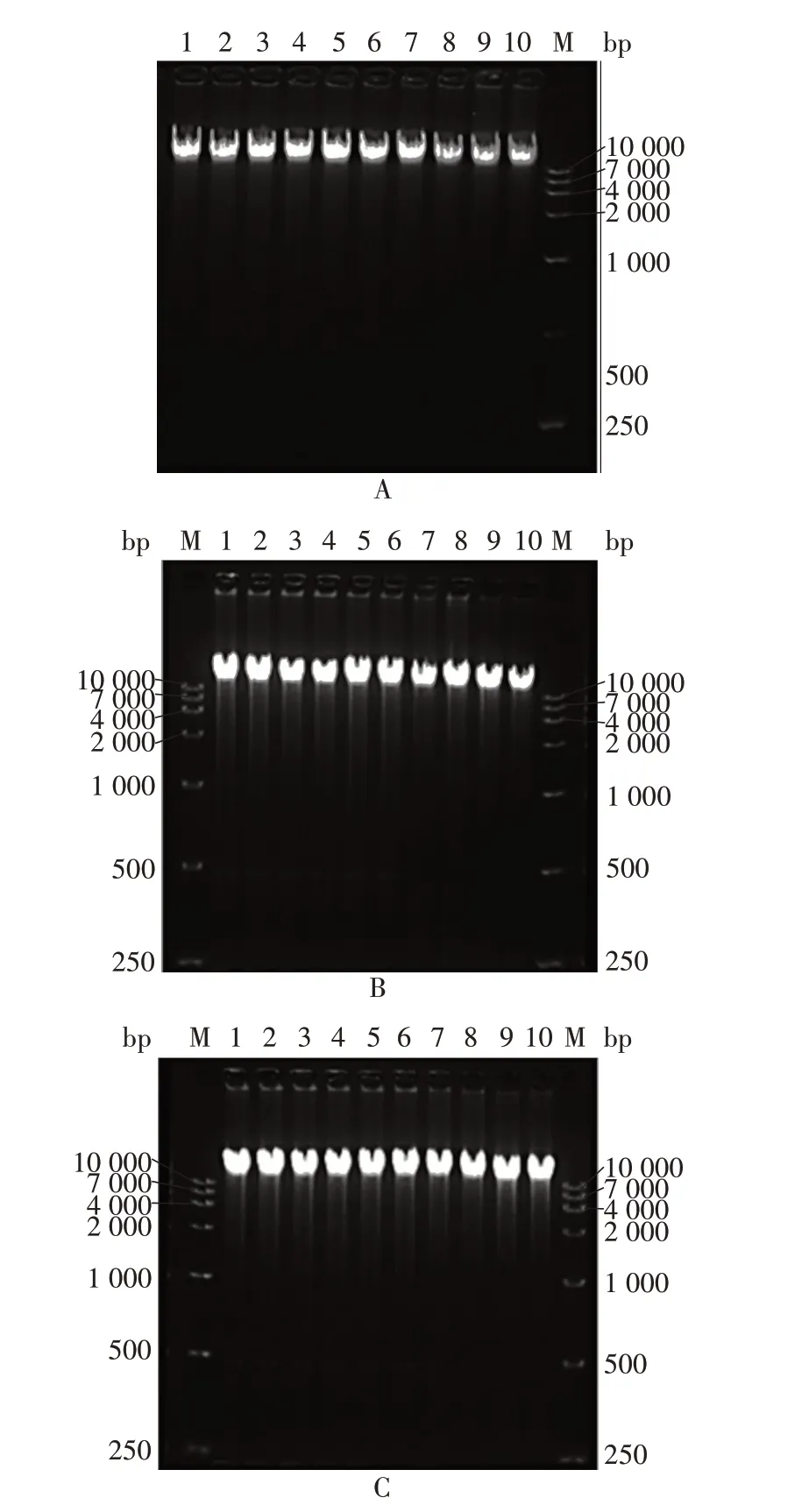
图5 不同温度保存条件下凝胶电泳结果Fig.5 Results of gel electrophoresis under different temperature storage conditions
2.5 标准品的适用性 分别使用罗氏和Applied Biosystems 荧光定量PCR 仪对制备的DNA 标准品进行荧光定量PCR测定,在0.3 ~3 000 pg/反应范围内扩增曲线平滑,见图6。标准曲线见图7,采用罗氏仪器时,斜率为-3.295,扩增效率为101%,R2为0.999 2;采用Applied Biosystems 仪器时,斜率为-3.439,扩增效率为95%,R2为0.999 5。表明标准品适用性良好。
3 讨论
宿主细胞DNA残留具有生物安全风险,重组AAV制品多采用HEK293 细胞制备,需对其定量控制。目前不同实验室的qPCR 方法结果差异较大,其中重要原因就是缺少统一的DNA 标准物质。基于以上背景,本研究以HEK293 细胞基因组DNA 为原料,成功制备了我国首批HEK293 细胞DNA 国家标准品。通过紫外分光光度法和琼脂糖凝胶电泳分析,该标准品的纯度符合要求。经5 家实验室共同完成协作标定,该标准品的平均含量为104.8 ng/μL,RSD为4.2%,均数的95%可信区间为103.8 ~105.8 ng/μL。单次测定的95%参考值范围为96.0 ~113.6 ng/μL,平均可信限率为1.0%。该标准品的批号为270039-202301。加速热稳定性试验结果显示,在-80 ℃条件下,该标准品能够长期保持稳定性,后续将继续进行长期稳定性考察。采用荧光定量PCR 法对该标准品进行适用性研究,结果表明,其能够满足要求,适用性良好,可用于HEK293细胞DNA含量的定量检测。

