地衣素合成酶关键模块 LchAD 蛋白的性质和功能研究
杨伟杰 杨周林 朱浩东 魏煜 刘君,2 刘训
(1.四川轻化工大学生物工程学院,宜宾 644000;2.酿酒生物技术及应用四川省重点实验室,宜宾 644000)
地衣素(lichenysin)是由7 位氨基酸多肽和羟基脂肪酸形成的环脂肽化合物,具有一定的抗肿瘤[1]、抗病毒[2]、抗炎[3]、抗癌[4]等活性,对白酒风味形成有促进作用[5-6]。地衣素可由地衣芽孢杆菌[7](Bacillus licheniforms)以葡萄糖为底物,经过非核糖体多肽合成酶(nonribosomal peptide synthetase, NRPS)催化合成(图1‑A),NRPS 在地衣素合成途径中被称为地衣素合成酶。已发现的地衣素生物合成过程如图1‑B 所示,腺苷化(adenylation,A)结构域激活氨基酸,各氨基酸在硫酯化(thiolation,T)结构域的运输下,在缩合(condensation, C)结构域上形成肽键,形成的多肽链-脂肪酸链复合体在硫脂酶(thioesterase, TE)结构域的作用下环化并释放出地衣素[8]。地衣素合成酶含有一个单独的模块,硫酯酶模块LchAD 蛋白。LchAD 蛋白可作为载体,将β-脂肪酸运送到地衣素合成酶的第一个C结构域[9],与谷氨酰胺(glutamine, Gln)结合以保证多肽链和脂肪酸链的连接,为后续环化提供基础(图1‑B)。LchAD 蛋白可能参与编辑修正错误激活的氨基酸,确保地衣素合成酶行使正常功能,从而保证地衣素的正确合成[8]。由此可见,LchAD 蛋白对地衣素的产生和产量具有较大影响。因此,研究LchAD 蛋白的性质和功能将对深入解析地衣素生物合成途径具有重要理论意义,同时对地衣素的工业生产及应用具有一定促进作用。
LchAD 蛋白属于II 型硫酯酶(type II thioester‑ase, TE II),该类型硫酯酶属于α/β 水解酶超家族,含有保守的催化三元件(Ser‑His‑Asp),具有水解、环化和释放的功能[10]。但有文献指出并不是所有的TE II 都含有同样的催化三元件,在某些TE II 中Ser残基会被Cys 残基所替代,从而导致TE II 酶活降低[11]。NRPS 参与多种微生物次生代谢产物的合成,其关键模块TE II 影响着多种非核糖体多肽类物质的合成和产量。研究发现,在万古霉素(vancomycin)生物合成过程中,肽链只有在TE II 的氧化修饰下,才能形成生物活性肽[12]。Schneider 等[13]通过删除编码表面活性素(surfactin)生物合成酶的TE II,导致表面活性素产量减少84%。Wu 等[14]研究发现在卡西霉素(calcimycin)生物合成过程中,TE II 的失活能导致其前体物质产量下降。同样,Kotowska等[15]报道了TE II 的失活导致非核糖体多肽类物质Coelimycin 的生物合成无法继续。这些研究结果表明,TE II 直接参与了多种非核糖体多肽类物质的生物合成,且能对这些物质的生物合成产生不同程度的影响。
截至目前,已有多种TE II 蛋白晶体被成功解析,例如来自合成利福霉素(rifamycin)途径中的RifR蛋白晶体[16]、参与合成表面活性素的SrfD 蛋白晶体[9]和灵菌红素(prodiginine)合成途径中的RedJ蛋白晶体[17]。研究发现TE II 蛋白具有多种构象,构象的变化使其能与其他结构域相互作用,从而发挥生物学功能。此外TE II 蛋白还具有灵活的盖子结构(lid structure),可以通过改变活性位点的大小和形状来控制底物的进入[18]。然而,对地衣素合成途径中的关键模块LchAD蛋白的相关研究还未见报道。
本研究为探究地衣素合成途径中关键模块LchAD 蛋白的性质和功能,首先从酿酒大曲中筛选地衣素产生菌,对其进行鉴定和命名,并以其基因组DNA 为模板克隆LchAD 基因,随后探究LchAD蛋白异源表达及纯化的最适条件,最后利用生物信息学在线软件分析其性质和功能,旨在为地衣素生物合成途径的进一步解析奠定基础。
1 材料与方法
1.1 材料
大曲样品取自于四川某酒厂(2022 年5 月)。蛋白胨、牛肉膏、氯化钠、琼脂、明胶、过氧化氢、磷酸二氢钠、无水乙醇、硝酸钾、葡萄糖、可溶性淀粉、番红试剂、溴麝香草酚蓝、α-萘酚、碘、碘化钾等试剂均为分析纯,购自上海源叶生物科技有限公司。限制性内切酶Xho I、BamH I、T4 连接酶,购自大连宝生物公司。细菌DNA 抽提试剂盒购自全氏金生物有限公司。
牛肉膏蛋白胨培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,pH 7.0-8.0。明胶液化培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,明胶120,pH 7.2-7.4。V‑P 半固体培养基(g/L):蛋白胨12,酵母浸粉1,葡萄糖10,NaCl 5,琼脂3,pH 7.0-7.5。葡萄糖发酵培养基(g/L):酵母浸粉5,蛋白胨10,NaCl 10,葡萄糖10,pH 7.0-8.0。淀粉培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5,可溶性淀粉2,琼脂15-20,pH 7.0-8.0。Cooper 培养基[19](g/L):葡萄糖25,NH4NO34,KH2PO44.082 7,Na2HPO45.68,MgSO4·7H2O 0.197 2,CaCl20.000 8,Na2‑EDTA 0.001 5,pH 7.2-7.4。
1.2 方法
1.2.1 大曲中芽孢杆菌的筛选 称取10 g 大曲样品,加入已灭菌的生理盐水90 mL,在37℃、180 r/min 条件下富集30 min,随后在85℃水浴中处理15 min[20]。参照梁慧珍等[21]方法进行菌株筛选,获得纯种后,冷藏菌株并编号。
1.2.2 菌株发酵产物的检测 液态发酵:制备种子液,使其OD600值为0.8-1.0 时。将种子液按体积分数3%的接种量接种到Cooper 发酵培养基中,摇床37℃,250 r/min 培养72 h。
发酵产物的提纯:将发酵液离心20 min(8 000 r/min),收集上清液,用6 mol/L 的HCl 调节上清液的pH 至2.0,4℃过夜放置。8 000 r/min 离心20 min收集沉淀,用30 mL 甲醇分3 次浸提沉淀物[22],均在4℃浸提4 h。收集浸提液用0.22 μm微孔滤膜过滤。保存样品用于一级质谱和二级质谱的检测。
发酵产物的检测:目标物质在正级模式下检测,检测条件:DP 167 V,EP 6.9 V,CE 40 V,针泵流速0.07 mL/min,扫描范围:一级质谱100-1 100 Da,二级质谱100-1 000 Da。
1.2.3 生理生化实验鉴定 过氧化氢酶实验、硝酸盐还原实验、糖醇发酵实验、接触酶测试、淀粉水解实验、V‑P 实验和明胶液化实验采用王成俊等[23]方法。
1.2.4 分子生物学鉴定 使用27F/1492R 通用引物对菌株基因组进行PCR 扩增,扩增片段送至成都擎科有限公司进行测序。测序序列在NCBI 数据库中BLAST 比对后,选择相似度高的菌株序列,采用MEGA 7 软件的Neighbor‑joining 法(bootstrap=1 000)建立系统发育树,确定菌株YC7 的种属[24]。
1.2.5 LchAD 基因的克隆和重组质粒的构建
(1)基因克隆。使用primer primer 5 软件设计引物,送至成都擎科有限公司合成,上游引物:5'‑CGGATCCATGAACGAGATCATTAAGCA‑3',下 游引物:5'‑CCTCGAGACACACCGATTTTCCGTT‑3'。以筛选的地衣素产生菌基因组DNA 为模板进行PCR扩增。
(2)重组质粒的构建。将克隆的LchAD 基因和载体pET‑28a 分别进行双酶切(Xho I 和BamH I),随后过夜连接,转入大肠杆菌(Escherichia coli)DH5α 感受态细胞,具体参照Ngo 等[25]方法。
1.2.6 LchAD 蛋白的异源表达与纯化 制备含有重组质粒的E.coli BL21(DE3)菌悬液,OD600在0.6-0.8 时,加入IPTG(终浓度为100 μg/mL)诱导表达,20℃,180 r/min 诱导16 h。收集菌体,超声破碎细胞壁,收集上清液,用镍柱进行纯化。使用不同浓度的咪唑洗脱杂蛋白。具体参照Ngo 等[25]方法。
1.2.7 生物信息学分析 利用Prot Param 预测LchAD 蛋白的理化性质;NCBI Conserved Domain 在线软件预测LchAD 蛋白的保守结构域;Prot Scale在线软件对LchAD 蛋白进行亲疏水性的分析;利用在线网站(https://services.healthtech.dtu.dk/service.php?SignalP‑5.0)对LchAD 蛋 白 进 行 信 号 肽 的 预测;利用SOPMA 进行二级结构分析与预测;利用SWISS‑MOOEL 和Alpfold 开源数据库进行三级结构预测[26]。
2 结果
2.1 菌株的筛选
从大曲样品中筛选获得3 株纯种菌株,编号为YC1、YC2 和YC7,各菌株的菌落形态描述见表1。

表1 菌落形态Table 1 Colony morphology
2.2 质谱鉴定
对3 株菌株进行质谱检测发现,只有菌株YC7有地衣素结构离子峰。一级质谱结果(图2)显示,图中出现了m/z 为1 007.4、1 021.5 和1 035.4 的离子峰,分别对应地衣素同系物的质子化峰。同时出现了m/z 是1 029.3、1 043.4 和1 057.4 的离子 峰,分别是1 007.4、1 021.5 和1 035.4 相应的[M+Na]+峰。因此,推测菌株YC7 发酵产物中有地衣素的同系物。于是对1 007.4、1 021.5 和1 035.4 离子峰进行ms/ms 分析以期确认其主成分的结构。
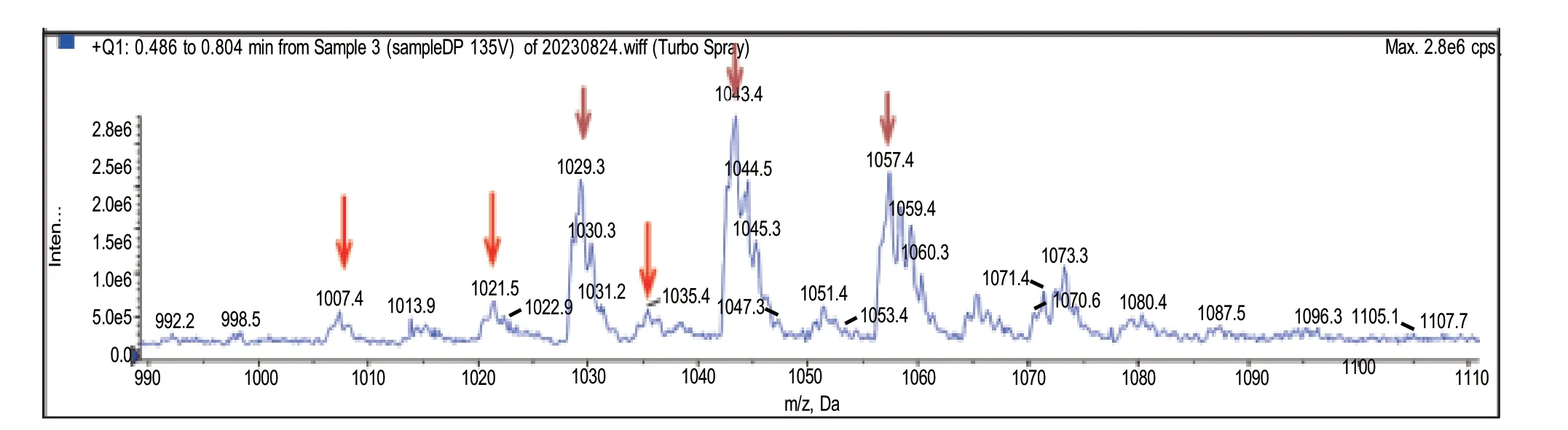
图2 一级质谱图Fig.2 Primary mass spectrogram
ms/ms 分析图谱(图3‑A)显示,m/z 为1 007.4的离子峰有两种类型的碎片离子,一种是发生简单断裂形成的片段[M+H]+峰,如m/z 是337.2、468.1、581.2 和680.2 等, 这 些 特 征 值 与 图3‑B中[C14‑lichenysin+H+]的理论值b2、a3、a4 和a5相吻合;另一种是双氢转移(double H transfer)断裂机制,即脂肽物质的内酯结构在断裂时,脂肪酸链上的两个氢原子转移到羟基端的氨基酸残基上(图3‑C),使C 端残基的分子量比简单的酰胺键断裂产生的碎片质量少18(即少一个H2O),如m/z为355.3 的离子峰可以表示为[C14‑OH‑Gln+H+]片段,符合地衣素D 断裂后的理论值。在图3 中还有一个主要的碎片离子是m/z 为671.1,其产生的原因是位于第7 位的Val 发生双氢转移断裂产生的特征碎片离子,且ms/ms 的检测结果与图3‑C 中[C14‑lichenysin+H+]的理论值相符合,所以推断此部分是脂肪酸链为14 个C 的地衣素G。从m/z 为1 021.5的离子峰结果可以看出,有m/z 为685.2 和337.3 的离子峰,符合地衣素A 断裂产生的特征峰(附图1)。另外,分析m/z 为1 035.4 的离子峰结果发现,有m/z 为685.0 的特征峰,该值与附图2 中脂肪酸链碳原子为15 的地衣素理论值相符。以上结果表明菌株YC7 为地衣素产生菌。
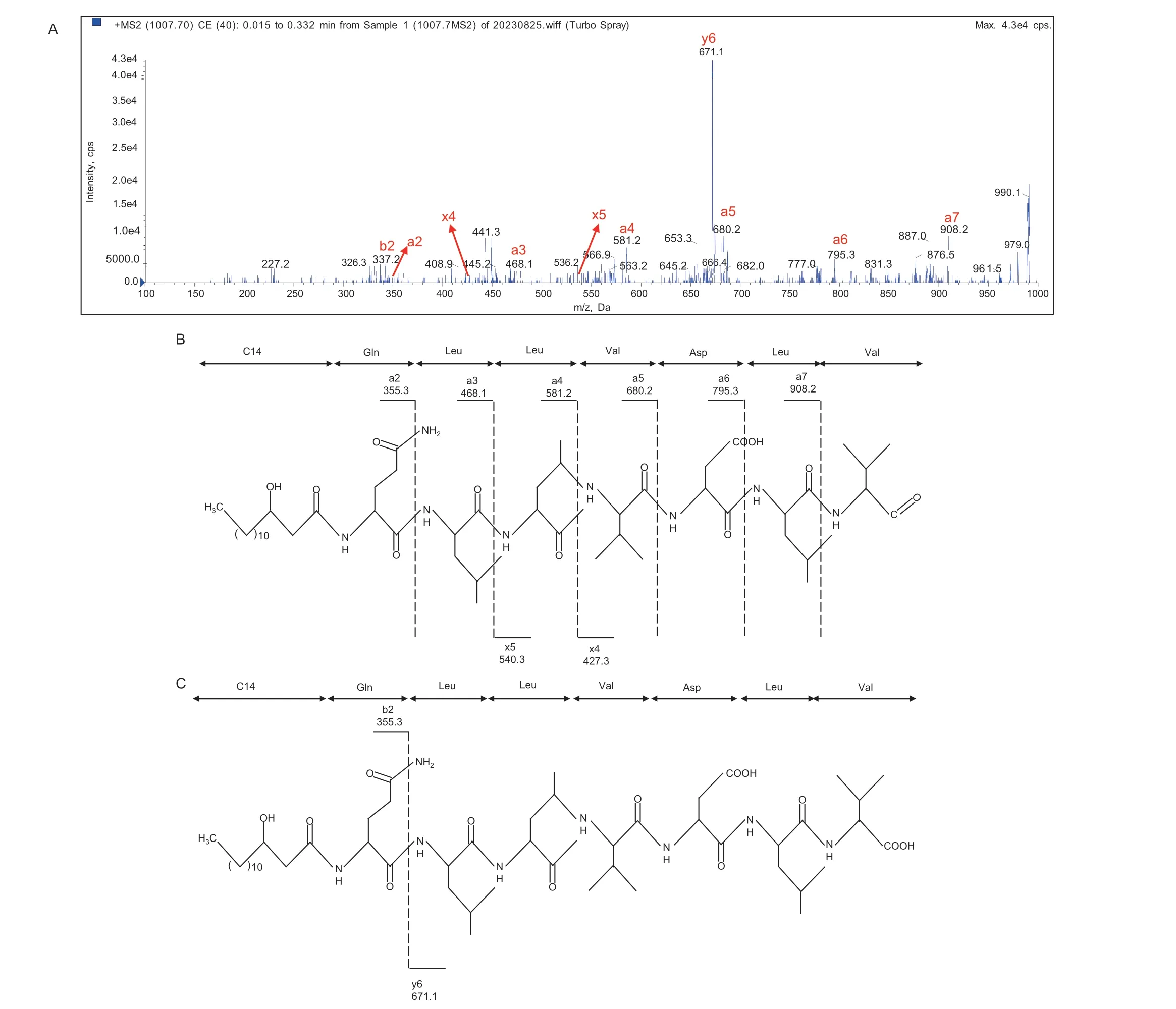
图3 m/z 为1 007.4 离子峰的二级质谱图(A)及该离子峰发生简单断裂(B)和发生双氢转移断裂(C)产生的特征离子碎片理论值Fig.3 Secondary mass spectrometry of ion peak with m/z of 1 007.4(A)and theoretical values of characteristic ion fragments generated by simple cleavage(B)and double hydrogen transfer cleavage(C)of this ion peak
2.3 菌株的鉴定
2.3.1 生理生化鉴定结果 由表2 可知,菌株YC7为革兰氏阳性菌,芽孢椭圆形,兼性厌氧,化能异氧型,葡萄糖产气阴性,接触酶、葡萄糖产酸、淀粉分解、V‑P 实验及明胶分解均为阳性。
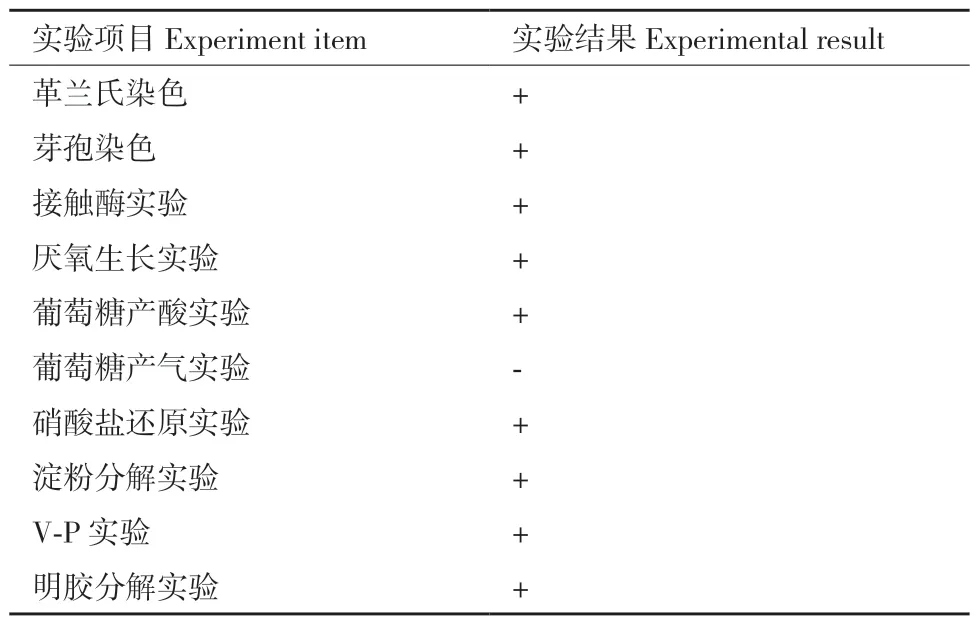
表2 生理生化结果Table 2 Physiological and biochemical results
2.3.2 分子生物学鉴定结果 利用通用引物27F/1492R 扩增获得菌株YC7 的16S rDNA,测序比对后发现,菌株YC7 与Bacillus licheniformis strain DSM13的16S rDNA 序列相似度为99.65%。下载10 株不同种的标准菌株的序列,使用软件MEGA 7 构建系统进化树。结果(图4)显示,菌株YC7 与Bacilluslicheniformis strain DSM13 的自展值为89,故菌株YC7 被命名为地衣芽孢杆菌YC7 并用于后续实验。
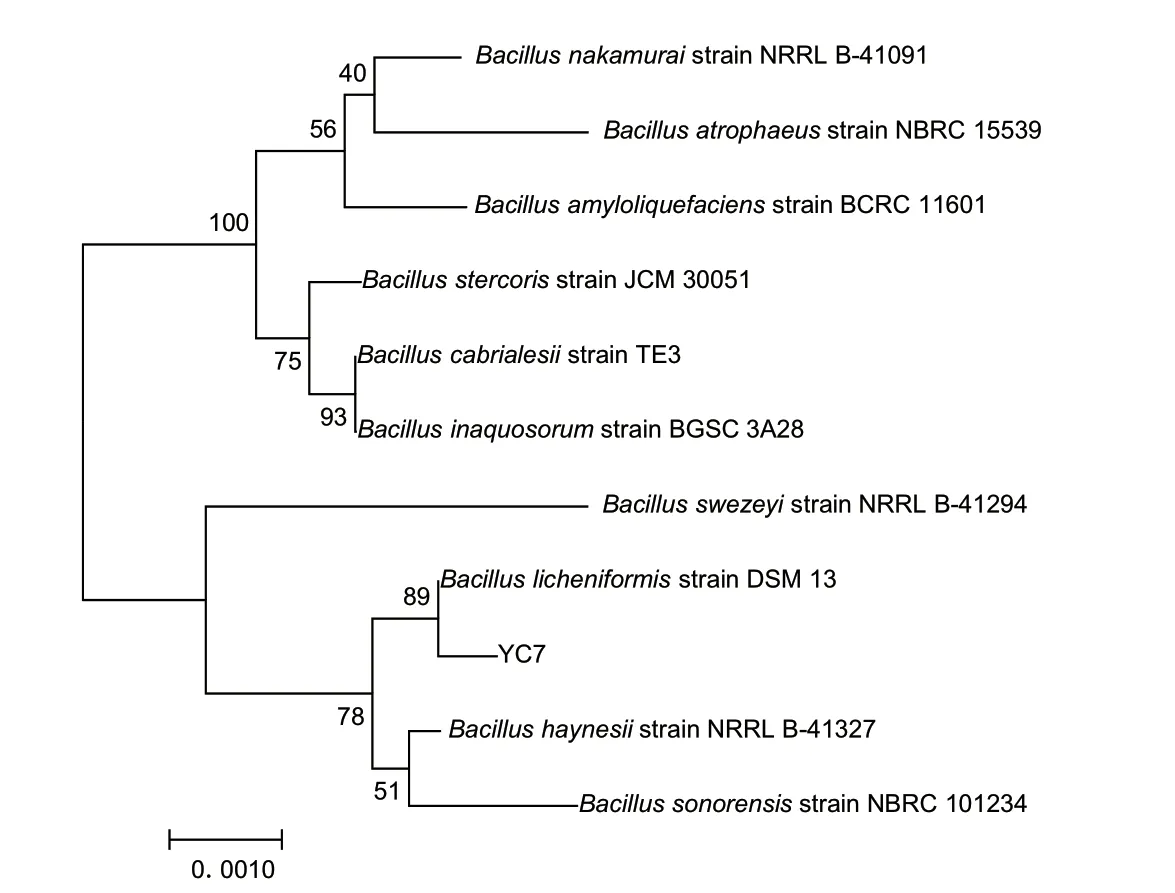
图4 菌株YC7 的系统进化树Fig.4 Phylogenetic tree of strain YC7
2.4 LchAD蛋白的异源表达及纯化结果
重组质粒pET‑28a‑LchAD 双酶切后,电泳结果显示有两条清晰条带(图5‑A)。其中一条条带的大小为750 bp 左右,与LchAD 基因大小一致;另一条条带大小为5 000 bp 左右,与pET‑28a 载体大小一致,双酶切结果说明重组质粒构建成功。在温度为20℃,IPTG 终浓度为100 μg/mL 的条件下,重组质粒pET‑28a‑LchAD 在E.coli 中的表达结果如图5‑B所示,目的蛋白条带在27.62 kD 左右。同时,在泳道1 和2 中未见有目的蛋白,而在泳道3、4 和5 中均出现目的蛋白,该结果说明,在此条件下能成功诱导LchAD 蛋白表达,且能形成可溶性蛋白。在使用不同浓度咪唑洗脱杂蛋白的实验中发现,在咪唑浓度为250 mmol/L 时能最大程度洗脱杂蛋白,获得比较纯的目的蛋白(图5‑C)。
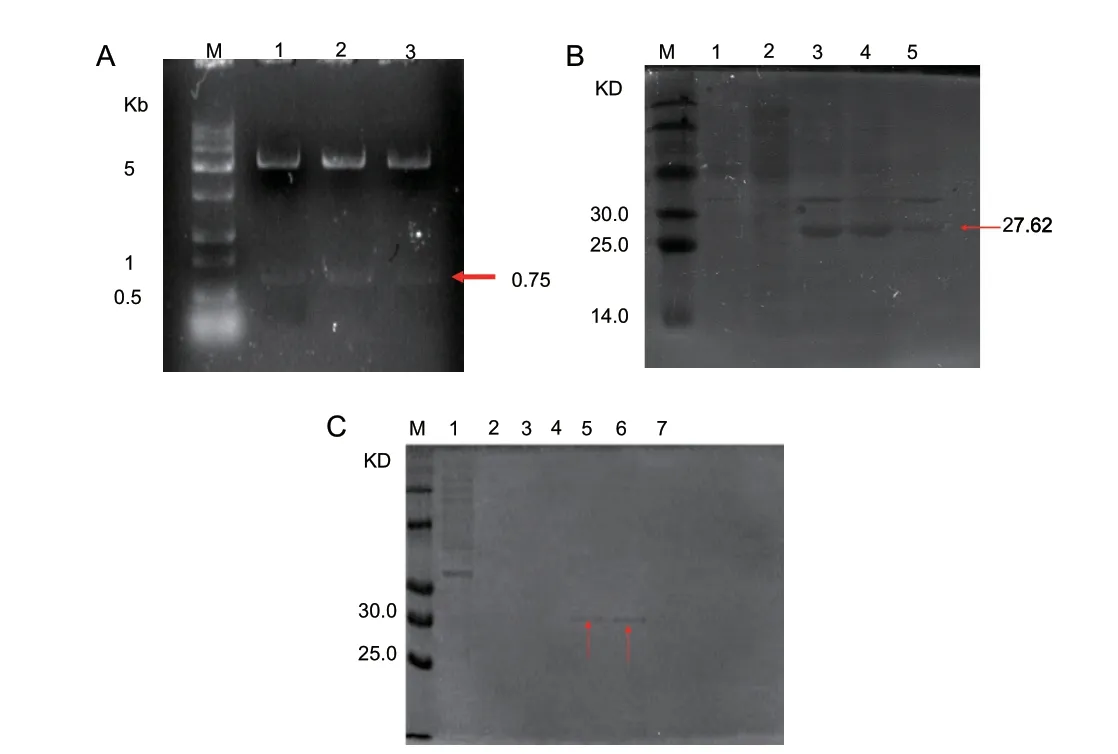
图5 重组质粒pET-28a-LchAD 双酶切(A)和 LchAD 蛋白表达(B)及纯化(C)结果Fig.5 Results of double digestion of recombinant plasmid pET-28a-LchAD(A)and LchAD protein expression(B)and purification(C)
2.5 生物信息学分析结果
2.5.1 LchAD 蛋白理化性质预测 Prot Param 预测该蛋白质的分子质量约为27.62 kD,理论等电点(pI)为7.23;氨基酸序列由20 种氨基酸组成,其中丙氨酸(Ala)占比最高达到10.6%,亮氨酸(Leu)占比次之达到10.2%,色氨酸(Trp)和半胱氨酸(Cys)占比最少分别是0.8%和1.2%;带负电荷残基(Asp+Glu)总数和带正电荷残基(Arg+Lys)的总数相同均为26;其分子式为 C1243H1929N341O345S14,总原子数是3 872;同时该蛋白的不稳定指数为36.03,属于稳定蛋白;脂肪系数(aliphatic index)为83.01。
2.5.2 LchAD 蛋白的保守结构域、亲疏水性和信号肽预测 使用NCBI Conserved Domain 在线软件预测LchAD 蛋白的保守结构域(图6‑A)发现,LchAD蛋白的氨基酸序列只有一个GrsT 保守结构域,说明LchAD 属于GrsT 基因家族;使用Prot Scale 在线软件对LchAD 基因进行亲疏水性分析,结果如图6‑B所示,最大的位点是108 号位点,疏水值是2.156,最小的位点在125 和126 号位点,亲水值均为‑2.511,其中亲水性的位点多于疏水性的位点,所以推测该蛋白是亲水性蛋白。根据在线软件的预测,LchAD蛋白存在信号肽的可能性为0.028 4(图6‑C)。
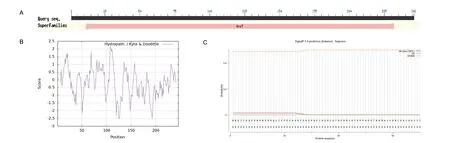
图6 LchAD 蛋白的保守结构域(A)、亲疏水性(B)和信号肽(C)预测Fig.6 Prediction of conserved domain(A), hydrophilicity and hydrophobicity(B)and signal peptide(C)of LchAD protein
2.5.3 LchAD 蛋白的二级和三级结构预测 利用SOPMA 软件预测LchAD 蛋白的二级结构(图7‑A)。LchAD 蛋白中α-螺旋(Hh)占比43.5%,β-折叠(Ee)占比13.82%,β-转角(Tt)占比5.69%,无规则卷曲(Cc)占比36.99%。在该蛋白中α-螺旋、β-折叠和β-转角总量占比63.01%,由此说明该蛋白可能比较稳定。
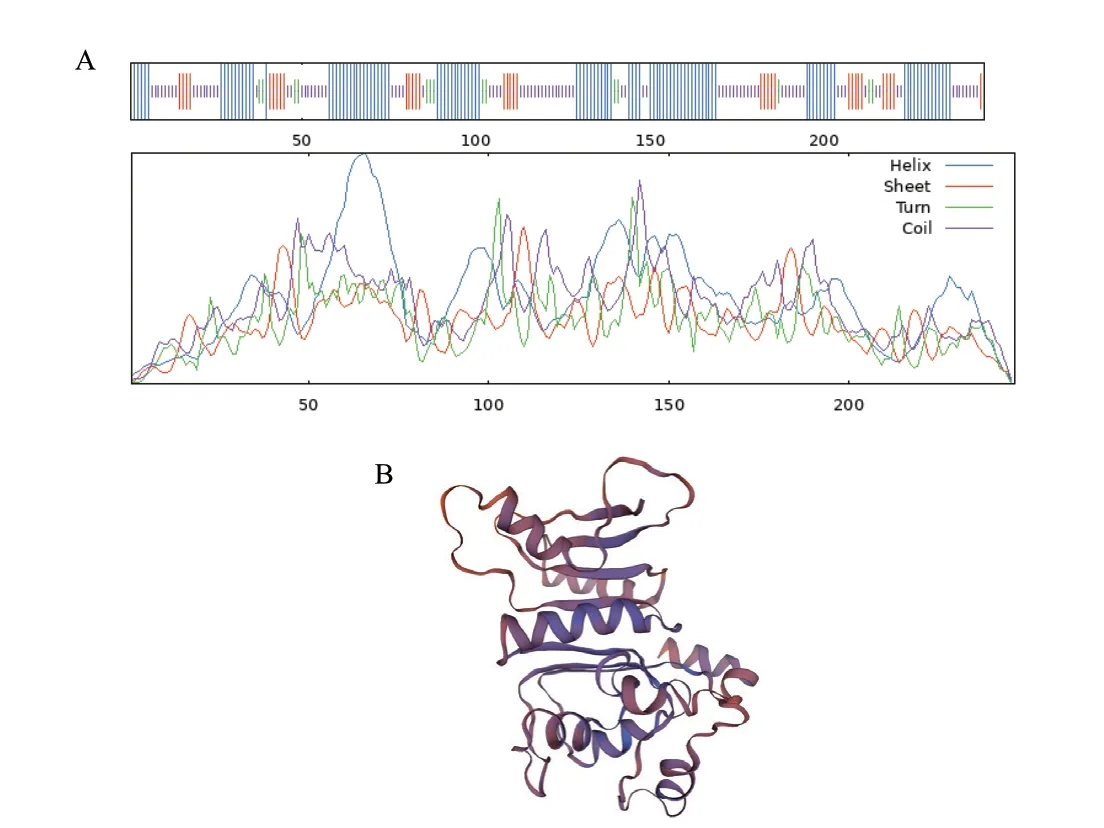
图7 LchAD 蛋白的二级结构(A)和三级结构(B)预测结果Fig.7 Predicted results of secondary structure(A)and tertiary structure(B)of LchAD protein
采用SWISS‑MODEL 服务器和Alaphfold 开源数据库对LchAD 蛋白的三级结构进行预测,SWISS‑MODEL 服务器共预测出一致度大于30%的模型有6种,最高的一致度为94.31%,但是该UniProtKB 条目未知,很可能已过时,其次是一致度为63.52%的模型,该模型来自于表面活性素合成酶的硫脂酶模块(surfactin synthetase thioesterase subunit),此结果与Alaphfold 开源数据库预测结果一致,该蛋白预测的模型如图7‑B 所示。在预测模型图中可观察到较多的α-螺旋与β-折叠,说明该预测结果与二级结构预测结果相符。
3 讨论
TE II 蛋白在非核糖体多肽类物质的生物合成中发挥着重要的生理功能[18]。研究表明,TE II 的失活将影响多种非核糖体多肽类物质的生物合成量,例如TE II 失活导致卡西霉素生物合成的前体物质产量下降[14];在非核糖体多肽类物质Coelimycin 的生物合成过程中,TE II 失活直接导致其合成无法继续[15]。
地衣素生物合成酶的关键模块LchAD 蛋白属于TE II 家族[27-28],在地衣素生物合成中发挥着重要作用[8-9]。截至目前,对LchAD 蛋白的研究还相对较少。为探究该蛋白的性质和功能,本研究参照钟桂芳等[20]方法从酿酒大曲中筛选目标菌株,筛菌处理条件为85℃水浴15 min,最终获得3 株菌株。所获得的菌株数量与已报道的多数筛菌实验的结果有差异[29-31]。但该结果与明红梅等[32]报道的结果相似,其筛菌处理条件为80℃水浴10 min,获得4 株菌株。本研究所采用的水浴处理温度和时间对于多数微生物来说相对苛刻,但有利于获得目标菌株。筛选菌株的发酵产物经质谱串联方法检测,在菌株YC7 的发酵产物中出现m/z 为1 007.4、1 021.5 和1 035.4 的离子峰。该检测结果与Rønning 等[33]的结果相比,缺少m/z 为996.3 的离子峰,但二者所使用的菌株不同,可能是导致最终发酵产物中所含地衣素同系物不完全一致的原因。因此,确认菌株YC7 为地衣素产生菌。
研究发现TE II 蛋白在大肠杆菌中异源表达较易形成可溶性蛋白,但不同的TE II 蛋白所需的诱导条件不尽相同[34-35]。Suharti 等[34]发现硫酯酶TESITB 蛋白能在温度为37℃,IPTG 浓度为1 mmol/L,诱导4 h 后形成可溶性蛋白。陈维斌[35]在纳他霉素(natamycin)工业生产菌株Streptomycetes chattanoogensis L10 中发现了硫酯酶ScnI 蛋白,在0.4 mmol/L IPTG,37℃条件下诱导6 h 后获得可溶性蛋白。本研究在IPTG 浓度为100 μg/mL,20℃条件下,诱导16 h,获得分子量为27.62 kD 的可溶性蛋白。本研究首次探索了LchAD 蛋白异源表达及纯化的条件,在相对较低的温度条件下,成功获得在大肠杆菌中异源表达的LchAD 蛋白,为后续研究奠定基础。
不同蛋白的结构差异导致功能的多样性。本研究预测LchAD 蛋白为亲水性蛋白,无信号肽,含有一个GrsT 保守结构域。研究表明,TE II 蛋白具有GrsT 保守结构域[36],目前已报道的TE II 的功能包括可作为启动单元控制物质的合成、水解释放产物、提供或者去除异常中间体以及去除非活性酰基残基[18]。GrsT 是一种由短杆菌环肽素(gramicidin S)生物合成基因簇编码形成的蛋白酶[37],尽管目前对短杆菌环肽素的NRPS 进行了大量的研究,但是GrsT 蛋白的功能依旧未知[38]。Berditsch 等[39]推测GrsT 蛋白可能参与催化酰基载体蛋白(acyl carrier protein, ACP)中脂肪酰基链的水解及磷酸化。LchAD 蛋白的二级结构预测结果显示,该蛋白主要由α-螺旋、β-折叠和β-转角组成,且在其三级结构预测结果中也可观察到许多α-螺旋和β-折叠。LchAD 蛋白的三级结构与表面活性素合成酶中硫酯酶模块相似。地衣素和表面活性素同属于表面活性素家族(surfactin family)[40]。研究表明表面活性素合成酶和地衣素合成酶极为相似,二者之间只存在细微的差别[41]。这与本研究中LchAD 蛋白的三级结构类似于表面活性素合成酶中硫酯酶模块的结果一致。研究发现含有α/β 水解酶折叠结构的蛋白具有水解和释放产物的功能[10,28,42]。Koglin 等[9]分析了表面活性素合成酶中硫酯酶模块的三维结构发现,该蛋白呈现典型的α/β 水解酶折叠,位于中间的7 个β-折叠被8 个α-螺旋包围。LchAD 蛋白与表面活性素合成酶中硫酯酶模块的结构相似,推测LchAD 蛋白可能具有与之相似的功能,但不同蛋白在结构上的微小差异仍能导致其功能的不同。Whicher 等[17]对 RifR 和 RedJ 的结构研究发现,二者的“lid” 结构具有相同的折叠,但仍存在细微的差别,这些差异导致RedJ 的疏水口袋比RifR 大,最终使二者的功能存在一定差异。因此,想要揭示LchAD 蛋白的生物学功能,尚需进一步解析其结构特征。
综上所述,本研究通过对LchAD 蛋白的二级、三级结构及理化性质预测分析,为该蛋白的结晶条件筛选提供了理论依据,也为利用X 射线衍射解析其结构奠定基础。但对LchAD 蛋白如何发挥作用及其如何与其他模块相互作用还有待进一步明确,以便全面认识LchAD 蛋白的生物学功能,进而促进对地衣素生物合成机制的深入解析。研究结果将为深入探究LchAD 蛋白的生物学功能提供理论依据,为解析地衣素生物合成途径的相关分子机制奠定基础。
4 结论
从酿酒大曲中筛选出地衣素产生菌,鉴定并命名为地衣芽孢杆菌YC7。从该菌株中成功克隆LchAD 基因,在IPTG 终浓度为100 μg/mL,温度为20℃条件下获得可溶性LchAD 蛋白,其分子量约为27.62 kD。在咪唑浓度为250 mmol/L 时,获得较高纯度的LchAD 蛋白。预测LchAD 蛋白为稳定的亲水性蛋白,无信号肽,含有一个GrsT 保守结构域,其三级结构与表面活性素合成酶的硫脂酶模块相似。
文章所有附图数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002‑5464/home.shtml)。

