产胞外多糖多功能促生菌的筛选鉴定及促生评价
常海霞 李明源 麦日艳古·亚生 周茜 王继莲
(1.喀什大学生命与地理科学学院,喀什 844000;2.新疆帕米尔高原生物资源与生态重点实验室,喀什 844000)
随着现代农业的发展,土壤耕作强度逐年增加,土壤板结、盐碱化等问题日益严重。如何改善土壤结构,提升土壤肥力是目前亟待解决的重要问题。早期土壤修复主要通过水利工程、物理化学改良等措施,但存在一定局限性,难以兼顾土壤改良和植物促生的双重效果[1]。研究表明,通过化肥施加、地膜覆盖等方式可改变土壤物理结构、降低水分蒸散量,但极易导致二次污染,影响土壤内部环境营养之间的平衡,对植物生境造成严重破坏[2-3]。在此背景下,对土壤有更好增益效果的微生物改良备受研究者青睐。如Liu 等[4]发现改变土壤中优势细菌的丰度,可提高土壤养分有效性;配合施用AM真菌能够改良盐渍土壤物理结构,并增加土壤大团聚体的比例,进而促进植物生长[5]。可见微生物在植物促生及土壤结构改良方面具有一定应用潜力,可达到植物-土壤双控的目的。
某些微生物在代谢过程中可分泌胞外多糖(exopolysaccharides, EPS),它们在单糖组成、连接方式上呈现出多样性,这赋予菌株丰富的功能性和独特的生物学活性[6],保护其免受外界损伤[7]。胞外多糖还是一种很好的生物源肥料,外源施加可有效激活植物自身潜在的防御机制,保护其不受环境波动和干旱、盐碱、重金属等非生物胁迫影响[8-9]。如Sun 等[10]发现骆驼刺(Alhagi sparsifolia)内生细菌NX‑11 通过分泌胞外多糖减轻了盐胁迫对水稻幼苗的损害;Ghazala 等[11]将产胞外多糖混合菌剂接种小麦,显著提高了其在水分胁迫下的抗氧化能力。可见,挖掘产胞外多糖菌株作为生物接种剂,是提高植物抗逆性的一项有效策略[12-14]。但目前高产胞外多糖的菌种资源相对匮乏,且多数为非盐碱环境下获得,导致胞外多糖促生菌的开发应用受到极大限制[15]。目前已发现46 属76 种微生物能够分泌胞外多糖,但被广泛应用的却只有十几种,科学家们也试图用基因工程手段构建高产胞外多糖菌株,但收效甚微。因此,进一步开展产胞外多糖菌株资源的筛选,并将其应用于盐碱环境就显得尤为重要。
本研究拟从新疆南疆盐碱植物根际土壤中分离筛选产胞外多糖菌株,并基于单因素和响应面实验对高产胞外多糖菌株发酵培养基组分进行优化,以进一步提高其多糖产量。通过考察产胞外多糖菌株对盐碱土中植物的促生效果及土壤团聚体的作用,为盐碱土壤改良提供优良菌种资源,为解析产胞外多糖菌株的促生机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 研究区况及样品采集 研究区位于新疆喀什地区盐碱草地(76°10'92″E,39°44'18″N),该地区全年干旱少雨,蒸发强烈,盐碱面积大。2023 年2 月,在该地区共采集了盐节木(Halocnemum stro‑bilaceum)、盐爪爪(Kalidium foliatum)、旱生芦苇(Phragmites australis)、骆驼刺(Alhagi sparsifolia)、盐生草(Halogeton glomeratus)等5 种盐碱植物根际土壤样本。采集方法为多点混合采样法,除去表层浮土,挖出整株根系,抖落根系附着的松散土壤后封装于自封袋,4℃条件下带回实验室用于菌株分离。
盆栽试验所用土壤取自喀什郊区未开垦盐碱地,pH 值为8.32,全盐含量为1.95 g/kg,碱解氮、速效钾和有效磷含量分别为23.81 mg/kg、96.34 mg/kg、12.06 mg/kg,有机质含量为13.58 g/kg。
1.1.2 培养基 菌株分离采用LB 培养基[16];解磷能力测定采用NBRIP 无机磷培养基和Mongina 有机磷培养基[17];固氮能力测定采用Ashby 固体培养基[18];产 吲 哚‑3‑乙 酸(indole‑3‑acetic acid, IAA)能力检测采用King’s B 培养基[19];产铁载体能力检测采用CAS 检测培养基[20]。
基础培养基:葡萄糖10.0 g/L,蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠5.0 g/L。
产糖发酵培养基:甘油12.5 mL/L,蛋白胨9.0 g/L,酵母粉5.5 g/L,CaCO35.1 g/L。
1.2 方法
1.2.1 产胞外多糖菌株的筛选 称取根际土壤样品10 g,置于90 mL 无菌水中,30℃、180 r/min 振荡30 min。将土壤悬液梯度稀释后涂布LB 平板,37℃倒置培养48 h。菌落黏稠,且用牙签挑取后呈拉丝状的初步认定为产胞外多糖菌株[21]。将胞外多糖菌株接种至LB 培养基上培养48 h,观察菌落形态特征,并多次划线纯化。
1.2.2 菌株鉴定 用裂解液(Lysis Buffer for Mi‑croorganism to Direct PCR, TaKaRa)提取产胞外多糖菌株的基因组DNA,采用16S rRNA 通用引物27F(5'‑AGAGTTTGATCMTGGCTCAG‑3')和1492R(5'‑TACGGYTACCTTGTTACGACTT‑3')对菌株进行PCR 扩增[17]。PCR 产物经1%琼脂糖凝胶电泳检测后,由杨凌天润奥科生物科技有限公司完成测序。将返回序列提交至EzBioCloud 数据库进行同源性比对,选择同源性较高的同源序列,使用MEGA 11.0软件构建系统发育树。
1.2.3 胞外多糖含量测定 将产胞外多糖菌株摇床培养48 h 后,用乙醇沉淀法提取发酵液粗多糖[22]。将10 mL 发酵液置于50 mL 离心管中,低温离心去除菌体后,取上清液加入2 倍体积的预冷乙醇,4℃静置12 h 后10 000 r/min 离心10 min。所得沉淀用蒸馏水溶解定容,即为粗多糖溶液,用苯酚-硫酸法测定其OD490吸光值[23]。以不同浓度的葡萄糖标准溶液(0.20、0.40、0.60、0.80、1.00 mg/mL)制作葡萄糖标准曲线[23],根据标准曲线计算菌株产多糖含量。
1.2.4 其他促生性能测定
1.2.4.1 固氮能力测定 采用点接法,用无菌牙签将产胞外多糖菌株接种于Ashby 固体培养基上培养72 h,观察菌株长势,能在培养基上正常生长的即为固氮菌[18]。
1.2.4.2 分泌IAA 能力测定 将菌株在King’s B 液体培养基培养后,采用Salkowski 比色法进行显色反应,若颜色呈现粉色则表示能分泌IAA[24]。将阳性菌株接种于King’s B 液体培养基,28℃、150 r/min振荡培养3 d,12 000 r/min 离心5 min。取一定体积上清液加入Salkowski 显色剂,以未接菌的King’s B液体培养基为对照,28℃避光放置30 min 测定OD530吸光值[24]。将上述方法以不同浓度的IAA 稀释液绘制标准曲线, 根据标准曲线测定发酵液中IAA 含量。
1.2.4.3 产铁载体能力测定 将菌株点接在CAS 检测平板上培养96 h,观察菌落周围是否出现明显的橙色铁载体晕圈,有橙色晕圈即表示该菌株能够产铁载体[20]。
1.2.4.4 溶磷能力测定 将待测菌株分别接种于NBRIP 无机磷培养基和Mongina 有机磷培养基上,30℃恒温培养3 d,观察溶磷圈形成情况[25]。将阳性菌株接种于LB 液体培养基中振荡培养24 h 后,按1%接种量分别接入Mongina 和NBRIP 液体培养基中,振荡培养7 d,用钼锑抗比色法测定有效磷浓度[25]。
1.2.5 单因素优化菌株发酵产糖培养基
1.2.5.1 碳源种类优化 分别以1%的甘油、甘露醇、乳糖、蔗糖、可溶性淀粉替代基础培养基中的葡萄糖,每个处理3 次重复。将最高产胞外多糖菌株种子液按1%接种量转接到置换碳源后的培养基中,25℃、180 r/min 培养48 h,以胞外多糖产量为评价指标,确定菌株发酵产糖的最适碳源。
1.2.5.2 氮源种类优化 分别以1.5%的玉米粉、蛋白胨、硫酸铵、尿素、酵母粉替代基础培养基中的蛋白胨+酵母粉,每个处理3 次重复。将种子液按1%接种量转接于置换氮源后的液体培养基中,培养条件同上,确定菌株发酵产糖的最适氮源。
1.2.5.3 无机盐种类优化 分别以0.5%的K2HPO4、MgSO4、MnSO4、CaCO3、K2HPO4+MgSO4替 代 基 础培养基中的NaCl,每个处理3 次重复。将种子液按1%接种量转接于置换无机盐后的液体培养基中,培养条件同上,确定菌株发酵产糖的最适无机盐种类。
1.2.6 响应面法优化菌株发酵产糖培养基 根据单因素结果,以甘油为最优碳源,蛋白胨+酵母粉为最优氮源,CaCO3为最优无机盐,运用Design‑Expert 8.0.6 软件设计4 因素3 水平[L9(34)]响应面实验,确定菌株发酵产糖的最适培养基。
1.2.7 植物促生实验 将供试土与基质按1∶1 比例均匀混合,置于电热恒温箱中,高温干燥灭菌6 h,自然冷却后均匀分装于花盆中。挑取颗粒饱满、大小均匀的新玉24 号玉米种子常规消毒后,置于水琼脂平板上催芽。将发芽良好的种子移栽至花盆,每盆2 株幼苗,待叶片长至四叶时进行灌根处理。处理组分别接种粗多糖提取液(A)和发酵液(B),对照(CK)接种等量液体培养基,每个处理6 个重复。统一管理20 d 后收获,测量相关指标,并用乙醇浸泡法测定叶绿素含量[26]。
1.2.8 高产胞外多糖菌株对土壤团聚体影响 分别将发酵液及粗多糖提取液按5%接种量接入到称取50 g 过0.25 mm 筛的土样平皿中,30℃培养20 d。以等量液体培养基为对照,定时补充无菌水保持土壤表面湿润,分别用干筛法[27]和湿筛法[28]测定土壤中大团聚体的组成,分析胞外多糖对土壤团聚体的影响。
2 结果
2.1 产胞外多糖菌株分子生物学鉴定
从盐碱植物根际共筛选到19 株产胞外多糖菌株,对这些菌株进行16S rRNA 基因测序,结果如图1 所示。所有菌株分属7 个属,假单胞菌属(Pseudomonas)有8 株,为绝对优势属,占总菌数的42.1%;肠杆菌属(Enterobacter)为3 株,占总菌数的15.8%;芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、克锡勒氏菌属(Kushneria)均有2 株,占总菌数的10.5%;泛菌属(Pantoea)、欧文氏菌属(Erwinia)各1 株,占总菌数的5.3%。
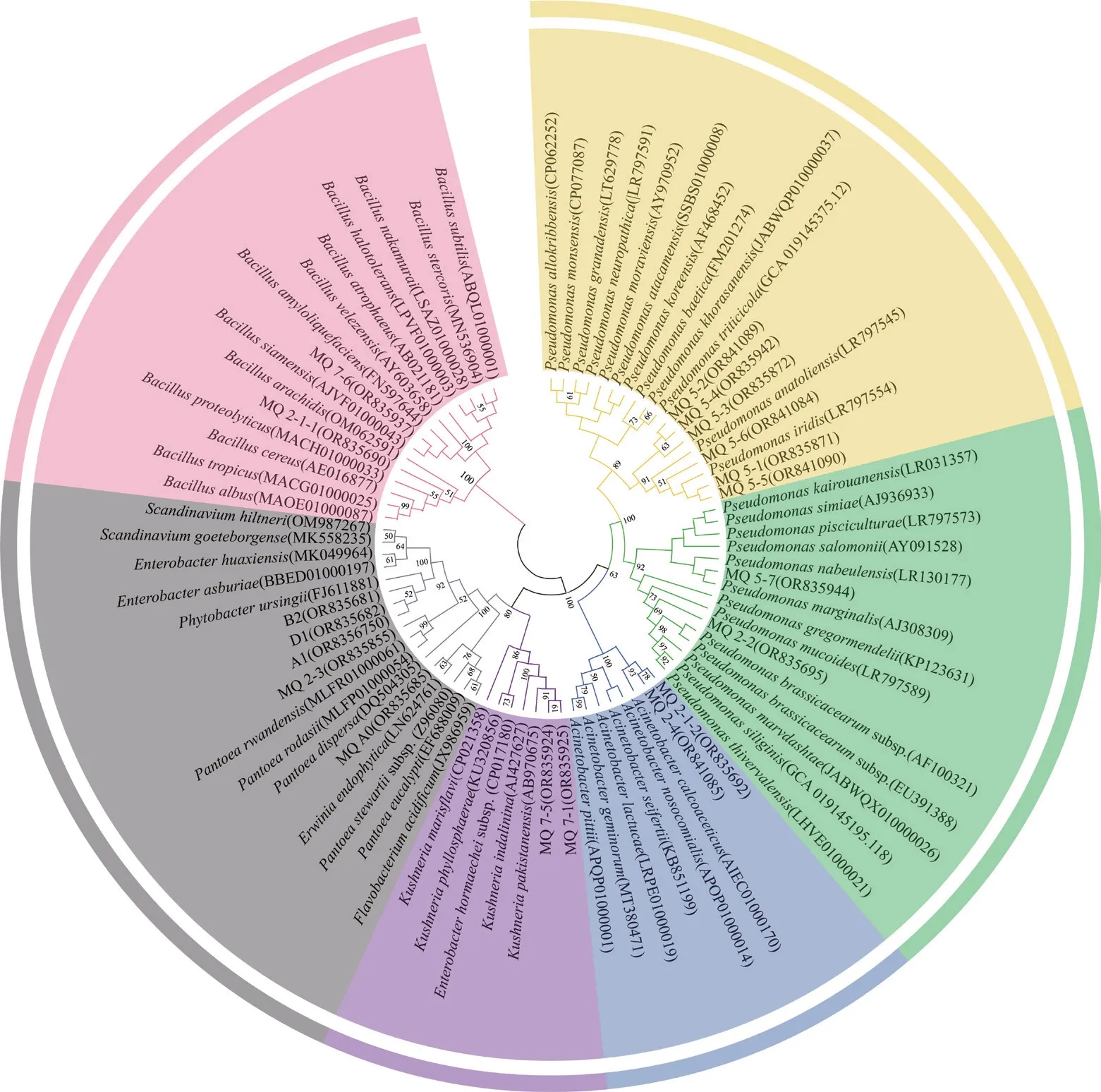
图1 基于16S rRNA 基因的产胞外多糖菌株系统发育树Fig.1 Phylogenetic tree of bacterial 16S rRNA gene sequences revealing exopolysaccharides-producing strains evolutionary divergence
2.2 促生性能评价
将初筛得到的产胞外多糖菌株发酵培养,测定其多糖含量及其他促生性能,结果如表1 所示。19株产胞外多糖菌株摇床培养48 h 后,多糖含量为236-1 544 mg/L,尤以泛菌属MQ A0 产量最高,且兼具固氮、产IAA、产铁载体和溶磷能力,在植物促生和土壤改良方面潜力较大,作为目的菌株进行后续培养基组分优化。
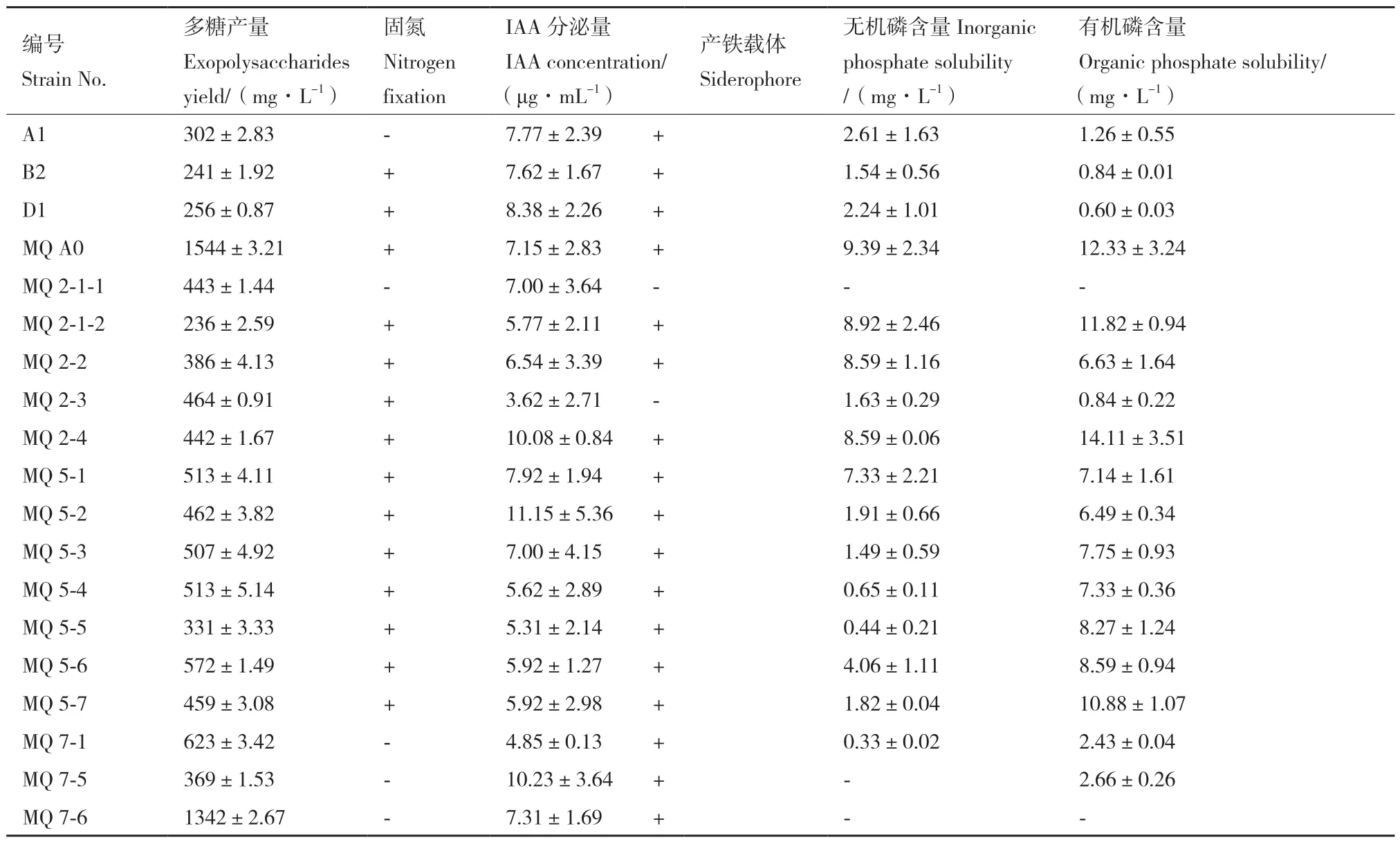
表1 胞外多糖产量及其他促生能力测定Table 1 Determination of exopolysaccharide yield and other growth-promoting characteristics
2.3 单因素实验
2.3.1 碳源种类对MQ A0 产胞外多糖的影响 碳源是微生物生长过程中必不可少的元素,其种类和浓度会影响菌株生长及产物合成。不同碳源对MQ A0 胞外多糖产量的影响结果如图2 所示,在以甘油为碳源时多糖产量可达2 147 mg/L,显著高于其他碳源(P<0.05);甘露醇次之,多糖产量为1 516 mg/L;其他碳源的促进效果并不明显,因此确定甘油为发酵培养基的最优碳源。

图2 不同碳源对胞外多糖产量的影响Fig.2 Effects of different carbon sources on exopolysaccharide yield
2.3.2 氮源种类对MQ A0 产胞外多糖的影响 氮源主要用于菌体细胞和含氮代谢物的合成,在培养基中碳源不足时也可作为补充碳源。由图3 可知,以蛋白胨和酵母粉为氮源时,MQ A0 胞外多糖的产量较高,两者配合使用多糖产量可达1 645 mg/L。发酵过程中,蛋白胨和酵母粉的搭配使用既能促进菌体吸收,又有利于产物稳定期的延长,因此确定蛋白胨+酵母粉为最优氮源。
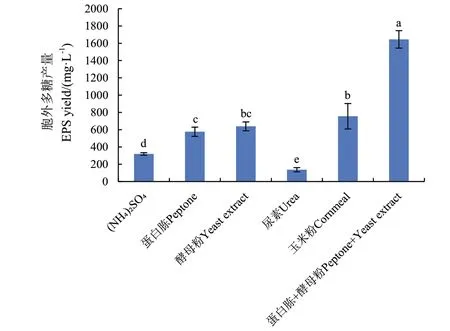
图3 不同氮源对胞外多糖产量的影响Fig.3 Effects of different nitrogen sources on exopolysaccharide yield
2.3.3 不同无机盐对MQ A0 产胞外多糖的影响 无机盐可维持细胞渗透压,为菌体提供稳定的外界环境。如图4 所示,以CaCO3作为无机盐时,MQ A0的产糖量显著高于其他无机盐(P<0.05),K2HPO4+MgSO4次之;以NaCl 作为无机盐时产糖量最差,仅620 mg/L,因此确定CaCO3为MQ A0 发酵产糖的最优无机盐。

图4 不同无机盐对MQ A0 产胞外多糖的影响Fig.4 Effects of different inorganic salts sources on exopolysaccharide yield
2.4 响应面结果分析
2.4.1 试验方案及方差分析 基于单因素实验结果,以甘油(A)、蛋白胨(B)、酵母粉(C)和CaCO3为主要因素,采用4 因素3 水平Box‑Behnk‑en 响应面优化法,结果见表2。通过实验设计得到产糖量(Y)与甘油(A)、蛋白胨(B)、酵母粉(C)、CaCO3(D)编码水平下的二次响应面回归模型Y=2367.80+288.67A-0.25B+101.92C+20.33D-324.50AB-61.50AC-3.00AD-13.50BC-133.25BD+106.75CD-348.90A2-420.52B2-429.27C2-358.90D2。

表2 BOX-Behnken 实验设计与结果Table 2 Experimental design and results of BOX-Behnken
由方差分析(表3)可得F(回归)=41.5,P<0.000 1,表明该模型高度显著;决定系数R2=0.976 5,表明该方程能够较好地模拟胞外多糖的产量变化。校正系数R2Adj=0.951 5,表明该模型能够解释95.15%的响应值变化,可用于预测菌株发酵产糖。综合F值大小可知,各因素对胞外多糖产量影响顺序依次为:甘油>酵母粉>CaCO3>蛋白胨。

表3 Box-Behnken 设计方差分析Table 3 Box-Behnken design variance analysis
2.4.2 响应面分析 利用Design‑Expert.8.05 软件对表2 中实验数据进行二元多次回归,得到方程的响应曲面及等高线如图5 所示。曲面越陡斜表明该因素的影响越显著,反之影响不显著。甘油(A)的曲面较蛋白胨(B)、酵母粉(C)、CaCO3(D)陡斜,表明甘油对胞外多糖产量的影响更大(图5‑a、c、e);酵母粉(C)的曲面较蛋白胨(B)、CaCO3(D)陡斜,表明酵母粉对多糖产量的影响次之(图5‑g、i);CaCO3(D)的曲面较蛋白胨(B)陡斜,表明蛋白胨对胞外多糖产量的影响最小(图5‑k)。

图5 各因素间对胞外多糖产量影响的响应面及等高线图Fig.5 Response surfaces and contours of the influences of various factors on exopolysaccharide yield
等高线形状反映出两因素间交互作用的强弱,椭圆形说明二者交互作用较强,圆形则无交互作用。AB、AC、BD、CD 等高线形状均为椭圆,表明各因素间交互作用较强(图5‑b、d、i、l)。而AD、BC等高线形状为圆形,表明甘油与碳酸钙、蛋白胨与酵母粉之间交互作用较弱(图5‑f、h)。综上,各因素对胞外多糖产量对影响显著性顺序为:甘油>酵母粉>碳酸钙>蛋白胨,与方差分析结果一致。
通过分析,预测最优培养基组分为:甘油12.52 mL/L、蛋白胨9.04 g/L、酵母粉5.12 g/L、CaCO35.09 g/L,在此条件下产糖量为2 445 mg/L。结合操作可行性修正参数后(调整为甘油12.5 mL/L、蛋白胨9.0 g/L、酵母粉5.5 g/L、CaCO35.1 g/L),进行3 次重复试验。结果显示,平均产糖量为2 436 mg/L,与预测值偏差0.37%,可知该响应面模型优化MQ A0 产胞外多糖培养基组分配比可行。
2.5 盆栽促生效应评价
将玉米幼苗分别进行不同的接种处理,培养20 d 后的生理指标见表4。与对照相比,接种MQ A0 显著促进了幼苗生长,尤以鲜重和根长增幅较大,分别增加了203.0%和99.7%。接种粗多糖提取液也显著增加了玉米植株各项生理指标,与发酵液相比,植株的株高、须根数、茎粗、鲜重以及叶绿素含量差异并不显著。总体而言,接种优化后的MQ A0 发酵液对盐碱土壤中玉米的促生效果更优。

表4 不同处理对玉米幼苗生长的影响Table 4 Effects of different treatments on the growth of maize seedlings
2.6 胞外多糖对土壤团聚体的影响
接种20 d 后测定不同处理的土样团聚体含量,结果如表5 所示。以直径>0.25 mm 的团聚体作为评价指标,团聚体质量分数与平均重量直径均按照粗多糖提取液、发酵液、对照的顺序依次递减,表明粗多糖提取液和发酵液都能促进土壤团聚体形成,尤以粗多糖提取液影响更大。PAD 是反映土壤水稳性的指标,与对照相比,接种发酵液与粗多糖都能降低团聚体破坏率,分别降低了10.8%与8.4%,表明二者均对提高土壤水稳性有积极作用。

表5 不同处理对土壤团聚体的影响Table 5 Effects of different treatments on soil aggregates
3 讨论
不同地理环境和宿主植物根际产胞外多糖菌株的类群差异较大,如Niu 等[29]从谷子(Setaria italica)根系分离的产胞外多糖菌株分别隶属于假单胞菌属和肠杆菌属,尤以荧光假单胞菌产糖量较高;分离自拟南芥(Arabidopsis thaliana)根际的产胞外多糖菌株分别隶属于假单胞菌和芽孢杆菌属[30]。本研究从南疆盐碱植物根际分离的产胞外多糖菌株以假单胞菌占绝对优势,进一步证实假单胞菌是植物根系普遍存在,并可能发挥重要作用的微生物类群,但最高产多糖菌株以泛菌属MQ A0 最为显著。泛菌属作为一种革兰氏阴性菌,能够利用D‑葡萄糖和其他糖类产酸,多数能够增强宿主植物抵御病原体的功能,同时还能有效抵抗盐胁迫,降低细胞膜损伤[31-32]。但当前泛菌属在胞外多糖促生方面的研究尚未见报道,本研究进一步拓宽了产胞外多糖的菌株资源。
微生物胞外多糖的产量随介质成分的不同而变化,包括但不限于碳、氮、无机盐种类和其他环境因素[33]。目前已有诸多采用单因素、响应面优化菌株产糖量的报道,但不同于本研究确定的最适培养基组分,王琪等[34]对产罗汉果内生菌的单因素分析表明,蔗糖、尿素比甘油、蛋白胨更利于菌株发酵产糖。乔新荣等[35]发现木贼镰孢菌(Fusarium equiseti)在以葡萄糖为碳源时,多糖产量更高。培养基组分对多糖产量影响较大,一方面与菌株种属特性有关,另一方面还可能与其多糖结构有关。胞外多糖类型多样,结构复杂,其物理性质、功能特性都存在一定差异,同一菌株也可能产生不同组分的多糖。如陈海燕等[36]从嗜热链球菌MGD1‑4 中分离到EPS‑1a 和EPS‑3a 两个不同组分的多糖,其理化特性存在明显差异。因此,为更好地探究胞外多糖不同组分的结构与生物活性间的相关性,本研究后期将进一步开展对胞外多糖的分离、纯化与结构分析研究。
糖是一种类似于植物激素的信号分子,在植物的生命周期中具有重要作用,可以调节植物的营养传输、生长发育[37]。本研究中,接种MQ A0 菌株发酵液对盐碱土壤中的玉米植株具有更好的促进效果,推测是由于发酵液中存在大量活菌体,能够与植物根系互作,较大程度地帮助植物根系建立有益的微生物群落结构,提高其对盐碱胁迫的耐受性。另一方面,MQ A0 兼具固氮、解磷、产IAA 和铁载体等多种促生特性,再次表明了产胞外多糖菌株的功能多样性,这可能也是接种发酵液比粗多糖提取液更能促进植株生长的重要原因。但本研究尚未探究胞外多糖对植物生长的调节机制。研究表明,胞外多糖浓度的增加对植物的促生作用呈现先增加后降低的趋势[38],推测可能与胞外多糖的调节机制和土壤微环境有关。因此有必要结合不同宿主植物和胁迫条件,探究胞外多糖用量与土壤肥力间的平衡点,以更好地缓解植物盐碱胁迫。当前研究仅限于室内条件,尚未开展大田实验,后续需结合田间复杂多变的环境因素,进一步考察产胞外多糖菌株的大田应用效果,为胞外多糖菌肥的制备提供更多数据支撑。
土壤团聚体是土壤结构的基本组分,也是反映土壤结构的重要指标,影响着土壤肥力和微生物多样性[39]。研究证实,胞外多糖与土壤结皮、土壤团聚体稳定性等性质密切相关[9]。本研究接种胞外多糖粗提液显著增强了土壤团聚体水稳性,降低土壤PAD 值,与以往报道相符[12,39]。目前普遍认为胞外多糖对土壤的改良机制主要是通过静电引力和范德华力,以胶膜形式包被在土壤颗粒外表,通过增加土壤颗粒的黏结性来促进团粒结构的形成[40-41]。推测本研究中土壤团聚体稳定性的提高也与多糖独特的结构有关,具体还需进一步解析。胞外多糖对土壤环境的调节是一个复杂的过程,已有学者从不同角度阐述了胞外多糖的作用机制,其在农业生产中的应用也逐步受到关注。但总体来看,胞外多糖的结构与功能、生理代谢及其对微生物生态系统的影响等仍需系统性分析。
4 结论
分离自新疆喀什盐碱草地植物根际土壤的19 株产胞外多糖菌株隶属于7 个菌属,以Pseudomonas占绝对优势,其中泛菌属Pantoea MQ A0产糖量最高,且兼具固氮、产IAA、产铁载体和溶磷能力。优化后的MQ A0 发酵培养基组多糖产量增加57.8%,接种优化后的MQ A0 发酵液显著增加了盐碱土栽培的玉米植株生物量,其胞外多糖粗提液对土壤团聚体改良也有积极影响。

