脆弱拟杆菌六型分泌系统对肠道屏障的影响及机制
雷棋怡 徐杨 李鹏飞
(1.苏州大学附属第一医院血液科,苏州 215000;2.苏州大学造血干细胞移植研究所,苏州 215000)
肠黏膜屏障是肠道与外界环境接触的第一道屏障,对减少病原体的侵袭、毒素的吸收有极其重要的作用。肠道屏障功能的减退或缺失往往伴随着肠道菌群失调,甚至会导致肠道菌群的易位,致使菌群进入血液,进而引发多种肠道和血液疾病,如炎症性肠病(inflammatory bowel disease, IBD)[1]、脓毒血症(Sepsis)[2-3]、移植物抗宿主症(graft ver‑sus‑host disease, GVHD)[4]等。因此,肠道菌群与肠道屏障之间的相互作用备受瞩目。一方面,肠道菌群为宿主提供能量和营养,促进免疫系统的发育,帮助宿主抵御病原体。另一方面肠道细菌的代谢物如短链脂肪酸(short chain fatty acid, SCFAs)可以影响人类肠道上皮和黏膜屏障的完整性、免疫反应和微生物群的多样性[5]。但是,能应用到临床治疗的菌群产物依然十分有限,需要进一步探索肠道菌群与宿主之间相互作用的机制。
作为肠道中最主要的共生菌类群之一,拟杆菌的多个成员被认为是肠道有益菌,在调节肠道炎症反应和维持肠道屏障等方面起到重要作用[6-8]。值得注意的是,基因组测序结果表明,约50%的拟杆菌目细菌中都存在着六型分泌系统(T6SS)[9]。T6SS 是存在于革兰氏阴性菌中的蛋白分泌系统,一般通过接触依赖的方式将效应物注入到相同生态位的靶细胞中,在多种水平上调节和塑造肠道菌群的稳定性[10]。早期研究表明T6SS 可以杀伤相同生态位的细菌以影响菌群构成,有助于细菌在肠道的定殖[11]。在肠道病原菌中,T6SS 效应蛋白通过黏附修饰、细胞骨架重构和逃避宿主固有免疫等过程来实现胞内病原菌的定位、存活和传播[12-14]。目前鉴定出来的T6SS 效应蛋白多为核酸酶或者核酸靶向酶,然而绝大多数共生菌T6SS 的功能,尤其是对肠道屏障的功能尚不清楚。
肠道炎症的发病因素包括遗传易感、黏膜屏障的损坏、肠道微生物群的失调和免疫紊乱等。靶向肠道菌群的定向精准干预,是治疗肠道炎症相关疾病的新选择。本研究拟利用硫酸葡聚糖钠盐(DSS)诱导的小鼠肠道屏障损伤模型,探讨肠道拟杆菌T6SS 以及其分泌蛋白对肠道炎症以及肠道屏障的作用。本研究进一步通过非靶向代谢组分析探讨T6SS介导的细菌间竞争对肠道代谢组的影响,为其作为益生菌改善肠道屏障功能提供理论依据[15]。
1 材料与方法
1.1 材料
Bacteroides fragilis(脆弱拟杆菌, B.fragilis)菌株购自中国工业微生物菌种保藏管理中心;限制性内切酶BamH I 和Sal I 购自NEB;感受态细胞 S17‑pir 购自源叶生物;红霉素购自索莱宝;四环素购自Cayman;DSS(36-50 kD)购自MP Biomedicals;异硫氰酸荧光素葡聚糖购自Sigma‑aldrich;逆转录试剂盒购自TaKaRa;SYBR Green 探针购自上海蓝木;引物由金唯智公司负责合成(表1);多功能酶标仪用Synergy HTX Multimode Reader 购自BioTek;qRT‑PCR 仪购自Applied Biosystems。
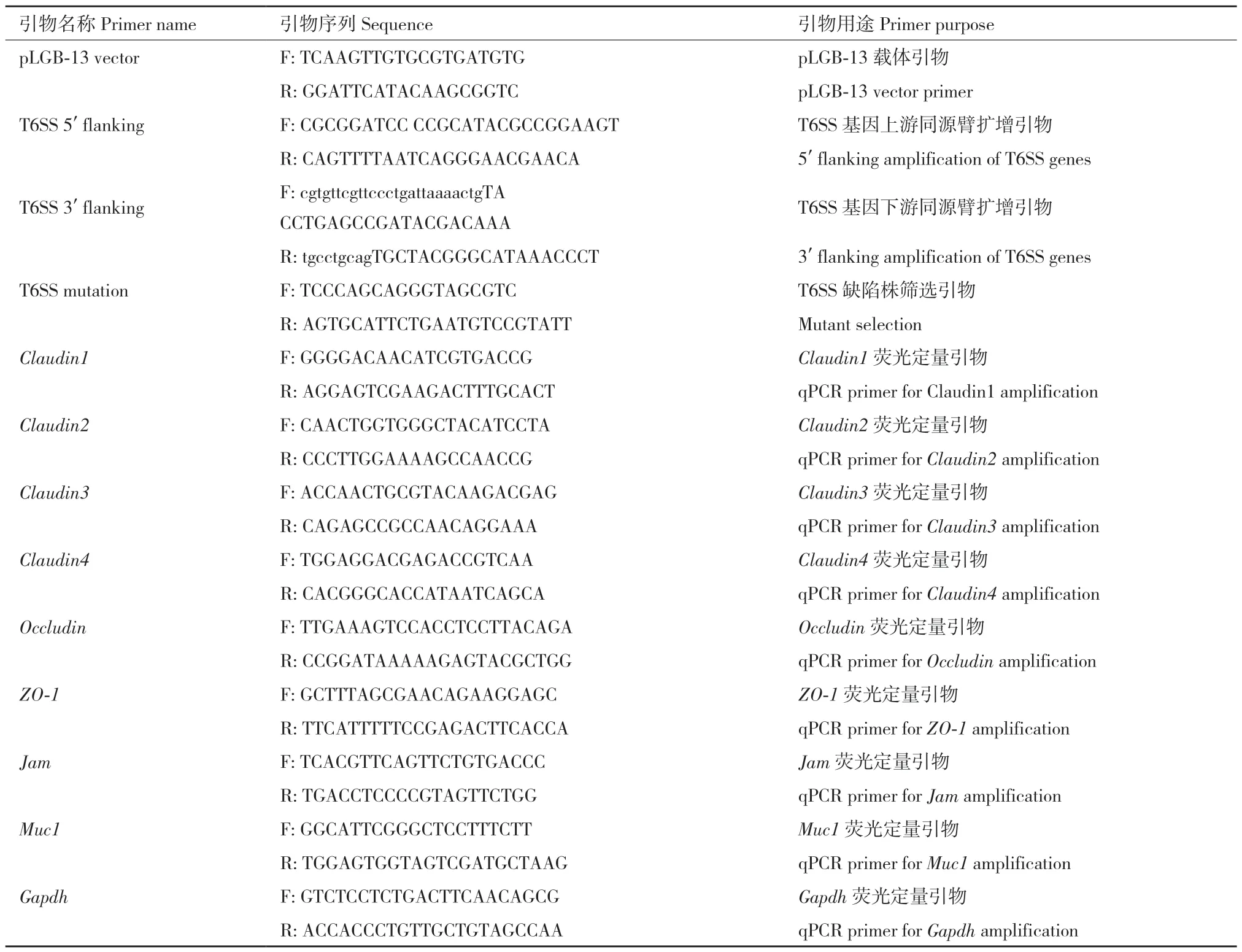
表1 引物列表Table 1 Primer sequence
1.2 方法
1.2.1 细菌培养 B.fragilis 按1∶100 接种到新鲜的脑心浸液肉汤(BHI)培养基中,活化过夜2 次。二次活化培养16 h 后,离心浓缩细菌(6 000 ×g,4℃,10 min),并用磷酸缓冲盐水(PBS)洗涤2 次,最后将收集的细胞重新悬浮于PBS 溶液中调整至所需终浓度。
1.2.2 缺陷株的制备 本实验采用自杀质粒pLGB13构建T6SS 缺陷株[16-17]。将选定基因上下游500-3 000 bp 序列通过BamH I 和Sal I 双酶切位点克隆到自杀质粒上,随后转化到感受态细胞S17‑pir 中。然后通过接合转化的方式将质粒转到B.fragilis WT菌株中。第一轮筛选采用红霉素(索莱宝,e8100)和特异性引物得到发生单边同源重组的克隆。第二轮筛选将细菌用有限稀释法涂布于含有四环素(6 μg/mL)的血平板上进行培养,利用特异性PCR 筛选,得到T6SS 缺陷株。利用全基因组测序确定突变株的基因敲除。
1.2.3 同源进化树的构建 根据NCBI 数据库中T6SS 保守基因tssH,利用MEGA11[18]构建N‑J[19]同源进化树分析其序列多态性。
1.2.4 动物实验设计 选用SPF 级雌性C57BL/6J 小鼠,8-10 周龄,体重为(20±2)g/只。动物随机分为3 组,每组10 只,分别在温度21-25℃、相对湿度40%-60%的标准条件下和标准光周期(12 h白天/12 h 黑夜)下饲养。给予小鼠酸化水和标准食物,并在实验前进行为期7 d 的驯化。随后,各组小鼠饮水中加入3%(W/V)DSS,维持7 d,第8天改为常规饮用水。B.fragilis WT 和ΔT6SS 组每24 h 分别灌胃1 × 109CFU 相应脆弱杆菌株活菌制剂,共7 d,每24 h 灌胃一次。
1.2.5 血清荧光素的测定 在第9 天前一晚所有小鼠禁食、禁饮12 h 后,灌胃异硫氰酸荧光素葡聚糖。所有小鼠在异氟醚下处死。收集眼球血及结肠。眼球血室温放置30 min 待血液凝固后,离心3 000×g,RT 15 min,取上清测定血清中的荧光强度。本项目经苏州大学附属第一医院医学伦理委员会审查同意并按相关规定进行(2021 伦审(申报)批第248 号)。
1.2.6 组织病理学 建立DSS 模型后第9 天,根据实验分组,收集小鼠的结肠,用体积分数为4%的多聚甲醛液固定后经石蜡包埋、切片及HE 染色后,在镜下观察小鼠结肠的病理损伤程度。
1.2.7 免疫组化 建立DSS 模型后第9 天,将新鲜结肠组织标本(0.5 cm)转移到含4%多聚甲醛的离心管中固定后,经脱蜡、水化、抗原修复、封闭后,分别加入鼠源Claudin‑2、Claudin‑3 和Claudin‑4 一抗,并于37℃孵育1 h。经PBST 洗涤3 次后,每张切片滴加HRP 标记的二抗(抗鼠),室温孵育30 min。使用DAB 法显色5 min 后,经过复染、脱色反蓝后封片。
1.2.8 小鼠肠道组织紧密连接蛋白基因表达检测 建立DSS 模型后第9 天,剪取结肠组织50 mg,利用Trizol‑氯仿法提取组织总RNA。利用试剂盒将RNA 逆转录为cDNA,使用SYBR Green 探针检测8种紧密连接蛋白(Claudin‑1、Claudin‑2、Claudin‑3、Claudin‑4、Occludin、ZO‑1、Jam 和Muc‑1)的表达情况。RT‑PCR 反应条件为:94℃ 5 min;94℃ 35 s,60℃ 35 s,72℃ 35 s,共35 个循环;72℃ 10 min。引物序列见表1。
1.2.9 代谢组分析 收集第7 天的小鼠粪便,液氮速冻后,由天津诺禾致源公司(Novogene Co.Ltd)采用液质联用技术(LC‑MS)进行非靶向代谢组测序[20-21]。
1.2.10 数据分析 应用GraphPad Prism 9(Version 9.5.0)统计软件分析实验结果。两组间采用t 检验进行差异分析。多组间比较采用One‑way ANOVA 进行方差分析,组间两两比较采用Dunnett 方法。差异结果用均数±标准误差(mean±SEM)表示。P<0.05 具有统计学意义。
2 结果
2.1 T6SS在拟杆菌细菌中广泛存在
以B.fragilis T6SS 保守基因tssH 为模板在NCBI数据库进行同源比对并构建Neighbor‑Joining 同源进化树,结果表明T6SS 在拟杆菌属细菌中分布广泛(图1)。

图1 基于拟杆菌属细菌tssH 基因构建的N-J 同源进化树Fig.1 Neighbor-Joining homogeneous phylogenetic tree based on tssH gene in Bacteroides genus
2.2 T6SS的缺失不影响B.fragilis的生物活性
为了探讨B.fragilisT6SS 与肠道屏障之间的作用,本研究采用自杀质粒pLGB13 定向敲除T6SS 分泌系统中的tssB‑tssC‑tssH 基因。细菌全基因组测序验证了在2365875-2370215 序列的缺失(图2‑A)。筛选得到的缺陷株B.fragilis ΔT6SS 失去了将效应蛋白分泌到靶细胞中的能力,但是并不影响其在液体培养基的生长曲线(图2‑B),也不影响细菌的转录组和代谢组(图2‑C-D)。
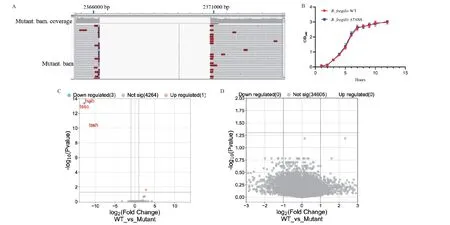
图2 B.fragilis T6SS 缺陷株的构建Fig.2 Construction of B.fragilis ΔT6SS strain
2.3 脆弱杆菌T6SS的缺失导致对DSS的保护性降低
随着DSS 诱导肠炎的进行,各组小鼠体重与初始相比均有所降低。在诱导后7 d,与对照组相比,B.fragilis WT 实验组小鼠的体重下降趋势有显著改善;而B.fragilis ΔT6SS 实 验 组 体 重 与B.fragilis WT 组相比明显降低(图3‑A)。第10 天处死小鼠,统计各组小鼠结肠长度。B.fragilis WT 组小鼠结肠长度比对照组(P = 0.025 0)和B.fragilis ΔT6SS 组(P =0.028 4)有明显改善(图3‑C)。
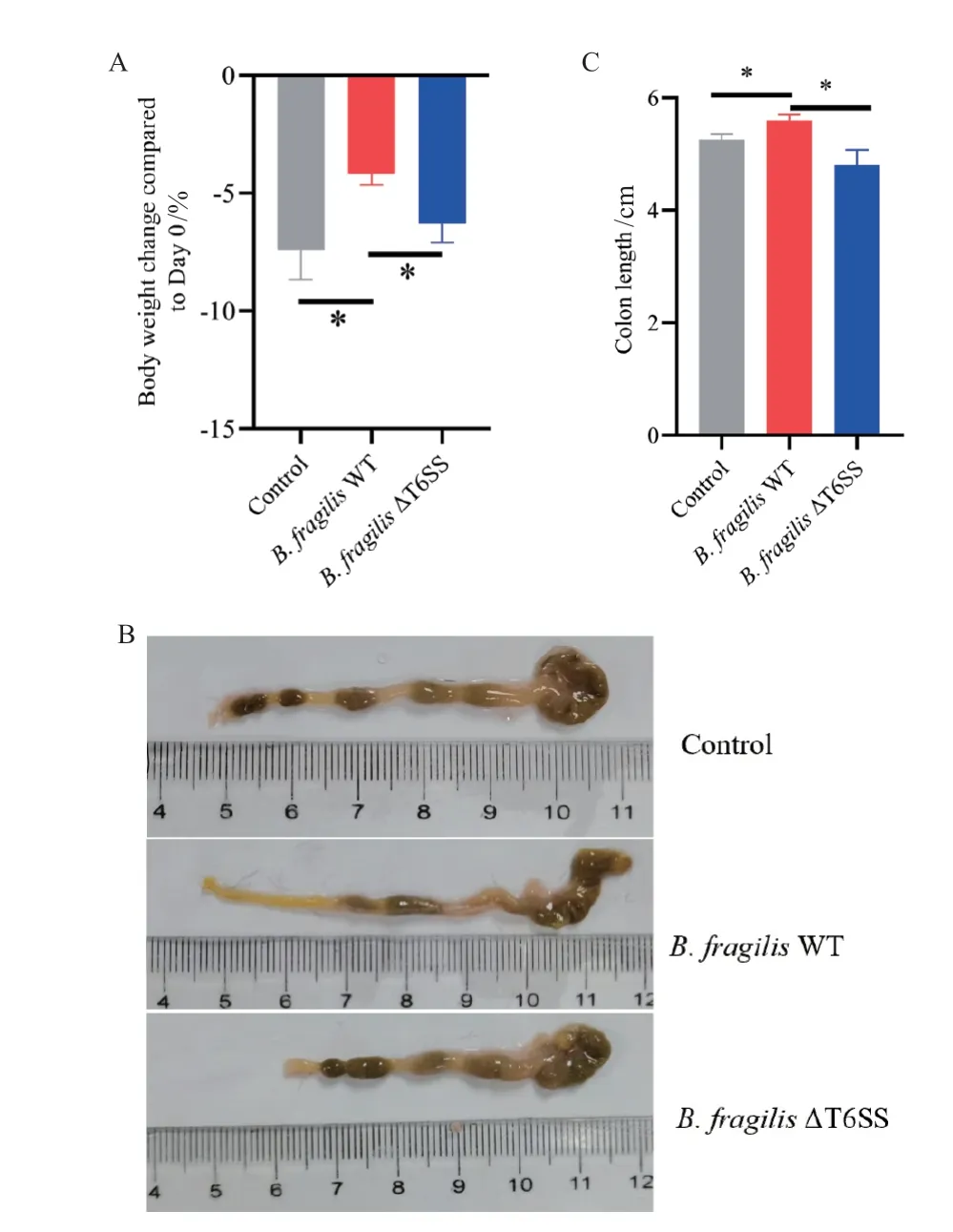
图3 B.fragilis T6SS 参与到对DSS 诱导肠道炎症的保护性Fig.3 B.fragilis T6SS involved in protection on DSS-induced colitis
2.4 B.fragilis T6SS有助于DSS诱导肠道损伤的保护性
DSS 诱导的小鼠结肠炎病变以盲肠和远段结肠为著。因此,选择小鼠结肠进行病理切片观察。与对照组相比,B.fragilis WT 组小鼠结肠组织病理得到明显改善,而B.fragilis ΔT6SS 组小鼠结肠组织出现了和对照组类似的严重组织学损伤,具体表现为隐窝细胞和杯状细胞减少,肠道上皮损伤和炎性细胞浸润(图4‑A)。此外,在第9 天给小鼠灌服荧光素葡聚糖后,收集血清检测荧光强度。结果表明,B.fragilis WT 组小鼠血清中荧光素葡聚糖浓度显著低于对照组和B.fragilis ΔT6SS 组,而对照组和B.fragilis ΔT6SS 组小鼠血清中荧光素葡聚糖浓度无显著差异(图4‑B)。

图4 B.fragilis T6SS 有助于DSS 诱导肠道炎症中肠道屏障的维持Fig.4 B.fragilis T6SS contributes to the maintenance of the intestinal barrier in the DSS-induced colitis
2.5 B.fragilis T6SS 有助于上调肠道细胞紧密连接蛋白的表达
上皮屏障功能的丧失可能是由于细胞旁紧密连接通透性的变化造成的。第9 天收集小鼠的大肠,提取RNA 后进行逆转录聚合酶链反应。结果显示,B.fragilis WT 组相比于其他两组,上皮细胞紧密连接 蛋 白Claudin‑2、Claudin‑3、MUC‑1 和Occludin的mRNA 水平更高(图5‑A)。免疫组化也表明B.fragilis WT 组小鼠肠道组织中Claudin‑2、Claudin‑3和Claudin‑4 有更高的表达量(图5‑B)。对照组和B.fragilis ΔT6SS 组小鼠肠道组织中紧密连接蛋白的表达无显著差异。
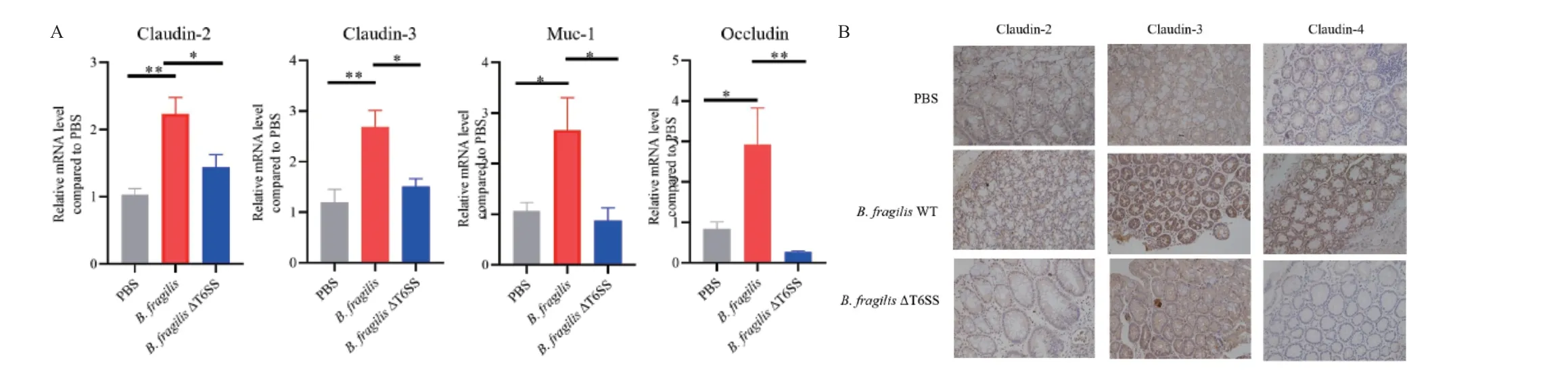
图5 B.fragilis T6SS 有助于上调肠道细胞紧密连接蛋白的表达Fig.5 B.fragilis T6SS upregulates the expressions of intestinal tight junction proteins
2.6 代谢组测序
肠道菌群的代谢产物对肠道屏障有直接的作用,因此,我们进一步采用代谢组测序来探索B.fragilis T6SS 参与的菌种竞争对肠道代谢组的影响。结果表明,灌服B.fragilis WT 和B.fragilis ΔT6SS 小鼠粪便的代谢组有明显区别(图6‑A)。与B.fragilis ΔT6SS组相比,灌服B.fragilis WT 的小鼠粪便有96 个显著差异代谢产物,其中上调代谢产物86 个,下调代谢产物10 个(图6‑B)。差异代谢产物见图6‑C,其中上调最为显著的代谢产物为甘氨酸(Glycitein)、D‑泛黄酸钙(calcium D‑panthotenate)和大豆黄酮(daidzein)。KEGG 通路富集分析表明,差异代谢产物集中在胆碱能突触(cholinergic synapse)和甘油磷脂代谢(glycerophospholipid metabolism),且均为上调(图7)。

图6 T6SS 对肠道代谢组学的影响Fig.6 Effect of T6SS on intestinal metabolome

图7 差异代谢物的KEGG 富集结果Fig.7 KEGG enrichment of differentially expressed metabolites
3 讨论
肠道微生物与肠道屏障的相互作用,以及其在人类健康中的病理生理作用一直是研究的活跃领域。由于频繁使用广谱抗生素和放化疗,血液病和肿瘤学疾病患者的肠道通透性增加的风险尤其高。靶向肠道屏障稳态已成为诊断和治疗大量疾病的挑战。通过FMT 或者定向补充特定益生菌是提高肠道屏障功能的潜在途径[22]。安全性方面研究最充分的产品是乳酸杆菌、双歧杆菌和布拉酵母。它们通过增加紧密连接蛋白的表达、减少肠道炎症和调节局部免疫反应来发挥其活性[23]。深入探索肠道微生物与肠道屏障之间的作用机制,有助于发现新的具有生物活性的细菌产物,并应用到临床实践。
本研究表明,作为主要的肠道共生细菌之一,拟杆菌B.fragilis 的蛋白分泌系统T6SS 有助于上调肠道紧密连接蛋白的表达,进而改善肠道屏障的通透性,减轻DSS 诱导的肠炎。在肠道炎症患者中,肠道屏障可能由于黏膜损伤、细胞分子变化或自身免疫性疾病引起的免疫反应失调而被破坏,而肠道通透性的增加会导致细菌、毒素等入侵黏膜层,进一步损害屏障的完整性[24-25]。已有研究表明,B.fragilis 单个菌株可以调节肠道T 细胞炎症因子的释放和短链脂肪酸(SCFAs)的含量来减轻肠道炎症反应,提高肠道的完整性[26]。本研究表明B.fragilis利用其T6SS 提高肠道屏障的完整性,为其作为益生菌改善肠道炎症提供进一步的理论依据。
此外,小鼠肠道非靶向代谢组分析表明,B.fragilis T6SS 能显著影响肠道代谢组,上调甘氨酸、D‑泛黄酸钙和大豆黄酮等96 个代谢产物,且多个代谢产物富集到胆碱能突触代谢和甘油磷脂代谢相关通路。由于后生素进一步避免了细菌通过胃肠道屏障或者抗生素耐药的风险,同时保留了益生菌的功效,被认为是对易受感染的患者(例如免疫功能低下或重病儿童和早产儿)使用活菌更安全的替代品[27-29]。深度测序的发展有助于进一步揭示特定肠道微生物群落及其代谢产物与疾病发生发展的相关性。已有研究表明肠道微生物可以分解膳食中的碳水化合物产生丁酸盐等,有助于修复肠道屏障并抑制IEC 细胞凋亡,也可能通过降低IEC 组蛋白乙酰化水平,从而减轻aGVHD[5]。丁酸盐还具有抗炎特性,可以调节局部入侵细菌诱导的炎症反应。本研究表明B.fragilis T6SS 显著改变肠道代谢组,这或许是由于T6SS 对菌群结构数量的改变所引起的。本研究筛选到的差异代谢产物,是否对肠道屏障起到直接的保护作用,还需要进行深入的机制研究和功能验证。
在营养和空间有限的肠道环境中,微生物必须使用各种策略与宿主和其他细菌共存或竞争。T6SS在肠道细菌中普遍存在,是影响微生物群组成的相互作用力之一。T6SS 最初被认为是革兰氏阴性菌中的一种接触依赖性杀菌机制[30]。然而,近年的研究极大扩展了其功能靶标和分泌机制[31]。病原菌可以利用T6SS 促进人类肠道中宿主细胞的相互作用和发病机制,而共生生物可以通过菌群竞争杀伤其他细菌来定殖特定的生态位。每分钟每克结肠内发生超过109次T6SS 分泌事件,表明T6SS 在多种水平上调节和塑造肠道菌群的稳定性[32]。目前,通过表达针对靶标的纳米抗体,构建了具有增强细胞黏附能力的程序化抑制细胞(PIC),可以增加T6SS 的杀伤能力和杀伤谱[33]。结合这些成功的尝试和本研究的结果,对T6SS 进行利用和工程化改造,是对肠道菌群进行定向干预的方法之一。
B.fragilis T6SS 对肠道屏障的保护性是通过直接的蛋白分泌,或是通过间接的菌种竞争尚需进一步地探索。对共生菌T6SS 作用机制的深入研究能够进一步剖析肠道微生物及细菌产物与人类细胞相互作用的分子机制,可以为肠道精准改造治疗提供更为安全有效的备选工程菌,具有重大的临床意义。
4 结论
本研究表明拟杆菌B.fragilis T6SS 显著改变肠道代谢组,并影响肠道紧密连接蛋白的表达,保护肠道屏障的完整性,减轻DSS 诱导的肠炎。

