真菌电化学修复除草剂污染土壤:降解动力学探索
郝大程 郑宇薇 王凡 韩蕾 张赜
(1.大连交通大学环境与化学工程学院,大连 116028;2.大连环资科技有限公司,大连 116100)
近几十年来,集约化农业越来越多地使用除草剂,从而保持了农作物的质量和数量,提高了世界粮食产量。然而,这些化合物可以通过地表径流、淋滤、喷雾漂移、土壤侵蚀和沉积进入生态系统[1-2]。此外,有机污染物通过食物链等途径最终富集到人体内,威胁人类健康,农业土壤有机污染修复迫在眉睫[3]。电动力(EK)修复技术在环境保护过程中发挥着重要的作用,具有多功能性、能量效率高、可自动控制、环境相容性高等优点[4]。微生物修复通过微生物将有机污染物作为碳源,进行生长繁殖,是一种可持续的降解环境污染物的方法[5]。微生物燃料电池(MFC)是利用生物电化学技术来完成土壤中污染物的去除,同时还可产电,无需额外供电,其用于污水处理的研究渐多,但用于污染土壤修复的研究甚少[6]。氯氟吡啶酯(florpyrauxifen‑benzyl,F,图1‑A)属于最早开发的选择性合成激素类除草剂[7],易在稻田中代谢迁移污染环境,影响后茬作物生长;具有强烈刺激性,能麻醉中枢神经系统[8]。弗吉尼亚州明确规定除非产品标签允许,否则不要使用氯氟吡啶酯处理过的水进行灌溉[9]。高效氟吡甲禾灵(haloxyfop‑P,H,图1‑B)对安氏伪镖水蚤、牡蛎等13 种海洋生物均具有一定致死率[10]。用紫外/过氧硫酸氢钾系统降解高效氟吡甲禾灵,获得最高去除率为56.82%[11]。从大豆田分离的土壤水微菌菌株处理100 mg/L 的高效氟吡甲禾灵,经40 h得到较好的降解效果[12],但该菌株尚未用于土壤修复,且真菌用于除草剂污染土壤的研究较少[13]。

图1 除草剂化学结构Fig.1 Chemical structures of herbicides
利用宏基因组测序[14]以及MiSeq 高通量扩增子测序和分离菌鉴定[15]揭示了红豆杉根际惊人的微生物多样性。踝节菌Talaromyces dalianensis DJTU‑SJ5[16]与疣孢漆斑菌Myrothecium verrucaria DJTU‑sh7[17]均是从矮紫杉、南方红豆杉等药用植物根际土壤中分离筛选得到。通过单因素实验发现短时间内踝节菌DJTU‑SJ5 对三环、四环甚至较难降解的五环多环芳烃均有较好的降解效果[18]。高产漆酶的疣孢漆斑菌DJTU‑sh7 对活性翠蓝和活性绿19 等染料具有良好脱色效果[15,19-20]。但两种真菌对除草剂类有机污染物去除效果未知。真菌、细菌和其他微型生物均在土壤中广泛存在,且适应环境能力强,代谢功能多样,但真菌降解除草剂的应用研究较少;为了全面挖掘土壤生物用于污染修复的潜力,有必要加强对真菌降解除草剂的研究。
本研究通过EK、微生物、MFC 技术处理灭菌土壤中两种除草剂氯氟吡啶酯和高效氟吡甲禾灵,其中在后两种方法的研究中,均添加踝节菌DJTU‑SJ5 与疣孢漆斑菌DJTU‑sh7 单菌株以及混合菌株。本研究开发了一种添加真菌菌株的微生物强化生物电化学系统,将电化学修复和微生物修复结合起来;对比了3 种方法去除污染物的效果与优缺点,确定除草剂降解产物,推测其降解路径,对实验过程中除草剂浓度变化规律进行降解动力学拟合。
1 材料与方法
1.1 材料
土壤取自大连交通大学环境与化学工程学院楼前花坛处,去除植物根系和石块过1.7 mm(10 目)筛,备用。称取土样5.00 g,加入25 mL 无二氧化碳水(去离子水122℃灭菌20 min,取出冷却至室温),玻璃棒剧烈搅动2 min,静置30 min,测定pH、电导率。未添加除草剂灭菌土壤pH=7.9,σ=108.6 μS/cm。
1.2 方法
1.2.1 气相色谱-质谱(GC‑MS) 氯氟吡啶酯(F)的色谱条件:色谱柱Agilent HP‑5ms 30 m×0.25 mm×0.25 μm,升温程序:初始180℃,保持1 min,以25℃/min 升温到280℃保持15 min;以10℃/min升温到310℃保持10 min。进样口温度为250℃,气质接口温度280℃。进样量1 μL,分流比5∶1,载气流速1.0 mL/min,柱流量:1 mL/min。质谱条件:电离模式,离子源温度230℃,四级杆温度150℃,EI 电离70 eV,溶剂延迟3.75 min。扫描方式,选择离子监控,选择离子为286、344[21]。高效氟吡甲禾灵(H)选择离子为180、288、316 和375[22],其他条件同上。
1.2.2 EK 降解实验 将石墨毡裁剪成1 cm× 0.5 cm×0.5 cm 的长条用作碳纤维,取350 g 土壤122℃灭菌90 min,使土著微生物完全失活,加入20 mL除草剂溶液(F、H 溶液浓度分别为1.7 mg/mL 和4.3 mg/mL),60 mL 模拟电解液(80.75 mg/L Na2SO4、70 mg/L NaHCO3、30.36 mg/L NaNO3)[23]或去离子水,放入6 cm×6 cm×9 cm 电解池中,土壤中除草剂具体浓度同表1。石墨毡(6 cm×9 cm×0.5 cm)为阳极,不锈钢网(6 cm×9 cm×3 层)为阴极,以电解库伦法降解7 d(图2‑A、B)。每隔2 cm 取点(图2‑C)测土壤pH、电导率及除草剂去除率。氯氟吡啶酯处理分为6 组,F1(不加碳纤维)、F2(碳纤维2 g)为对照组不加电,F3、F4、F5、F6(碳纤维2 g)施加电压分别为5 V、10 V、10 V、10 V,其中F5 加去离子水,其他条件不变。高效氟吡甲禾灵(H)分组同F。用SPSS 26.0 软件进行单因素方差分析,比较不同实验组土壤pH、电导率的差异,用最小显著差异法(LSD)进行两两比较,下同。

表1 真菌与MFC 降解方案设计Table 1 Degradation scheme of fungi and MFC

图2 EK 降解实验Fig.2 Methods of EK degradation
1.2.3 真菌降解实验 80 mL 液体培养基中加10 mL除草剂,分别接种踝节菌(T)、疣孢漆斑菌(M),即F+T、F+M、H+T、H+M(表1),避光25℃培养14 d。80 mL 无机盐培养基中加10 mL 液体培养基、10 mL 除草剂,接种上阶段10 mL 菌液。每隔7 d 逐渐减少液体培养基的量,保持无机盐培养基和除草剂量不变,至不加液体培养基,此时,两菌对F、H的耐受浓度分别为0.18 mg/mL、0.47 mg/mL。取350 g 灭菌土壤,加入20 mL 除草剂溶液,接种相应菌液20 mL,无菌水调节土壤含水率保持在30%,封口25℃避光60 d,每隔15 d 搅匀土壤后取样测试。
1.2.4 MFC 降解实验 400 mL 无机盐培养基中加10 mL 除草剂溶液、10 mL 液体培养基、20 mL 对应菌液,连接不锈钢网电极及导线封口,避光25℃培养7 d 后加电驯化。第1 天0.2 V 加电4 h。第2 天0.5 V 加电4 h。第3、4 天0.5 V 加电12 h。第5、6天0.8 V 加电12 h。第7 天1 V 加电12 h,持续5 d。更换电极方向,继续每天1 V 加电12 h,7 d 后将真菌接入MFC。取350 g 灭菌土壤,加入2 g 碳纤维,60 mL 模拟电解液,20 mL 除草剂溶液,20 mL 菌液。MFC 内尺寸6 cm×6 cm×9 cm,底部有9 个d = 9 mm 小孔(图3‑A-C),便于O2进入。空气阴极采用石墨毡6 cm×6 cm×0.5 cm,阳极选用不锈钢网(6 cm×6 cm×3 层),接入导线压实,避免短路,25℃避光30 d。每隔15 d 取近阴阳极1 cm 土壤(图3‑D)测试。方案设计见表1。

图3 MFC 降解实验Fig.3 Methods of MFC degradation
1.2.5 除草剂降解动力学分析 采用Langmuir‑Hinshelwood 模型用Origin2018 软件进行动力学分析,方程为:
式中C0:污染物初始浓度;n:反应级数;K:反应速率常数;t:反应时间(d)。

2 结果
2.1 EK降解
在EK 研究中,F4 和H4 组的模拟电解液含有Na+、SO42-、HCO3-及NO3-,发现F4、H4 各点去除率均高于F5、H5(去离子水对照),距阳极4 cm 点获得最高去除率71%(F)、38%(H)。除草剂去除率随极板两端外加电压的升高而提高(图4‑G-H)。F6 和H6 组添加了碳纤维条,各点去除率均高于未加碳纤维的F4、H4,距阳极4 cm 点获得最高去除率80%、54%(图4‑G-H)。施加5 V 电压的F3 和H3 组pH 变化不明显,施加10 V 的F4、H4 组pH降低,2 cm 点下降幅度大于6 cm 点(P < 0.05)(图4‑A-B),原因是电解过程中,阳极产生H+,同时SO42-、HCO3-、NO3-等酸根离子向阳极移动,使2 cm 点pH 减小,而阴极产生OH-,同时Na+向阴极移动,使近阴极的6 cm 点pH 增大。添加碳纤维的F6、H6,其pH 变化比未添加的F4、H4 更剧烈,且距阳极越远pH 值越高(图4‑A-B)。与0 V 和5 V 相比,施加10V 的各组各点电导率降低(图4‑CD),5 V 和10 V 各组电流密度随时间增加而下降(图4‑E-F),说明土壤中可移动离子减少,可能是由于土壤中除草剂去除量增加,在电场作用下产生可移动离子量小于迁移出土壤的离子量[22]。各组4 cm点电导率低于2 cm、6 cm 点(P < 0.05),因为在电场作用下,离子向两极移动,导致两极中间位置的离子数量减少。
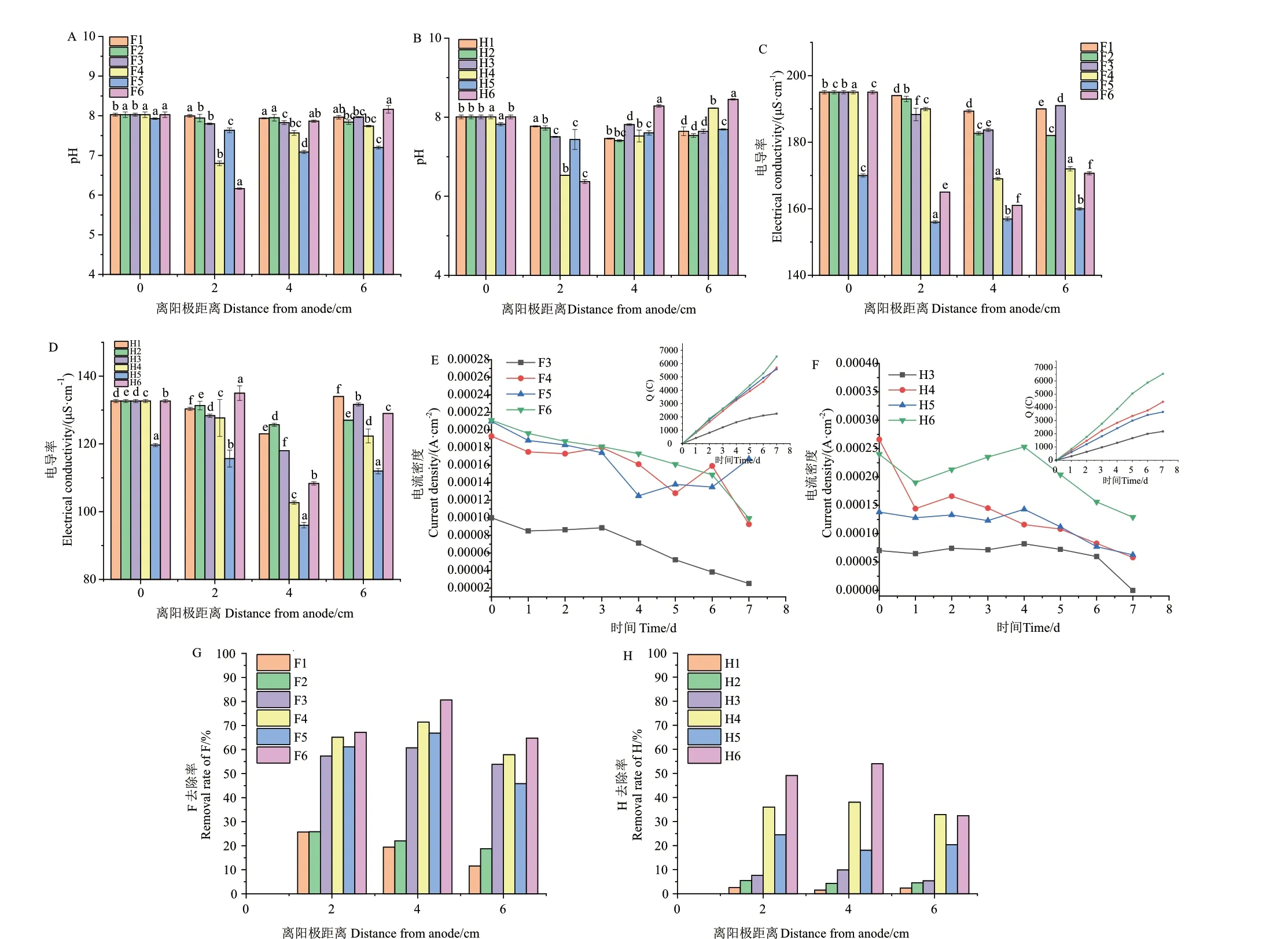
图4 EK 修复结果Fig.4 Results of EK remediation
2.2 真菌降解
修复30 d后,与单菌相比,混合菌去除效果更佳,两除草剂去除率分别为100%、37%,60 d 后各组F均被完全去除,疣孢漆斑菌对H 的去除效果最佳,去除率为61%(图5‑E-F);两种除草剂的真菌修复效果均比EK 好。60 d 后,F+T、F+M 和F+T+M 组电导率比对照组增加了285%、256%、257%(P <0.05),H 组与F 组电导率变化趋势相似(图5‑C、D),土壤中阴离子和阳离子数量在真菌降解除草剂的过程中明显增加。这可能与除草剂降解过程中释放Cl-和F-有关,还可能与真菌新生与死亡的动态变化有关。与对照组相比,各组在各时点的土壤pH 呈现波动变化(图5‑A、B),但与EK、MFC 相比,pH变化幅度较小,说明真菌修复较温和。

图5 真菌修复Fig.5 Fungal remediation
2.3 MFC降解
接入真菌稳定2 d 后,与空白对照和单菌相比,混合菌MFC 电性能最好(图6‑A、D),F+T+M 组电流密度稍高于H+T+M,但电压以及功率密度低于H 组;由于真菌适应MFC 系统和除草剂需要一定时间,F 组与H 组在修复初期差异不明显。修复15 d,与其他组相比,疣孢漆斑菌MFC 电性能最好(图6‑B、E),且H+M 组的电流密度和功率密度明显高于F+M 组,可能由于投加高效氟吡甲禾灵浓度高于氯氟吡啶酯,H 组真菌代谢及氧化还原反应更加活跃,产生电子多。修复30 d,与混合菌和踝节菌组相比,疣孢漆斑菌MFC 组电性能仍然更好(图6‑C、F),且H+M 组仍优于F+M 组,推测由于F 较易降解(图6‑K、L),残余量更少,氧化还原反应弱于H 组。相比其他组,疣孢漆斑菌MFC 对两种除草剂去除效果最好,30 d 后去除率分别为100%、62%,且阳极去除率略高于阴极(图6‑K、L)。随着时间的增加,各组阴极pH 越来越高于阳极,第30 天更加明显,如H+T+M 组阴极pH 达到8.34(P < 0.05)(图6‑G、H),这是由于阴极表面反应消耗H+而导致阴极pH 升高,同时阳极附近会产生H+降低pH[24]。第30 天,F+T、F+M 与F+T+M 组 电 导 率相比对照组增加了38%、136%、120%(P < 0.05),H 组趋势相似(图6‑I、J),说明在修复过程中,土壤中阴离子及阳离子数量明显增加;且阳极电导率大于阴极,如第30 天F+M 组阳极电导率比阴极高20.6%(P< 0.05),原因是盐离子随着水分的蒸发而向上扩散至土壤表层。
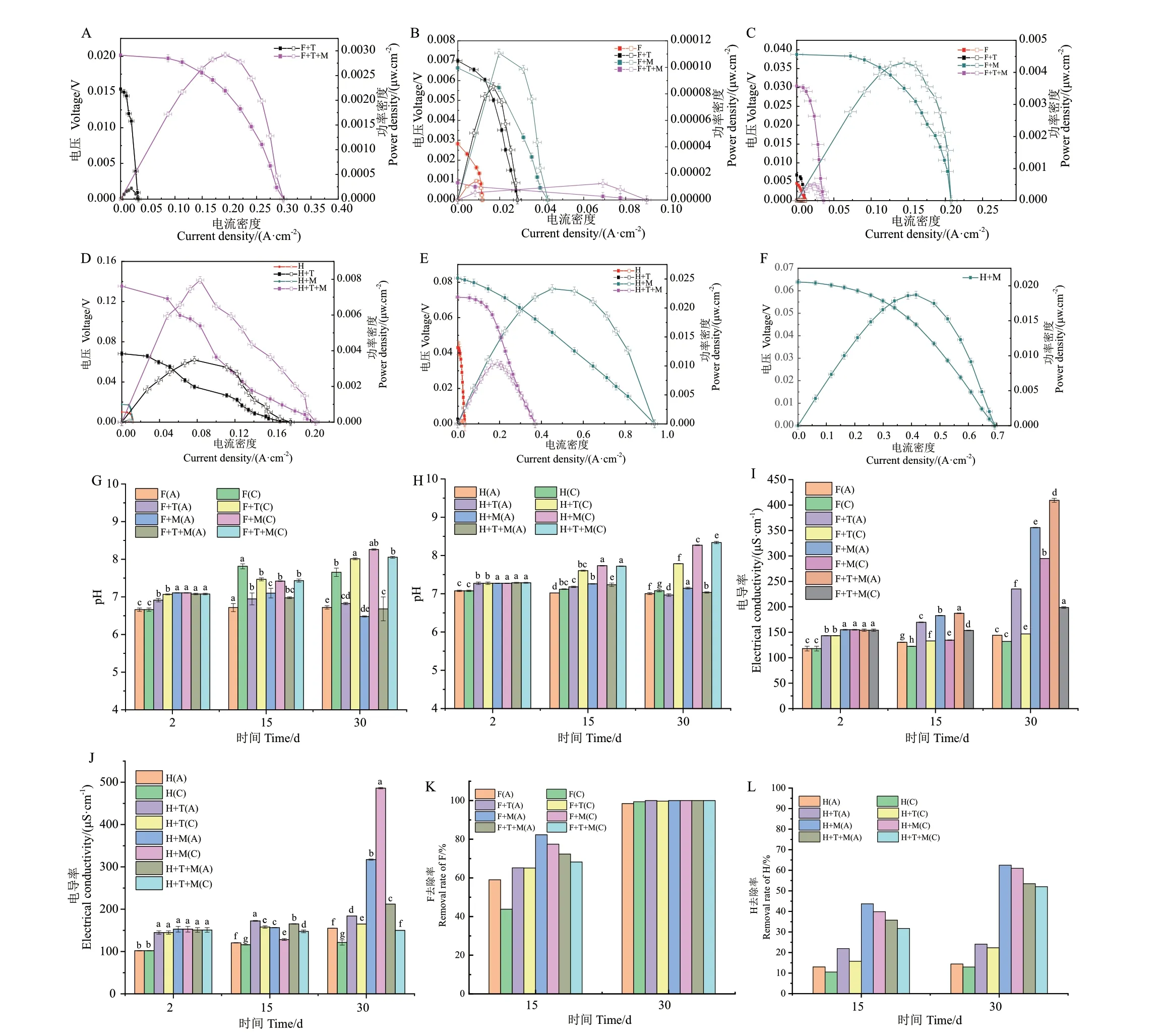
图6 MFC 修复Fig.6 Results of MFC remediation
2.4 降解路径推测
对除草剂降解产物进行了GC‑MS 检测,质谱图见图7‑A、B。氯氟吡啶酯降解产物为氟氯吡啶酸(halauxifen,C13H9Cl2FN2O3),离子碎片信息见图7‑C,降解路径推测如图7‑F,C‑F 键断裂,随后连接苯酚的C‑O 键断裂,得到降解产物。由于氟原子比氧原子半径大、金属性差距大,所以其极性差距较大,C‑F比C‑O 键极性强、键长较长、键能较小、更容易断裂[25]。高效氟吡甲禾灵降解产物/中间体为乙酸大茴香酯(4‑methoxybenzyl acetate,C10H12O3)、氟吡甲禾灵(haloxyfop‑methyl,C16H13ClF3NO4),离子碎片信息分别见图7‑D、E,降解路径推测如图7‑G,先断裂配位键得到氟吡甲禾灵,再断裂C‑O、C‑C 键得到乙酸大茴香酯,卤族元素F、Cl 得到有效去除。
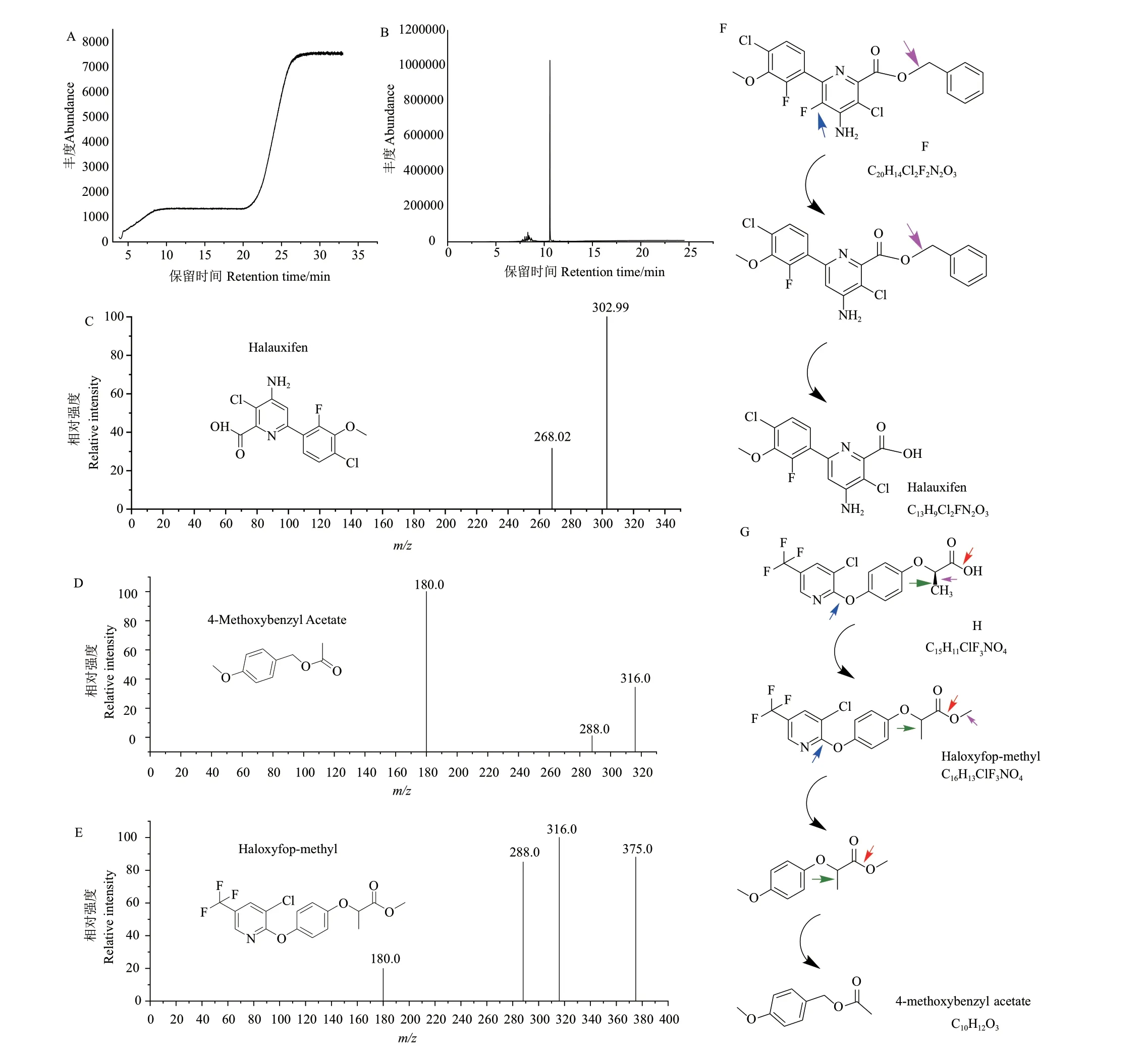
图7 除草剂降解产物Fig.7 Degradation products of herbicides
2.5 动力学分析
对除草剂降解变化规律进行零级、一级、二级反应动力学方程拟合(表2)。电动力、微生物、MFC 处理时,氯氟吡啶酯浓度的变化规律均符合一级动力学反应,高效氟吡甲禾灵浓度的变化规律分别符合一级、二级、二级动力学反应。一级反应是指反应速率与底物浓度的一次方成正比,反映的多为基元反应[26],而微生物参与的降解高效氟吡甲禾灵的过程包含众多复合反应,因此二级反应方程更好地模拟了这一过程。两种除草剂的降解速率常数为:微生物< MFC < EK,由降解速率常数求出两种除草剂的降解半衰期:微生物> MFC > EK。

表2 除草剂降解动力学拟合Table 2 Degradation kinetics of herbicides
3 讨论
除草剂不止会造成环境污染,也会间接对人体造成伤害,例如长时间接触除草剂可能诱发中枢神经系统肿瘤[27]。微生物修复技术是利用微生物对污染物的代谢作用转化、降解污染物,是处理土壤、沉积物、水和废水中各种有机污染物的常用方法[28],包括生物刺激、生物强化技术等[5,29]。与细菌相比,真菌的代谢功能同样十分多样化,对各种环境和胁迫因素的适应能力同样非常强[13,30],但是在生物强化中的应用较少,尤其是在生物强化MFC 中的应用尚未见报道。本研究发现疣孢漆斑菌与踝节菌对两种除草剂均有良好的去除效果,尤其疣孢漆斑菌。微生物修复效果优于EK,且成本低,对环境友好,但处理60 d 才能达到MFC 30 d 的去除效果,耗时较长。
空气阴极MFC 是一种生物刺激手段[31],在有机污染物去除方面潜力巨大。在MFC 的阳极,产电微生物将污染物被氧化时产生的电子通过外电路传输到阴极,最终以O2作为电子受体,同时与质子结合形成水[6]。赵晓东等[24]以四环素为研究对象构建土壤MFC,58 d 后四环素降解率为70%。黄阳天等[32]从海泥中筛选到高产脂肪酶的假单胞菌属Pseudomonas putida 和芽孢杆菌属Bacillus substills 菌株,用其构建的MFC 具有产电性能。本研究发现疣孢漆斑菌生物强化可以辅助MFC 修复污染土壤,它既能降解有机污染物又具有良好持久的产电特性。经驯化后,F、H 在30 d 内去除率分别为100%、62%,均高于EK 与微生物修复。本研究整个试验过程均在避光条件下进行,且未添加任何氧化剂,理论上各处理对除草剂的水解能力一致,因此非生物降解并非去除除草剂的主要途径。对照组的氯氟吡啶酯去除率约50%,推测可能发生吸附和非生物介导的水解等反应。对照组的高效氟吡甲禾灵去除率在10%左右,而实验组去除率远远高于对照组,提示吸附对于污染物去除的贡献远低于降解。在微生物电场刺激下,污染物降解速率提高,电场对微生物表现出定向筛选作用[33],促进具有异质降解功能的菌在阳极定殖生长;它们以及外加菌株能够适应以除草剂和土壤有机质为营养源,贫营养环境可能更有利于污染物的MFC 降解。
本研究的EK、微生物、MFC 处理均能完全去除氯氟吡啶酯,而高效氟吡甲禾灵不易被去除,原因可能是:(1)虽然各组等体积添加除草剂溶液,但氯氟吡啶酯浓度(1.7 mg/mL)远低于高效氟吡甲禾灵(4.3 mg/mL)。(2)氯氟吡啶酯为激素类除草剂,相对易降解[7],例如其在稻田中半衰期<1 个月[34];而高效氟吡甲禾灵为芳氧苯氧丙酸酯类除草剂[35],性质较稳定。(3)两种除草剂的物理化学性质相差较大,经微生物转化产生的代谢中间体迥异,这些因素对降解难易程度的影响十分复杂,有待深入研究。还应注意实验室估算的半衰期不能真实反映除草剂在田间的去除情况;土壤理化性质的复杂性对除草剂在土壤中的动态变化影响很大,如电导率、pH 等[36]。与细菌相比,真菌结构更复杂,对外界环境变化有较强的抵抗力,本研究的真菌修复和真菌强化MFC 修复提示了真菌在相关领域的应用潜力。相比踝节菌,疣孢漆斑菌对实验修复条件适应性更强,另外不同真菌对不同除草剂的亲和性和耐受性差异较大,以及两种菌株转化产生中间体的差异,均需进一步研究。EK、MFC 处理中添加了碳纤维条。未添加碳纤维的EK 组污染物转化率明显低于添加组,这是因为土壤的巨大内阻严重限制了土壤内离子的移动,致使电流密度小,除草剂去除率较低;导电碳纤维的加入有效降低土壤内阻,若外加电压相同,则电流密度有所提高,从而提高污染物去除率。土壤的巨大内阻也会限制MFC 的发电量以及修复效率,而碳纤维的加入有效地辅助阳极收集电子,可能是碳纤维产生一个导电网络,促进电子在土壤内的转移[37]。碳纤维很容易从修复后的土壤中分离出来,循环利用。
4 结论
EK 修复中,添加模拟电解液、碳纤维条、加电10 V 的处理组7 d 后氯氟吡啶酯和高效氟吡甲禾灵去除率分别为71%和38%。真菌修复中,添加疣孢漆斑菌实验组60 d 后两种除草剂去除率分别为100%和61%。MFC 修复中,由疣孢漆斑菌构建的MFC 30 d 后两种除草剂去除率分别为100%和62%,且阳极去除率略高于阴极。氯氟吡啶酯降解产物为氟氯吡啶酸,高效氟吡甲禾灵降解产物为乙酸大茴香酯,三种方法均能有效去除两种除草剂中的卤族元素F 和Cl。三种处理方法中氯氟吡啶酯浓度的变化均符合一级动力学反应,而真菌与MFC 修复中高效氟吡甲禾灵浓度变化均符合二级动力学反应。将电化学修复与微生物修复耦合的MFC 既可以修复污染土壤又能产生电能,是一种经济有效的修复策略,有望应用于多种场景的土壤修复。

