γ-氨基丁酸对绵羊卵巢颗粒细胞凋亡及类固醇激素分泌的影响
单新雨 李太春 杨若晨 段香茹 康佳 张英杰 刘月琴
(河北农业大学动物科技学院,保定 071000)
γ-氨基丁酸作为一种具有4 个碳原子的非蛋白质氨基酸,广泛分布于动植物和微生物中[1],同时,GABA 作为机体内不可或缺的一种抑制性神经递质,具有调节情绪、降低血压、调节血糖、改善肥胖、改善肝肾功能、调节免疫应答、促进胰岛素分泌、促进生殖等生理功效[2],并对癫痫、惊厥、亨廷顿病和帕金森病等多种精神疾病具有一定的疗效作用[3-4]。此外,GABA 通过下丘脑-垂体-性腺轴系影响垂体和性腺生理机能,从而参与激素的分泌调节,影响卵巢、输卵管的功能[5-6]。GABA 目前是热门的保健品,以GABA 胶囊、GABA 茶、GABA软糖等一系列产品的形式在市面上流通,具有抗焦虑,调节血压,镇静安神,改善睡眠等功效[7-9],在动物生产中作为添加剂可以促进采食、增强营养物质消化吸收和代谢[10-12],并发现能够改善雌性动物繁殖性能[13]。因此,GABA 在食品保健、生物制药、饲料添加剂等领域的应用前景十分广阔,近年来有关GABA 的研究逐渐成为热点,人们对GABA 的了解也逐渐深入、清晰。
调控动物繁殖性能机制十分复杂,其中,卵泡的排卵与质量至关重要,卵泡的发育依赖于卵母细胞及GCs 间的细胞通讯[14-15],GCs 分泌的类固醇激素可以维持卵母细胞发育成熟[16-17],而GCs 凋亡可直接导致卵泡闭锁[18]。GABA 在30 多种外周组织中表达,包括下丘脑、垂体、子宫、卵巢、胎盘和输卵管等。研究表明,在大鼠和人的体外试验中适宜浓度的GABA 可直接作用于GCs,影响GCs类固醇激素的生成[19-22],高浓度的GABA 可增加人黄体化GCs 凋亡[21]。不同动物生殖生理存在差异,GABA 是否对绵羊GCs 功能有调节作用未见报道。因此,本试验通过在绵羊卵巢GCs 培养体系中添加不同浓度的GABA,研究其对GCs 凋亡、类固醇激素的分泌及其相关基因表达的影响,以期揭示GABA 对绵羊繁殖机能的影响。
1 材料与方法
1.1 材料
从河北省保定市唐县瑞丽食品屠宰场采集体况良好的1-1.5 岁龄体重相似、饲养条件相同的性成熟健康小尾寒羊母羊新鲜卵巢,酒精及生理盐水清洗后立即放入含37℃生理盐水、1%双抗(1%青霉素、1%链霉素)的保温杯中并于2 h 内带回实验室。
1.2 方法
1.2.1 卵巢颗粒细胞培养 用75%酒精冲洗卵巢3次,37℃的生理盐水冲洗卵巢3 次,最后用含1%双抗的DMEM/F12 培养基冲洗1-2 次,放入完全培养基(10%胎牛血清(FBS)、2%双抗的DMEM/F12培养基)中,用灭菌手术刀片逐个割破直径3-7 mm的卵泡,收取卵泡液于培养基。将培养基转移到15 mL 离心管中离心(1 500 r/min,10 min)。弃去上清液,留下沉淀,加入完全培养基吹散沉淀使其均匀悬浮后离心(1 500 r/min,10 min),重复该步骤3 次。重悬浮GCs 并转移至细胞培养瓶于37℃,5% CO2的培养箱中培养,24 h 后更换培养基,去除未贴壁细胞。绵羊卵巢GCs 培养于完全培养基中,在恒温培养箱中(37℃,5% CO2)松盖培养,每1-2 d 换液一次,当细胞长至80%再消化传代。
1.2.2 GCs 免疫荧光鉴定 GCs 特异性表达促卵泡素受体(FSHR),免疫荧光法鉴定分离培养的绵羊卵巢GCs。将绵羊GCs 以1×105个/孔接种于含10% FBS、1%双抗的DMEM/F12 培养基的六孔板中,在37℃,5% CO2的培养箱中培养24 h 后吸去培养基;每孔加入4%多聚甲醛固定细胞15 min;4℃预冷多聚甲醛固定细胞20 min;0.2%的Triton X‑100室温通透细胞10 min;BSA 封闭液室温孵育30 min;加入稀释好的一抗(Rabbit Anti‑FSH receptor antibody)并放入湿盒,4℃孵育过夜;加入稀释好的 荧 光 二 抗(Mouse Anti‑rabbit IgG/Bio antibody),37℃孵育90 min;加入DAPI 染液,室温避光孵育10 min;每次操作完毕试剂反应完成后,PBS 浸洗细胞3 次;放在荧光显微镜下观察并拍照。
1.2.3 颗粒细胞增殖检测 将绵羊GCs 悬液以5×103个/孔接种于96 孔板中,分为5 组,每组4个重复,添加10 μL 不同浓度的GABA,使5 个组的浓度分别为0、10-8、10-7、10-6和10-5mol/L,每孔的最终体积为100 μL,于培养箱(37℃,5% CO2)中孵育24 h;向每孔加入10 μL CCK‑8 溶液后放入培养箱中孵育3 h;15 min 内用酶标仪测定各处理组450 nm 处的吸光度。
1.2.4 颗粒细胞凋亡检测 将绵羊GCs 在六孔培养板中以105个/孔的密度培养,分为5 组,每组3 个重复,添加0、10-8、10-7、10-6和10-5mol/L GABA处理24 h,离心收集生长状态良好细胞;用1×PBS(4℃)重悬细胞一次后离心(2 000 r/min,10 min);加入500 μL 的1×Binding Buffer 悬浮 细胞;加入5 μL 的Annexin V‑FITC 混匀后,室温避光孵育15 min;加入5 μL 的PI 染色;利用流式细胞仪检测细胞凋亡。
1.2.5 E2和P4的检测 以添加10-6mol/L GABA 为试验组,不添加GABA 为对照组,试验组和对照组GCs 在六孔培养板中以105个/孔的密度培养,每组3 个重复,细胞长至80%时收集细胞培养液,离心(3 000 r/min,10 min)取上清液,采用ELISA 试剂盒(上海酶联生物科技有限公司)检测细胞培养液上清中E2和P4的浓度。
1.2.6 RT‑qPCR 检测基因表达 Trizol 法提取试验组及对照组细胞总RNA,并使用NanoDrop 2000 分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)测定浓度,反转录试剂盒将RNA 反转录成cDNA,离心管中加入1 μL cDNA,正义链和反义链引物各0.4 μL,使其工作浓度为0.2 μmol/mL,2×TransStart®Tip Green qPCR Super mix(+Dye I)10 μL,最后加入8.2 μL 灭菌水补足20 μL 体系。使用Step One Plus 仪 器(Applied Biosystems,Carlsbad,CA) 对PCNA、CCNB1、CCND1、Bax、Caspase‑3、Bcl‑2、StAR、3β-HSD、CYP11A1、CYP19A1 的 表 达量进行检测,条件为95℃预变性2 min;95℃变性5 s,60℃退火30 s,40 个循环;熔解曲线阶段95℃15 s,60℃ 1 min,95℃ 15 s。通过熔解曲线分析验证每个PCR 扩增的特异性,以GAPDH 为内参基因,RT‑qPCR 结果采用2-ΔΔCt法进行分析。引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.2.7 Western blot 检测蛋白表达 样品总蛋白采用总蛋白提取试剂盒(Thermo Pierce)进行提取,然后采用BCA 定量试剂盒进行总蛋白定量。在分离胶上对总蛋白进行分离,经过转膜、封闭,然后于4℃进行一抗过夜孵育及室温进行羊抗兔二抗孵育60 min 后进行曝光及显影和定影并拍摄照片。抗体信息如表2 所示。

表2 一抗信息Table 2 Primary antibody information
1.2.8 数据统计分析 使用SPSS 26.0 软件进行统计学分析,单因素方差分析(one‑way ANOVA,LSD)用于确定多组之间的差异。两组间差异采用t 检验。显著性水平为P<0.05 差异显著,P>0.05 差异不显著,数据均以平均值±标准误表示。使用GraphPad Prism 进行作图。
2 结果
2.1 绵羊卵巢GCs鉴定
GCs 特异性表达FSHR 蛋白,免疫荧光鉴定结果如图1 所示。红色荧光标记的细胞即为表达FSHR阳性的细胞,蓝色荧光区域为DAPI 染液标记的细胞核,这表明分离培养的贴壁细胞为绵羊卵巢GCs。

图1 绵羊卵巢颗粒细胞鉴定(400×)Fig.1 Identification of ovine ovarian granulosa cells(400×)
2.2 GABA对绵羊卵巢GCs增殖的影响
不同浓度GABA 处理GCs 24 h 后的细胞增殖活力结果见图2。由图2 可见,添加GABA 处理组的细胞增殖活力均显著高于对照组(P<0.05),其中,10-6mol/L GABA 处理的细胞增殖活力显著高于其他添加组(P<0.05)。
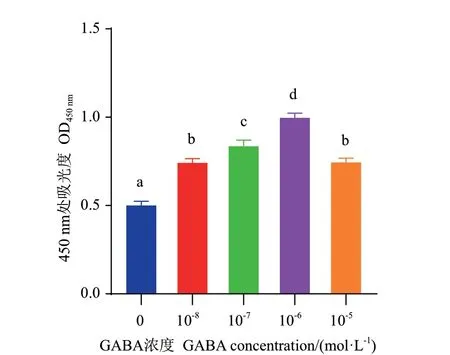
图2 不同浓度GABA 对绵羊颗粒细胞增殖的影响Fig.2 Effects of different concentrations of GABA on proliferation in ovine granulosa cells
2.3 GABA对绵羊卵巢GCs凋亡的影响
不同浓度GABA 对GCs 凋亡影响如图3 和表3所示。添加GABA 处理组的GCs 凋亡率均显著低于对照组(P<0.05),其中,10-6mol/L 组的凋亡率显著低于其他添加组(P<0.05)。

图3 GABA 处理绵羊颗粒细胞凋亡结果图Fig.3 Results of apoptosis in ovine granulosa cells treated with GABA

表3 不同浓度GABA 对绵羊颗粒细胞凋亡率的影响Table 3 Effect of different concentrations of GABA on apoptosis rate in ovine granulosa cells
2.4 GABA对绵羊卵巢GCs增殖和凋亡相关基因及蛋白表达的影响
RT‑qPCR 及Western blot 检 测10-6mol/L 的GABA 处理绵羊卵巢GCs 24 h 后增殖相关基因及蛋白表达情况如图4 所示,GABA 添加组CCNB1、CCND1 和PCNA mRNA 及蛋白表达量显著增加(P<0.05)。凋亡相关基因及蛋白表达情况如图5 所示,GABA 添 加 组Caspase‑3、Bax mRNA 及 蛋 白表达量显著降低(P<0.05),Bcl‑2 mRNA 及蛋白表达量显著增加(P<0.05),Bax/Bcl‑2 比值显著降低(P<0.05)。

图4 GABA 对绵羊颗粒细胞增殖相关基因及蛋白表达的影响Fig.4 Effects of GABA on the expressions of proliferation-related genes mRNA and proteins in ovine granulosa cells
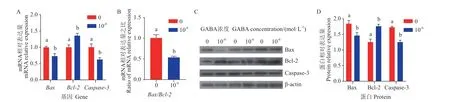
图5 GABA 对绵羊颗粒细胞凋亡相关基因及蛋白表达的影响Fig.5 Effects of GABA on the expressions of apoptosis-related genes mRNA and proteins in ovine granulosa cells
2.5 GABA对绵羊卵巢GCs E2和P4分泌的影响
10-6mol/L 的GABA 处理绵羊卵巢GCs 24 h 后,E2和P4的浓度见表4。由表4 可知,添加10-6mol/L的GABA 显著促进P4分泌(P<0.05)且显著抑制E2分泌(P<0.05)。

表4 10-6 mol/L GABA 对绵羊GCs 类固醇激素分泌的影响Table 4 Effects of 10-6 mol/L GABA on steroid hormone secretion of GCs in ovine granulosa cells
2.6 GABA对绵羊卵巢GCs类固醇激素合成关键基因及蛋白表达的影响
10-6mol/L GABA 处理GCs 后类固醇激素合成相关基因及蛋白的表达结果如图6 所示,与对照 组 相 比, 处 理 组StAR、3β‑HSD、CYP11A1 的mRNA 及蛋白相对表达量显著上升(P<0.05),且试验组CYP19A1 的mRNA 及蛋白表达量显著下降(P<0.05)。
3 讨论
3.1 GABA对GCs增殖和凋亡的影响
卵巢GCs 凋亡可导致卵泡的闭锁[23]。研究表明GABA 能够有效减少活性氧(ROS)含量,从而抑制人脐静脉内皮细胞凋亡[24]。给热应激雏鸡灌服50 mg/kg BW GABA 水溶液能够减少胰腺细胞凋亡[25]。有研究发现100 μmol/L GABA 处理奶牛乳腺上皮细胞(MAC‑T)12 h 能促进脂多糖(LPS)介导的MAC‑T 细胞增殖,并可能通过PI3K/AKT 通路抑制内源性LPS 诱导的MAC‑T 细胞凋亡[26]。GABA可能通过调节蜕膜细胞和滋养层细胞的增殖,从而参与小鼠胎盘的形成过程[27]。在肺上皮细胞,GABA 通过细胞膜上的GABAA受体引起细胞膜去极化,从而使膜上电压依赖性钙通道开放,胞浆钙浓度升高,促进细胞增殖[28]。本试验研究发现,在绵羊卵巢GCs 中添加GABA 能够促进细胞增殖并抑制细胞凋亡,与前人在其他细胞类型的研究结果一致。
细胞核抗原PCNA 作为细胞增殖标志物,通过结合DNA 聚合酶促进DNA 复制,对细胞的增殖水平起正向调控[29];而细胞周期蛋白B1(Cyclin B1,CCNB1)是有丝分裂开始的主要调节因子之一,细胞周期蛋白D1(Cyclin D1,CCND1)控制细胞周期从G1 期进入S 期[30],是细胞增殖的重要调控因子。本研究中,GABA 处理GCs 后PCNA、CCND1、CCNB1 mRNA 及蛋白表达量显著上升,表明GABA可促进GCs 增殖。细胞凋亡与B 细胞淋巴瘤蛋白2(B cell lymphoma protein 2,Bcl‑2)和半胱天冬酶家族(Caspase)有关[31-33],Bcl‑2 能够抑制细胞色素c 从线粒体释放,从而抑制内源性细胞凋亡[34-35],Caspase‑3 参与了细胞最终凋亡过程[36-37]。而Bcl‑2相关X 蛋白(Bcl‑2‑associated X protein,Bax)/Bcl‑2比值作为反映细胞凋亡敏感性的分子标志物[38],其比值上升时,Bax 容易形成同源二聚体,进而诱导细胞凋亡,而当其比值降低时,Bcl‑2 将发挥抑制细胞凋亡的功能[39]。本研究中,GABA 处理GCs 后上调Bcl‑2 mRNA 及蛋白表达,下调Bax、Caspase‑3 mRNA 及蛋白表达,且Bax/Bcl‑2 比值降低。这表明GABA 处理GCs,可抑制其凋亡。
3.2 GABA对GCs的E2和P4分泌水平的影响
GCs 可通过分泌E2和P4类固醇激素来维持卵巢正常的生理功能[40]。E2协同FSH 促进卵泡发育,诱导排卵前LH 峰的出现,促进排卵[41-42]。P4的重要作用是维持动物妊娠生理,利于胚胎着床[43]。此外,P4还能调控卵母细胞排卵及GCs 黄体化[44]。姜杰等[20,22]发现GABA 通过与其受体结合促进大鼠黄体化GCs 的P4分泌,抑制E2的生成,可能与细胞内腺苷酸环化酶系统有关。本试验结果与前人研究结果一致,GABA 促进绵羊卵巢GCs P4的分泌,抑制E2的生成。急性调节蛋白(StAR)在类固醇激素合成过程中将细胞质中的胆固醇转运到线粒体中,是类固醇激素合成的重要限速酶[45],参与P4分泌[46]。本试验中,GABA 处理GCs 后StAR 表达显著上升,与P4分泌变化趋势一致。CYP11 编码的细胞色素P450 胆固醇侧链裂解酶(CYP11A1)是类固醇激素合成中从胆固醇到孕烯醇酮的关键酶[47-48],3β-羟化类固醇脱氢酶(3β-HSD)催化孕烯醇酮或脱氢表雄酮生成有活性的P4和雄烯二酮,其编码基因3β-HSD 表达量与卵泡液中P4含量呈正相关[49]。本 试 验 中,经GABA 处 理 的GCs 基 因3β-HSD、CYP11A1 mRNA 及蛋白表达量上调,这与P4分泌变化趋势一致。由CYP19 编码的芳香化酶可以催化雄烯二酮及睾酮生成E2和雌酮[50-51]。本文中,GABA处理GCs 后CYP19A1 mRNA 及蛋白表达量显著下降,与E2分泌变化趋势一致。
4 结论
GABA 通 过 上 调CCNB1、CCND1、PCNA、Bcl‑2 基 因 表 达,下 调Caspase‑3、Bax 基 因 表 达,从而促进GCs 的增殖,抑制其凋亡;通过上调CYP11A1、StAR、3β-HSD 基因表达,下调CYP19A1基因表达,从而促进GCs 的P4分泌,抑制E2生成。

