马铃薯StDof5 的克隆及表达分析
梅显军 宋慧洋 李京昊 梅超,3 宋倩娜,3 冯瑞云,3陈喜明
(1.山西农业大学玉米研究所,忻州 034000;2.山西农业大学农学院,太谷 030800;3.山西省农业科学院作物科学研究所,太原 030031)
马铃薯是中国重要的粮菜兼用作物,折粮后产量居第四位,仅次于小麦、玉米与水稻,具有生长周期短、适应性强、产量高,块茎生长无限制等生产优势,具有很大的增产潜力,在保障国家粮食安全中起重要作用。马铃薯是盐中度敏感型作物,作为全球重要的粮食作物,目前推广应用的马铃薯品种大多耐盐性较差,马铃薯叶片在碱胁迫下发生萎蔫、植株枯萎,不能正常生长,因此,提高马铃薯品种耐盐碱能力是有必要的。
Dof 基因家族是植物中特有的一类单锌指蛋白超家族(single zinc finger protein superfamily)[1],它们在植株生长调控、信号传导、种子萌发、光周期响应、非生物胁迫[2]和开花调控中发挥重要作用[3]。其家族成员一般包括4 个部分,分别是N‑末端寡聚化位点、Dof 结构域、核定位信号区和转录激活结构域[4-5],Dof 保守结构域是由52 个相对保守氨基酸残基构成的C2‑C2 型单锌指结构域[6],包含着4 个绝对保守的Cys 残基[7],但C‑末端的转录激活结构域不具备保守性[8]。Dof 转录因子最早在玉米中发现[9],一般具有200-400 个碱基,仅包含1 个Dof 保守区和2 个转录区[10]。Dof 转录因子的研究对象多为模式植物以及多年生植物(如拟南芥、水稻[11]、番茄[12]、核桃[13]和玉米[14]等),由于家族成员C 末端转录调控域具有不同的氨基酸序列,推测其具备多种功能作用[15]。DOF 家族转录因子Cycling Dof Factor 1(CDF1)在马铃薯中与植物抗逆和块茎发育有着直接联系,且参与调控盐胁迫响应。近年研究发现,低温、干旱及NaCl 等3 种胁迫处理均提升了ABF4 的表达[16];拟南芥中SnRK2s 亚家族与ABI5 相互作用,经NaCl 和山梨醇处理后,SnRK2s 亚家族mRNA 的表达水平总体表现为先上升后下降,SnRK2.2、SnRK2.4、SnRK2.5、SnRK2.8 及SnRK2.10 对干旱胁迫具有强烈响应[17];AtMYB2 的mRNA 在盐胁迫和脱落酸(ABA)处理情况下会开始积累。此外,过表达MYC2 和/或AtMYB2 转基因植株表现出一定程度的ABA 敏感性增强[18]。AtMYC2 和AtMYB2 过表达的转基因植株中ABA 诱导的一些基因表达上调。在干旱和盐胁迫下,AtMYC2 和AtMYB2 蛋白都在ABA 表达调控中起重要作用;DREB1A 和DREB2A 能够调控玉米生长和提升非生物胁迫抗性[19];ABI3 和ABI5 在拟南芥不同组织和胁迫处理表现特定差异,以此在响应植物逆境胁迫中发挥重要功能[20-22]。
目前,只有StDof2 转录因子在彩色马铃薯中的相关研究,StDof2 蛋白与棉花GhDof1 的亲缘关系最近,过量表达GhDof1 能提高棉花抗盐性和抗冻能力,但关于马铃薯StDof5 在抗盐胁迫方面的研究还较为罕见。
本研究以马铃薯底西芮为转化材料,通过克隆StDof5,分析其氨基酸序列,构建StDof5 的过表达载体,转化至底西芮愈伤组织筛选出阳性植株并确定其基因功能,研究过表达StDof5 在马铃薯中转录情况,同时检测相关胁迫响应基因ABF4、SnRK2s、MYB2、DREB2A、ABI3 和ABI5 等的表达,为获得抗盐逆境胁迫新品种提供一定的理论和技术基础。
1 材料与方法
1.1 材料
无菌组培苗马铃薯品种底西芮(DES)由山西农业大学农学院植物基因编辑实验室保存。
过表达阳性植株与野生型继代在固体MS 培养基(MS 粉含蔗糖和琼脂粉)生长,25 d 后选取长势一致的过表达阳性植株与野生型进行生长表型试验。继代在0、50、100 和150 mmol/L 浓度的氯化钠MS培养基生长,进行过表达阳性植株与野生型继代,并观察生长表型。
过表达阳性植株与野生型在固体MS 培养基中生长25 d 后收集材料,‑80℃保存备用。采用1/2 Hoagland 培养液作为无土栽培营养液,配有0、50、100 和150 mmol/L 氯化钠浓度的1/2 Hoagland 营养液,每个处理8 个重复,过表达阳性植株与野生型清洗后移入不同盐浓度下培养,12 h 后剪去叶片‑80℃保存,后续测定相关生理指标。
马铃薯组培苗在固体MS 培养基中生长25 d 后,用1/2 Hoagland 培养液作为无土栽培营养液进行培养15 d 缓苗后进行盐胁迫试验,根据预试验结果,选取100 mmol/L 胁迫浓度对过表达阳性植株和野生型进行处理0 和12 h,采集植株的根、茎、叶部分用于RNA 提取,每组3 个生物学重复。所有采集的样品均迅速冷冻于液氮中,于‑80℃保存备用。
1.2 方法
1.2.1 农艺性状的测定 根长、株高的测定:用刻度钢尺直接测量每株苗。鲜重的称量:蒸馏水冲洗组培苗根上残留的固体MS 培养基,滤纸吸干水分后用电子天平称量每株鲜重。根数、叶片数:观察计算每株苗的根数、叶片数。
1.2.2 SOD、POD 和CAT 酶活性的测定 采用生工生物工程(上海)股份有限公司活性检测试剂盒测定过氧化物酶(peroxidase, POD)活性、超氧化物歧化酶(superoxide dismutase, SOD)活性和过氧化氢酶(catakase micrococcus lysodeikticus, CAT)活性。
1.2.3 生物信息学分析
(1)马铃薯StDof5 表达及蛋白理化性质分析。采用ExPASy(https://web.expasy.org/protscale/)分析StDof5 蛋白质的理化性质,运用在线网站Prot param(http://www.expasy.org/tools/protparam.html) 统计StDof5 蛋白质的氨基酸组成,使用TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白的跨膜结构域,运用在线工具Prot Scale(http://ca.expasy.org/tools/protscale.html)分析其亲疏水性,使用 在 线 工 具SOPMA(https://npsa‑prabi.ibcp.fr/cgi‑bin/npsa_automat.pl?page=npsa_sopma.html)预测二级结构,使用穿线法I‑TASSER(http://zhanglab.ccmb.med.umich.edu/)预测蛋白质三级结构。
(2)系统进化树的构建。利用DNAMAN 软件对28 种植物的Dof 蛋白氨基酸多序列比对。利用MEGA11 对番茄、甜辣椒、烟草等28 种不同物种Dof5 氨基酸序列构建系统进化树。
1.2.4 马铃薯StDof5 的克隆
(1)马铃薯的RNA 提取及cDNA 合成。使用植物总RNA 提取试剂盒提取马铃薯总RNA[23-25],并反转录成cDNA,以cDNA 为模板扩增StDof5 的CDS 序列。
(2)马铃薯StDof5 的扩增。从NCBI 下载马铃薯StDof5 的 序 列(Gene ID:37425596), 用Primer Premier 6.0 设计克隆引物:F:5'‑ATGGCTCAAGTT‑CAAGAAAGTC‑3';R:5'‑TCGGAGGTGCTCCTCCT‑CCT‑3'。以马铃薯叶片cDNA 为模板进行PCR 扩增,反应体系为50 μL:1 μL 模板cDNA、1 μL 引物、25 μL 2×Mix 和22 μL ddH2O,PCR 反应条件为95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 1 min,35 个循环;72℃ 5 min。产物经1.0%琼脂糖凝胶进行电泳检测、回收、测序。
(3)马铃薯StDof5 农杆菌载体的构建。将测序正确的质粒转入农杆菌中,农杆菌培养后经PCR 鉴定为阳性单克隆,将阳性单克隆进行摇菌保菌,保存‑80℃冰箱待用。
(4)马铃薯的遗传转化。试管薯的诱导:以四倍体马铃薯栽培品种底西芮(DES)为试验材料,在MS 培养基上,光照周期为16 h 光照/8 h 黑暗,温度为25℃,培养时间4 周,用于遗传转化。
农杆菌介导的遗传转化[26-35]:茎段预培养:切一定数目的茎段在预培养培养基中光照培养(48 h);菌种活化:从‑80℃取出保存的农杆菌(含有重组质粒)菌液,加入LB(含有50 mg/L Rif 和50 mg/L Kan+)液体培养基,28℃ 220 r/min,振荡活化2 d后备用;侵染:将菌液离心(3 000 r/min,10 min),收集菌沉淀,吸取上清液剩菌沉淀,加入MS 液体培养基混匀,检测OD600至0.5-0.6。将预培养茎段用镊子放于重悬的菌液中,10 min 后,茎段吹干后进行28℃暗培养48 h 后,移入愈伤组织培养基中在培养箱培养约3 周,产生愈伤球状组织时移入生芽培养基,出芽后移生根瓶,生根则初步确定为过表达阳性植株。
(5)过表达植株的鉴定。重组质粒中含有目的基因,该基因会随重组质粒整合到过表达阳性植株的DNA 上。提取预选过表达阳性植株与野生型的总DNA 为模板,利用植物表达载体携带的卡那霉素抗性对植株进行阳性鉴定。
1.2.5 转基因植株StDof5 表达量的测定 提取过表达StDof5 植株与野生型的RNA,并反转录cDNA,稀释反转录产物后作为模板进行RT‑qPCR 检测。利用NCBI Primer‑BLAST 设计qPCR 引物,引物序列见表1。以Actin 为内参基因,反应体系为 TB Green Premix Ex Taq I(Tli RNaseH Plus)(2×)10 μL、10 μmol/L 正反引物各0.8 μL、稀释后的cDNA 2 μL、ROX Reference Dye or Dye I(50×)0.4 μL 和 灭 菌水6 μL。荧光定量反应程序为95℃ 30 s;95℃ 5 s,60℃ 34 s,95℃ 15 s,60℃ 60 s,95℃ 15 s,40 个循环,DES 为对照组的表达量,利用2-ΔΔCt公式计算基因的相对表达量,利用SPSS 软件中的方差齐性检验(Levene test)、方差分析(aov 函数)及均值多重比较和进行差异显著性分析。

表1 荧光定量引物序列Table 1 Primer sequences for fluorescence quantification
2 结果
2.1 StDof5的生物信息学分析
2.1.1 StDof5 蛋白质理化性质及结构 StDof5蛋白由165 个氨基酸组成,蛋白质分子式为C800H1236N242O246S9, 原 子 个 数 为2 533 个。 组 成StDof5 蛋白共有20 种氨基酸,其中,天冬氨酸(Asp)所占比例最高为8.5%,色氨酸(Trp)所占比例最低为1.2%。带负电荷(Asp+Glu)和正电荷(Arg+Lys)的氨基酸残基总数分别为19 和21。StDof5 位于第2染色体上,其蛋白相对分子量为18 468.63 kD,等电点是8.47。脂肪族指数为51.45,不稳定系数为45.16,预测该蛋白为不稳定蛋白。
2.1.2 StDof5 蛋白质预测跨膜结构域及亲水性 通过TMHMM 分析StDof5 蛋白预测跨膜螺旋区域(图1‑A),预测得到的跨膜螺旋个数为0,预测得到1-165个氨基酸均在细胞外侧,StDof5 不属于跨膜蛋白。Prot Scale 分析StDof5 蛋白亲水性平均值为‑0.876,预测该蛋白属于亲水性蛋白(图1‑B)。

图1 StDof5 蛋白生物信息学分析Fig.1 Bioinformatics analysis of StDof5 protein
2.1.3 马铃薯StDof5 蛋白高级结构的预测 StDof5蛋白质二级结构预测结果显示(图1‑C),其中的33个氨基酸参与形成的α 螺旋占20%,β 转角占0,16个氨基酸参与形成延长链占9.7%,109 个氨基酸参与形成无规卷曲占66.06%。利用I‑TASSER 穿线法预测蛋白质三级结构(图1‑D),模型质量评估系数P‑score 为0.46,具有一定的可信度。
2.1.4 StDof5 蛋白生物信息学分析 通过NCBI 数据库对马铃薯与其他物种StDof5 氨基酸序列进行比对,结果表明,马铃薯与番茄(Solanum lycopersicum)、曼陀罗(Datura stramonium)、巴克特姆辣椒(Capzi‑cum baccatum)、甜辣椒(Capsicum annuum)、烟草(Nicotiana tabacum)的序列一致性分别为93.98%、83.24%、80.46%、79.89% 和79.41%。 采 用DNA‑MAN 进行多序列比对,28 种植物的Dof 蛋白具有一定的相似性,在100-105、158-165、168-182、188-192 处氨基酸序列(锌指结构)高度相似(图2)。利用MEGA 11 对不同物种Dof5 氨基酸序列 进 行 系 统 发 育 分 析( 图3),StDof5 与 芦 荟(XP_049370321.1)的锌指蛋白处于同一分支,具有很高的同源性。
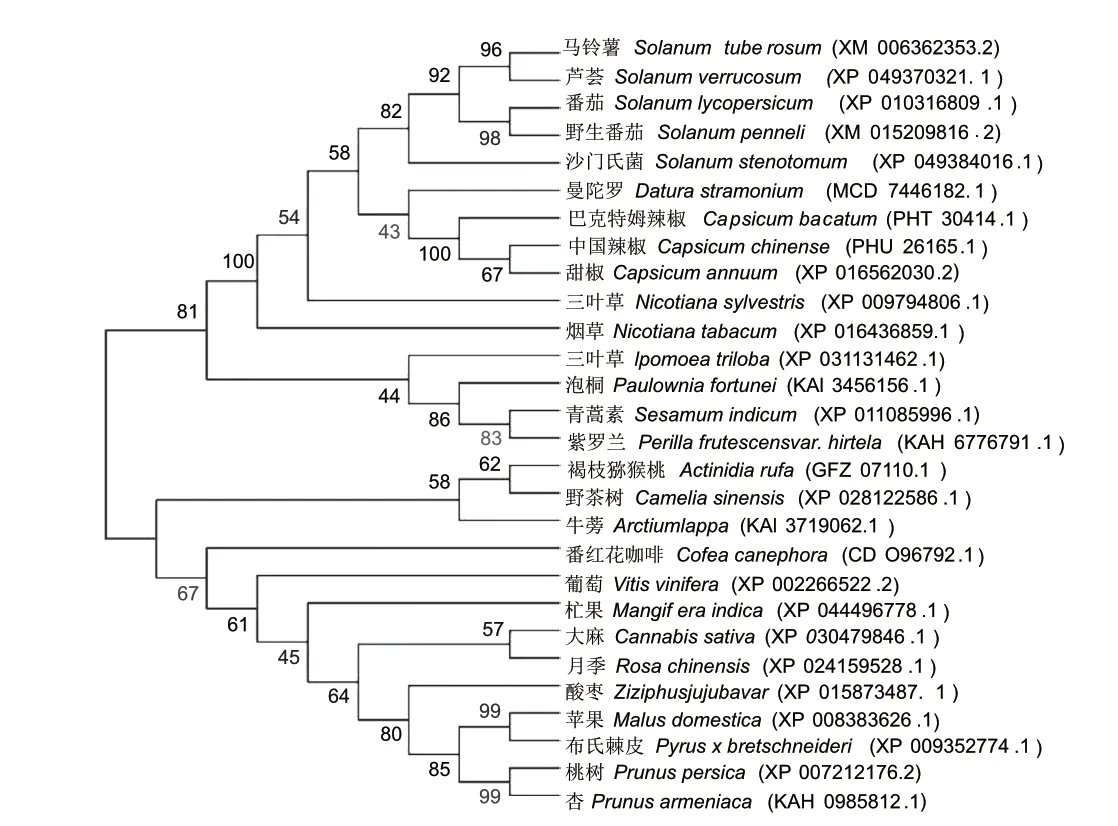
图3 不同植物中Dof5 蛋白进化树Fig.3 Evolutionary tree of Dof5 proteins in different plants
2.2 马铃薯StDof5的扩增检测
以马铃薯品种底西芮为试验材料,以cDNA 为模板,用特异性引物对目标基因进行扩增。结果(图4)表明,获得单一明亮条带,大小为498 bp。
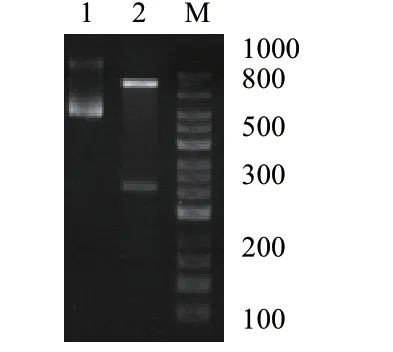
图4 马铃薯StDof5 的PCR 扩增Fig.4 PCR amplification of the potato StDof5 gene
2.3 马铃薯StDof5载体的构建
2.3.1 马铃薯StDof5 农杆菌载体构建 将PCR 鉴定为阳性单克隆(图5‑A)进行测序,选择正确的菌株进行后续遗传转化试验。

图5 马铃薯StDof5 载体的构建Fig.5 Construction of the potato StDof5 vector
2.3.2 马铃薯StDof5 的遗传转化 利用农杆菌介导遗传转化法,经预培养、暗培养、愈伤组织培养、生芽培养后移入生根瓶,如图5‑C 所示表明植株已生根,初步确定为过表达阳性植株。
2.3.3 过表达植株鉴定 预扩增片段大小1 123 bp,过表达阳性植株与野生型结果如图5‑B 所示,野生型马铃薯植株未能扩增出条带,表明成功获得8 株含有目的基因StDof5 过表达马铃薯植株。
2.4 马铃薯StDof5的表达量分析
运用100 mmol/L 进行盐胁迫,然后进行实时荧光定量PCR 分析。结果表明,模拟盐胁迫12 h 后,该基因在马铃薯根、茎、叶等部位均有表达,但在根中的表达量最高且根中表达量显著(图6)。

图6 不同组织中马铃薯Dof5 的表达量分析Fig.6 Analysis of Dof5 gene expression in different tissues of potato
为了研究Dof5 在马铃薯中的功能,在过表达马铃薯中选取4 个株系的根作为后续研究的材料。如图7 所示,过表达阳性植株中StDof5 的表达量都高于野生型,OP‑9、OP‑10、OP‑16、OP‑24 分别增长了39.1%、26.5%、31%、41.2%,而株系之间的表达量也不相同。

图7 StDof5 的表达量Fig.7 StDof5 gene expression
利 用RT‑qPCR 分 析 过 表 达Dof5 在 马 铃 薯 中胁迫响应相关基因转录情况,结果(图8)显示,马铃薯盐胁迫响应基因ABF4、SnRK2s、MYB2、DREB2A、ABI3 的转录水平在过表达阳性植株中显著高于野生型,ABI5 表达低于野生型。综上所述,StDof5 在马铃薯中能够调控胁迫响应相关基因的表达。

图8 过表达Dof5 阳性植株中胁迫响应基因的表达量分析Fig.8 Expression analysis of stress-responsive genes in overexpressing Dof5-positive plants
2.5 盐胁迫下StDof5的表型分析
过表达阳性植株与野生型在不同盐浓度下的MS培养基中生长,25 d 后对不同材料生长情况进行测量,150 mmol/L 盐浓度下均未生根未记录。结果显示,不同浓度下所有植株均生根,100 mmol/L 浓度下OP‑7、OP‑9 中有部分未生根现象;0、50 和100 mmol/L 盐浓度处理各无菌苗生长25 d 的数据如表2所示。

表2 盐胁迫生长指标的测定Table 2 Determination of the growth indicators of salt stress
从表2 和图9 均可以看出,25 d 盐胁迫后,0、50和100 mmol/L盐浓度处理下各个组培苗均能生长,但过表达阳性植株与野生型在不同盐浓度下对盐的耐受性和敏感性均有差别。当盐浓度达到50 和100 mmol/L 时,盐处理对过表达阳性植株与野生型的株高、鲜重、根长、根数影响显著,7 个品种间差异均达显著水平(P<0.05)。不同盐浓度下马铃薯株高、鲜重、根长、根数由高到低顺序均为:0 mmol/L>50 mmol/L>100 mmol/L,表现其株高、鲜重、根长、根数与盐浓度呈负相关;不同盐浓度对马铃薯叶片数的影响:过表达阳性植株与野生型叶片数随着盐浓度的增加变化不明显,当盐浓度为0、50 和100 mmol/L 时,过表达阳性植株较野生型叶片数变化不大且差异均不显著,由此推断叶片数与盐浓度高低影响不大。生长指标测定结果表明,过表达阳性植株与野生型株高、鲜重、根长、根数随盐浓度的增加而下降,但过表达阳性植株下降趋势较野生型缓慢,说明过表达阳性植株比野生型在盐胁迫下生长状态更好,表明过表达阳性植株能提高抵御非生物胁迫抗性。
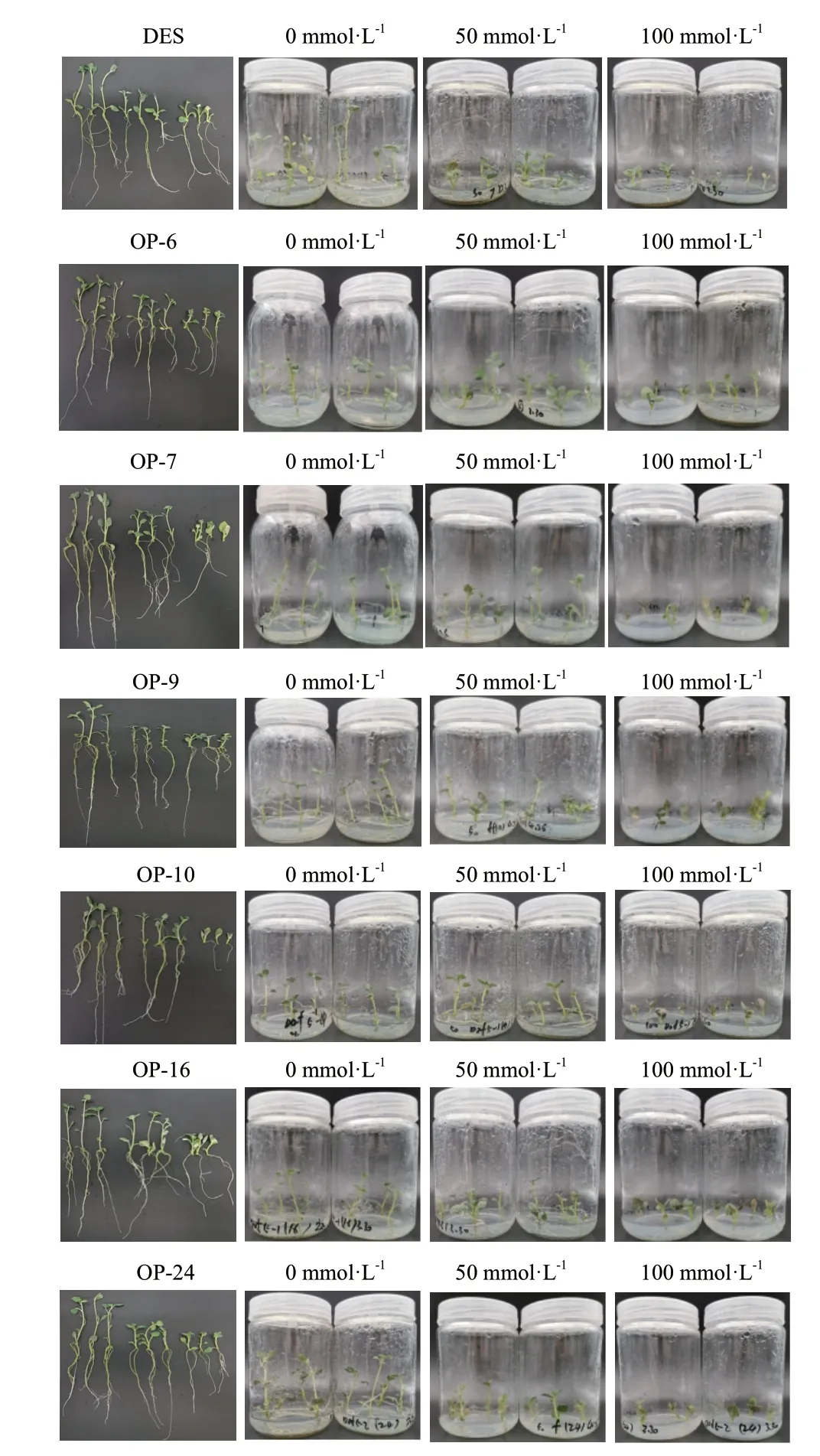
图9 盐胁迫25 d 后组培苗生长状态Fig.9 Growth status of tissue culture seedlings after 25 d of salt stress
2.6 SOD、CAT和POD活性测定结果
如图10 所示,随着盐浓度增加过表达阳性植株与野生型中SOD、CAT 和POD 的活性都不同程度增强。在50 mmol/L 胁 迫 下,OP‑9 和OP‑10 中POD、SOD、CAT 的活性与DES 相比,分别增强了40.8%和50.7%、8.9%和35.3%、48.92%和41.72%。随着盐浓度的增加,SOD、POD、CAT 活性增强幅度逐渐减小;不同盐胁迫下过表达阳性植株与野生型相比,过表达阳性植株的SOD、POD、CAT 三种酶活性均有不同程度升高,说明过表达阳性植株在盐胁迫下通过不断增强酶活性来抵御植株损伤程度。

图10 SOD、POD 和CAT 的酶活性Fig.10 Enzymatic activities of SOD, POD, and CAT
3 讨论
Dof 转录因子在植物调节生长发育与响应非生物胁迫中起重要作用[36-37],许多转录因子(DREB、ABF、bZIP、MYB、NAC 和WRKY 等)均已经被证明参与调控盐胁迫逆境响应[38]。拟南芥CDF3 通过结合转录因子CBF/DREB2A,能够诱导下游基因CRT/DRE 表达,从而参与调控植物干旱与低温胁迫信号传导途径。过表达GhDof1 能够上调胁迫相关基因GhSOD 和GhMYB 的表达量,从而提高棉花的耐低温及耐盐胁迫的能力[39]。番茄SlDof22 可以与SlSOS1 的启动区序列结合,参与抗坏血酸积累和响应盐胁迫反应[40]。Dof 家族转录因子在调控植物生长发育[41]、响应逆境胁迫[42-43]、参与激素调控信号转导方面起重要作用,探究其作用机理与功能有利于研究人员了解马铃薯生长发育过程及马铃薯响应逆境胁迫的功能机制。植物Dof 的功能主要集中在种子、器官的生长发育以及代谢通路的调控[44-46],而且Dof 基因家族响应非生物胁迫时基因表达会表现出上调趋势[47]。
Dof 转录因子在马铃薯中响应盐胁迫有一定的功能作用,在表型和表达量两个指标上过表达阳性植株较野生型均表现上升趋势,过表达阳性植株较野生型有较好的生长状态,表明Dof 基因在马铃薯底西芮中过表达后能够起到耐盐功能。本研究表明,在0、50 和100 mmol/L 盐浓度处理下,过表达阳性植株与野生型在不同盐浓度下对盐的耐受性和敏感性均有差别。随着盐浓度的增加,过表达阳性植株与野生型生长明显受到抑制,其株高、鲜重、根长、根数随盐浓度的增加而下降,而叶片数变化受盐浓度高低影响不大,但过表达阳性植株下降趋势较野生型缓慢,说明过表达阳性植株比野生型在盐胁迫下生长状态更好,提高抵御盐胁迫的能力。不同浓度盐胁迫下过表达阳性植株与野生型相比,过表达阳性植株的SOD、POD、CAT 三种酶活性均有不同程度的升高,说明过表达阳性植株在盐胁迫下通过不断增强酶活性来抵御植株损伤程度。本研究证明StDof5 在马铃薯耐盐性方面发挥重要作用,这为深入研究StDof5 功能作用奠定基础,也为后续筛选马铃薯耐盐新品种提供指导和依据。
Dof 基因在马铃薯底西芮中经过表达转化后进行盐胁迫处理,表明该基因能够抵御盐胁迫保持植株正常生长,为马铃薯在盐碱地能够更好地生长提供一些依据。研究表明玉米Dof 的转录水平在干旱和盐胁迫下上调表达,转基因玉米Dof3 参与应答盐胁迫信号途径,表现出极强抵御干旱和盐胁迫的能力。胡萝卜品种‘黑田五寸’‘君川红’在响应干旱和盐胁迫时,不同胡萝卜材料中DcDofD1 基因表达量不同,表明DcDofD1 基因对不同非生物逆境的应答是有差异的[48]。在盐胁迫下,与野生型烟草相比,转基因Dof2.2 烟草株系萎蔫程度高于WT 烟草植株,盐胁迫处理后转基因烟草叶片的叶绿素含量、可溶性糖含量及脯氨酸含量均显著低于WT 烟草,而丙二醛含量则高于WT 烟草。目前StDof2 转录因子在彩色马铃薯中通过体外酵母单杂实验,验证转录因子具备转录激活活性,且活性位点位于蛋白的 C 端。本实验在马铃薯中克隆StDof5 基因,并检测过表达植株的生长状况及表达量,qPCR 结果表明过表达阳性植株中StDof5 的表达量都高于野生型,且该基因在马铃薯根中的表达量最高,与前人的研究结果一致。对StDof5 过表达马铃薯盐胁迫下的功能进行分析与验证,为挖掘StDof5 基因功能和研究植物抗逆分子机制提供参考。关于马铃薯敲除载体的构建以及遗传转化还在进一步的研究之中。
4 结论
盐胁迫下,过表达阳性植株生长状态优于野生型,且过表达StDof5 在马铃薯中能够调控相关盐胁迫响应基因的表达,从而提高马铃薯抵御盐胁迫逆境能力。

