超声辅助提取花椒精油及抗氧化活性分析
张莹丽 柳亚文 杨红应 严露露 冯世杰 陈丽文

摘要:文章采用超声辅助水蒸气蒸馏法提取花椒精油,通过单因素试验和正交试验确定提取花椒精油的最佳工艺条件为原料粒度50目、料液比1∶15、超声温度50 ℃、超声时间60 min,在此条件下精油得率达2.61%。用气相色谱-质谱联用仪分析最佳工艺条件下提取的精油的化学成分,结果显示花椒精油主要含柠檬烯(18.267%)、4-萜烯醇(10.625%)、月桂烯(10.009%)、α-松油醇(8.199%)、乙酸松油酯(6.499%)、3-莰烯(6.512%)等。抗氧化活性研究结果表明,花椒精油对DPPH自由基和超氧阴离子自由基有很好的清除效果,在试验浓度范围内最高清除率分别可达到72.5%和80.6%。
关键词:超声辅助提取;花椒精油;提取工艺;抗氧化活性
中图分类号:TS264.3 文献标志码:A 文章编号:1000-9973(2024)02-0186-06
Ultrasonic-Assisted Extraction of Essential Oil from Zanthoxylum bungeanum Maxim. and Analysis of Its Antioxidant Activity
Abstract: In this paper, the essential oil is extracted from Zanthoxylum bungeanum Maxim. by ultrasonic-assisted steam distillation method. Through single factor test and orthogonal test, the optimum process conditions for the extraction of essential oil from Zanthoxylum bungeanum Maxim. are determined as follows: the particle size of the raw material is 50 mesh, the ratio of solid to liquid is 1∶15, the ultrasonic temperature is 50 ℃ and the ultrasonic time is 60 min. The yield of essential oil reaches 2.61% under such conditions. The chemical components of the essential oil extracted under the optimum process conditions are analyzed by gas chromatograph-mass spectrometer. The results show that the essential oil from Zanthoxylum bungeanum Maxim. mainly contains limonene (18.267%), 4-terpenol (10.625%), myrcene (10.009%), α-terpineol (8.199%), terpinyl acetate (6.499%) and 3-camphene (6.512%). The research results of antioxidant activity show that Zanthoxylum bungeanum Maxim. essential oil has good scavenging effects on DPPH free radicals and superoxide anion free radicals, and the highest scavenging rates could reach 72.5% and 80.6% respectively in the test concentration range.
Key words: ultrasonic-assisted extraction; Zanthoxylum bungeanum Maxim. essential oil; extraction process; antioxidant activity
花椒(Zanthoxylum bungeanum Maxim.)為芸香科花椒属落叶小乔木[1-2],花椒果皮中富含挥发油[3],可通过水蒸气蒸馏法、超临界CO2萃取法、微波辅助法、超声波辅助法等方法提取花椒精油[4-6],其主要活性成分有柠檬烯、月桂烯、罗勒烯、4-萜烯醇、α-松油醇、芳樟醇等[7-9],具有杀菌、抗炎、抗病毒、抗氧化、抗肿瘤、杀虫等作用[10-11],花椒精油的活性成分可通过气相色谱-质谱联用仪(GC-MS)来进行分离分析和定性定量检测[12]。本试验以花椒为原料,采用超声波辅助水蒸气蒸馏法提取花椒精油,通过GC-MS对花椒精油的组成成分进行分析,并对其抗氧化活性进行研究,以期为花椒精油的提取、成分分析、抗氧化活性研究和进一步开发利用提供依据。
1 材料和方法
1.1 材料
红花椒:产地四川汉源,厂家为玉林市升鼎聚原生中草药有限公司。
1.2 试剂
抗坏血酸(VC)、无水乙醇(均为分析纯):郑州派尼化学试剂厂;DPPH、Tris-HCl、邻苯三酚(均为分析纯):上海源叶生物科技有限公司;甲醇(色谱级):天津市科密欧化学试剂有限公司。
1.3 主要仪器与设备
KQ-200VDE双频数控超声波清洗器 昆山市超声仪器有限公司;HH-6恒温水浴锅 金坛市金城国胜实验仪器厂;800Y高速多功能粉碎机 永康市铂欧五金制品有限公司;6890N-5973气相色谱-质谱联用仪 美国安捷伦科技公司;V-1800紫外可见分光光度计 上海美谱达仪器有限公司;KDM调温电热套 山东鄄城华鲁电热仪器有限公司。
1.4 方法
1.4.1 花椒预处理
取一定量干花椒,放入多功能粉碎机中粉碎后过筛,置于阴凉干燥处密封保存备用[13]。
1.4.2 精油提取率的计算
准确称取20 g花椒粉末,提取条件初步选择原料粒度40目、料液比1∶10、超声时间90 min、超声温度60 ℃,计算提取率[14],之后密封避光4 ℃保存。
花椒精油提取率的计算公式:
精油提取率(%)=花椒精油的质量/花椒样品的质量×100%。
1.4.3 单因素试验
本试验选取原料粒度、料液比、超声温度和超声时间为单因素,研究原料粒度(20,30,40,50,60目)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25)、超声温度(20,30,40,50,60 ℃)、超声时间(30,60,90,120,150 min)对花椒精油提取得率的影响,以精油得率为依据,得出4个单因素的较优提取水平。
1.4.4 正交试验
在单因素试验结果的基础上,对原料粒度、料液比、超声温度和超声时间4个单因素选取3个适宜水平,进行四因素三水平的正交试验。对精油提取得率进行对比,从而获得最佳提取工艺。
1.4.5 花椒精油GC-MS组分分析
1.4.5.1 样品制备方法
样品用甲醇稀释50倍。
1.4.5.2 GC-MS组分分析
采用GC-MS分析法,结合相关文献鉴定成分[15-16],GC-MS分析条件如下:
色谱条件:色谱柱为HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),柱温60 ℃,柱流量0.9 mL/min,进样口温度250 ℃,柱前压6.97 psi,进样量1.0 μL,载气He,分流比50∶1,流速0.9 mL/min,程序升温:柱温60 ℃(初始柱温保持3 min),以5 ℃/min升至250 ℃,保持12 min。
质谱条件:离子源为EI源(70 eV),双灯丝,电子能量70 eV,离子源温度230 ℃,传输线温度280 ℃,扫描范围(m/z):40~500 u,谱图检索:NIST 14谱库。
1.4.6 抗氧化试验
1.4.6.1 DPPH自由基清除试验
精确稱取6 mg DPPH,用无水乙醇定容至250 mL,得到60 μmol/L的DPPH-乙醇溶液;于4 ℃避光保存,现配现用,4 h之内有效。将花椒精油用无水乙醇稀释,分别得到质量浓度为2,4,6,8,10 mg/mL的待测液[17]。
取1 mL待测液、1 mL无水乙醇,分别将其与1 mL DPPH-乙醇溶液混合,反应30 min后在517 nm处测吸光度,分别记为A1和A2;取1 mL待测液与1 mL无水乙醇混匀,反应30 min后在517 nm处测定吸光度A0,用无水乙醇调零,以VC为阳性对照,试验重复3次。
DPPH 自由基清除率(%)=[1-(A1-A0)/A2]×100%。
1.4.6.2 超氧阴离子自由基清除试验
取0.05 mol/L Tris-HCl缓冲液4.5 mL,于25 ℃水浴20 min,分别加入1.00 mL不同浓度的样品溶液和25 mmol/L邻苯三酚溶液0.40 mL,混匀后于25 ℃水浴反应5 min,加入1.00 mL 8 mol/L的HCl溶液终止反应,在325 nm处测吸光度[18]。以VC为阳性对照,试验重复3次。
超氧阴离子自由基清除率(%)=[1-(A1-A2)/A0]×100%。
式中:A1表示含有样品和邻苯三酚的溶液的吸光度;A2表示含有样品、不含邻苯三酚的溶液的吸光度;A0表示不含样品、含有邻苯三酚的溶液的吸光度。
2 结果与分析
2.1 单因素试验结果
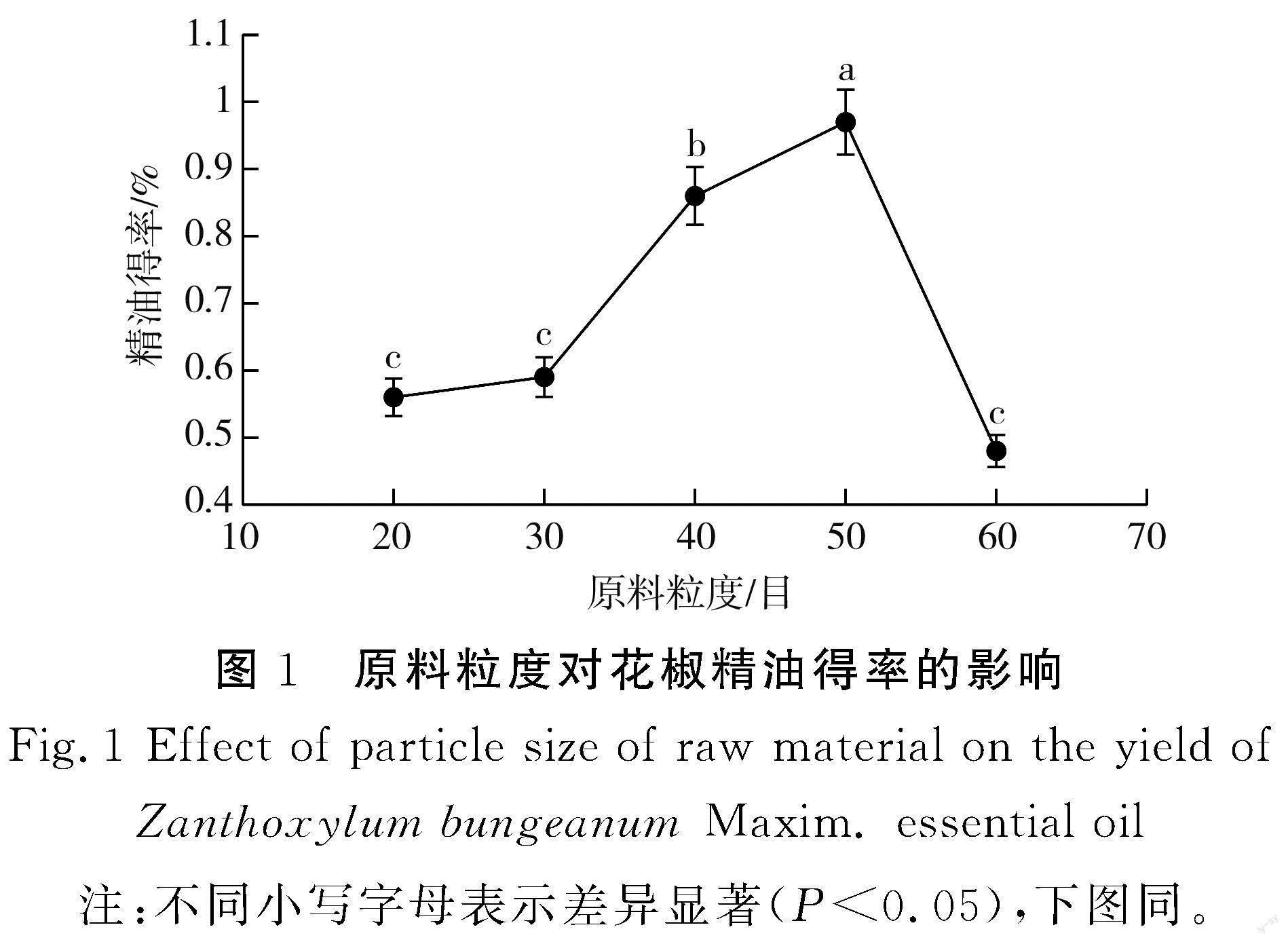
2.1.1 原料粒度对花椒精油得率的影响
由图1可知,随着原料粒度的增大,花椒精油得率随之增大,在20~50目范围内,花椒精油得率呈逐渐上升趋势。当原料粒度为50目时精油得率最高,60目时精油得率急剧下降,可能是由于花椒粉碎粒度太小,精油提取不完全。
2.1.2 料液比对花椒精油得率的影响
由图2可知,随着料液比的增大,精油得率逐渐增大,当料液比为1∶15时精油得率最高,继续增加料液比,得率逐渐下降,可能是由于料液比过大,花椒精油在水中的溶解度增大,进而导致精油产率下降。
2.1.3 超声温度对花椒精油得率的影响
由图3可知,当超声温度为20~40 ℃时,精油得率呈逐渐上升趋势,当超声温度达到40 ℃时精油得率最高,40~60 ℃时,精油得率随着温度的升高而逐渐降低,因此,40 ℃为最佳超声温度。
2.1.4 超声时间对花椒精油得率的影响
由图4可知,当超声时间为30~90 min时,花椒精油得率呈上升趋势,90 min时精油得率最高,时间小于90 min,超声时间太短,花椒中的精油不能被完全提取出来。时间大于90 min,精油得率呈递减趋势,因此90 min为最佳超声时间。
2.2 正交试验结果分析
正交试验因素水平表见表1,正交试验结果见表2。
由表2可知,影响花椒精油得率的因素主次顺序为D>A>C>B。花椒精油得率最高的试验最优组合为A2B2C3D1,即原料粒度50目,料液比1∶15,超声温度50 ℃,超声时间60 min。理论最优组合为A2B1C3D1,即原料粒度50目、料液比1∶10、超声温度50 ℃、超声时间60 min。理论最优组合和试验最优组合在料液比上存在一定差异,需进一步验证。
2.3 验证试验
根据正交试验结果,将试验最优组合和理论最优组合进行验证试验,每组试验平行测定3次,对精油得率进行比较,结果见表3。
由表3可知,A2B2C3D1(试验最优组合)条件下精油得率高于A2B1C3D1(理论最优组合),花椒精油最佳工艺为A2B2C3D1,即原料粒度50目、料液比1∶15、超声温度50 ℃、超声时间60 min。
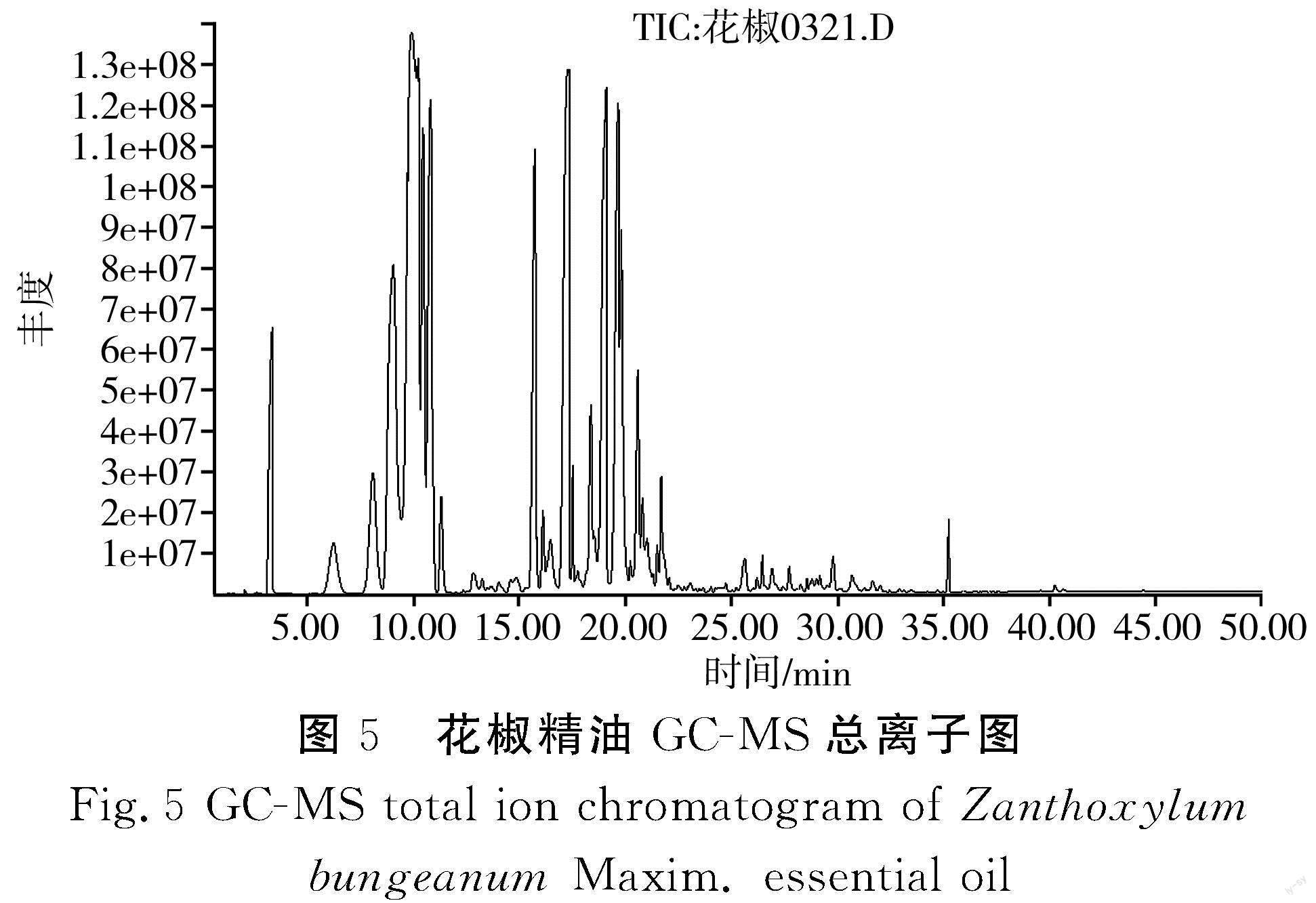
2.4 花椒精油GC-MS组分分析
由表4和图5可知,提取的花椒精油中共鉴定出86种物质,花椒精油的主要成分为柠檬烯(18.267%)、4-萜烯醇(10.625%)、月桂烯(10.009%)、α-松油醇(8.199%)、乙酸松油酯(6.499%)、3-莰烯(6.512%)等。
2.5 抗氧化试验结果分析
2.5.1 DPPH自由基清除试验
花椒精油对DPPH自由基的清除能力见图6。
由图6可知,DPPH自由基清除率随着花椒精油和VC质量浓度的增大而逐渐增大,两者的抗氧化能力有一定差异。当质量浓度为10 mg/mL时,花椒精油的DPPH自由基清除率达72.5%,表明花椒精油对DPPH自由基有一定清除能力,有较好的抗氧化活性[19]。
2.5.2 超氧阴离子自由基清除试验
花椒精油对超氧阴离子自由基的清除能力见图7。
由图7可知,随着质量浓度的增大,花椒精油和VC对超氧阴离子自由基的清除能力都随之增加,提取的花椒精油对超氧阴离子自由基有一定的清除效果,且与浓度呈正相关[20]。
3 结论
通过对花椒精油进行提取工艺优化、组分分析及抗氧化活性分析,结果表明,在原料粒度50目、料液比1∶15、超声温度50 ℃、超声时间60 min的条件下,提取的花椒精油得率最高,达2.61%;通过GC-MS分析,花椒精油中主要成分有柠檬烯(18.267%)、4-萜烯醇(10.625%)、月桂烯(10.009%)、α-松油醇(8.199%)、乙酸松油酯(6.499%)、3-莰烯(6.512%)等;通过DPPH自由基和超氧阴离子自由基清除试验发现,花椒精油与VC的自由基清除率均随着质量浓度的增加而上升,花椒精油具有较好的抗氧化活性。
参考文献:
[1]马钤,郭川川,张峰轶,等.花椒精油亚临界流体萃取工艺优化及GC-MS分析[J].中国酿造,2022,41(10):201-206.
[2]赵志峰,雷鸣,雷绍荣,等.两种四川花椒挥发油的成分分析[J].中国调味品,2004(10):39-42.
[3]MENG F B, LEI Y T, ZHANG Q, et al. Encapsulation of Zanthoxylum bungeanum essential oil to enhance flavor stability and inhibit lipid oxidation of Chinese-style sausage[J].Journal of the Science of Food and Agriculture,2022,102(10):4035-4045.
[4]王秋亞,景晓卉.花椒精油化学成分、提取方法及抑菌活性研究进展[J].中国调味品,2018,43(12):187-190,195.
[5]王德靖,唐湘湘,罗海.植物精油提取技术研究进展综述[J].中阿科技论坛(中英文),2023,47(1):108-112.
[6]杨雪.10种植物精油生物活性及其化学成分研究[D].贵阳:贵州医科大学,2022.
[7]WANG L, WANG Z M, LI X Y, et al. Analysis of volatile compounds in the pericarp of Zanthoxylum bungeanum Maxim. by ultrasonic nebulization extraction coupled with headspace single-drop microextraction and GC-MS[J].Chromatographia,2010,71:455-459.
[8]JANG K H, CHANG Y H, KIM D D, et al. New polyunsaturated fatty acid amides isolated from the seeds of Zanthoxylum piperitum[J].Archives of Pharmacal Research,2008,31(5):569-572.
[9]郑涛.花椒表型性状和有效成分的区域差异及气候驱动因子研究[D].咸阳:西北农林科技大学,2022.
[10]ZHANG H, GUO Z Q, WANG X, et al. Correction: protective mechanisms of Zanthoxylum bungeanum essential oil on DSS-induced ulcerative colitis in mice based on a colonic mucosal transcriptomic approach[J].Food & Function,2023,14(3):1795.
[11]金敬红,凌艺炜,姚正颖,等.不同干燥方式对青花椒精油品质的影响[J].中国野生植物资源,2022,41(12):46-50.
[12]白亚蒙,张峰升,李皓,等.基于GC-MS对顶空固相萃取法和微波辅助法获得的花椒挥发油香气成分分析[J].中国调味品,2023,48(3):187-190.
[13]吴娟娟,张加余,史石磊,等.不同产地红花椒椒目的全组分分析[J].天然产物研究与开发,2023,35(5):837-851.
[14]王娟,杜静怡,贾雪颖,等.花椒精油及其水提物的香气活性成分分析[J].食品工业科技,2021,42(20):229-241.
[15]NAOKO M, MICHIHO I. Genetic identification of the original plant species for Mentha herb listed in the Japanese Pharmacopoeia and analyses of their essential oil composition[J].Journal of Natural Medicines,2023,77(3):489-495.
[16]杜云霄,袁小钧,蔡雪梅,等.E-Nose结合GC-MS分析两种花椒精油成分及其抑菌活性研究[J].中国调味品,2022,47(3):164-169.
[17]王春杰,张立攀,赵梦瑶,等.超临界CO2提取牡丹花精油及其抗氧化活性研究[J].食品工业,2023,44(2):59-63.
[18]周江菊,任永权,雷启义.樗叶花椒叶精油化学成分分析及其抗氧化活性测定[J].食品科学,2014,35(6):137-141.
[19]王友峰,罗忠圣,黎浪,等.黔产青花椒精油成分分析及抑菌、抗氧化活性研究[J].中国食品添加剂,2023,34(4):285-292.
[20]丰丕雪,易弋,黄锦翔,等.半夏等15种常见中草药提取物的抗氧化能力比较研究[J].广西科技大学学报,2022,33(3):91-99.

