漆酶在食品分子修饰和食品胶体体系中的应用
葛怿泽 辛嘉英 刘思淼 锁博海 宋增武 夏春谷

摘要:近年来,改善食品分子的功能和营养特性一直是研究的热点。食品分子的酶促修饰可用于增强其在食品中的功能性质。漆酶可催化蛋白质、多糖和多酚的氧化,在食品分子以及食品胶体的构建中具有巨大的应用潜力。文章总结了漆酶的结构、来源、对食品分子修饰的催化机制及其在食品胶体体系中的应用。研究发现漆酶分两步催化食品分子的氧化:第一步涉及产生自由基或醌的酶促反应;第二步涉及自由基或醌与其他分子的非酶促反应。漆酶在整个过程中主要起着引发反应的作用。由漆酶诱导的食品分子交联有助于改善食品分子的性质和功能,从而增加食品分子的功能性质、扩展用途,以及改善食品胶体体系(如乳液、纳米颗粒和微凝胶)的形成和稳定性,从而增强它们封装、保护和递送生物活性化合物的潜力。
关键词:漆酶;催化;自由基;交联;食品胶体体系
中图分类号:TS201.25 文献标志码:A 文章编号:1000-9973(2024)02-0209-07
Application of Laccase in Food Molecular Modification and Food Colloid Systems
Abstract: In recent years, improving the functional and nutritional characteristics of food moleculars has been a research hotspot. Enzymatic modification of food moleculars can be used to enhance their functional properties in food. Laccase can catalyze the oxidation of proteins, polysaccharides and polyphenols, and has great potential for application in the construction of food moleculars and food colloids. In this paper, the structure, source, catalytic mechanism of laccase on food molecular modification and its application in food colloid systems are summarized. It is found that laccase catalyzes the oxidation of food moleculars in two steps: the first step involves enzymatic reactions that produce free radicals or quinones; the second step involves non-enzymatic reactions of free radicals or quinones with other moleculars. In the whole process, laccase mainly plays a role in initiating the reaction. Cross-linking of food moleculars induced by laccase helps to improve the properties and functions of food moleculars, thus increasing the functional properties of food moleculars and expanding their applications, as well as improving the formation and stability of food colloid systems (such as emulsion, nanoparticles and microgels), so as to enhance their potential to encapsulate, protect and deliver bioactive compounds.
Key words: laccase; catalysis; free radicals; cross-linking; food colloid system
漆酶(laccase,EC1.103.2)是一種含铜离子的氧化酶,属于多铜氧化酶家族[1]。漆酶广泛存在于细菌、真菌、植物和昆虫中,其中在真菌漆酶方面的研究最多[2]。漆酶通常被认为是绿色催化剂,因为它们能够在分子氧的存在下将化合物氧化为自由基,副产物只有水[1]。
许多食品中的蛋白质和多糖具有良好的增稠、胶凝、乳化特性等[3-4],因此,它们可用于改善食品的外观、质地、稳定性等。然而,天然食品分子的性质和范围有限,不能满足商业化的要求,因此,有必要采用绿色、安全和有效的方法对食品分子进行修饰,以扩展其功能特性。目前的修饰方法包括物理、化学、酶和基因工程方法[5-8]。物理方法不易控制。有些化学交联剂在食品中已经得到广泛应用,但人们仍担心其潜在的毒性[9]。食品中是否可以使用转基因成分存在争议。而酶因其高效的特异性、催化效率以及作用条件温和的优点而受到青睐。目前的商品酶具有出色的功能特性,包括对pH、盐和温度变化的高抵抗力、快速反应速率和高底物利用率[10-11]。
漆酶广泛用于构建食品胶体体系,如形成和稳定乳液、纳米颗粒和凝胶[12]。食品中最常用的乳液是水包油(O/W)、油包水(W/O)和双重乳液(W/O/W)[13]。纳米颗粒因其较大的比表面积和较小的尺寸,在食品中表现出独特的功能属性,可改善营养素的分散性、稳定性[9]。食品凝胶由相互作用的生物聚合物分子或分散在水中的胶体颗粒网络构成,可用于封装和释放生物活性物质。本文总结了漆酶对食品分子性能的影响,并且强调了漆酶在改善或扩展食品胶体特性方面的应用。
1 漆酶的结构
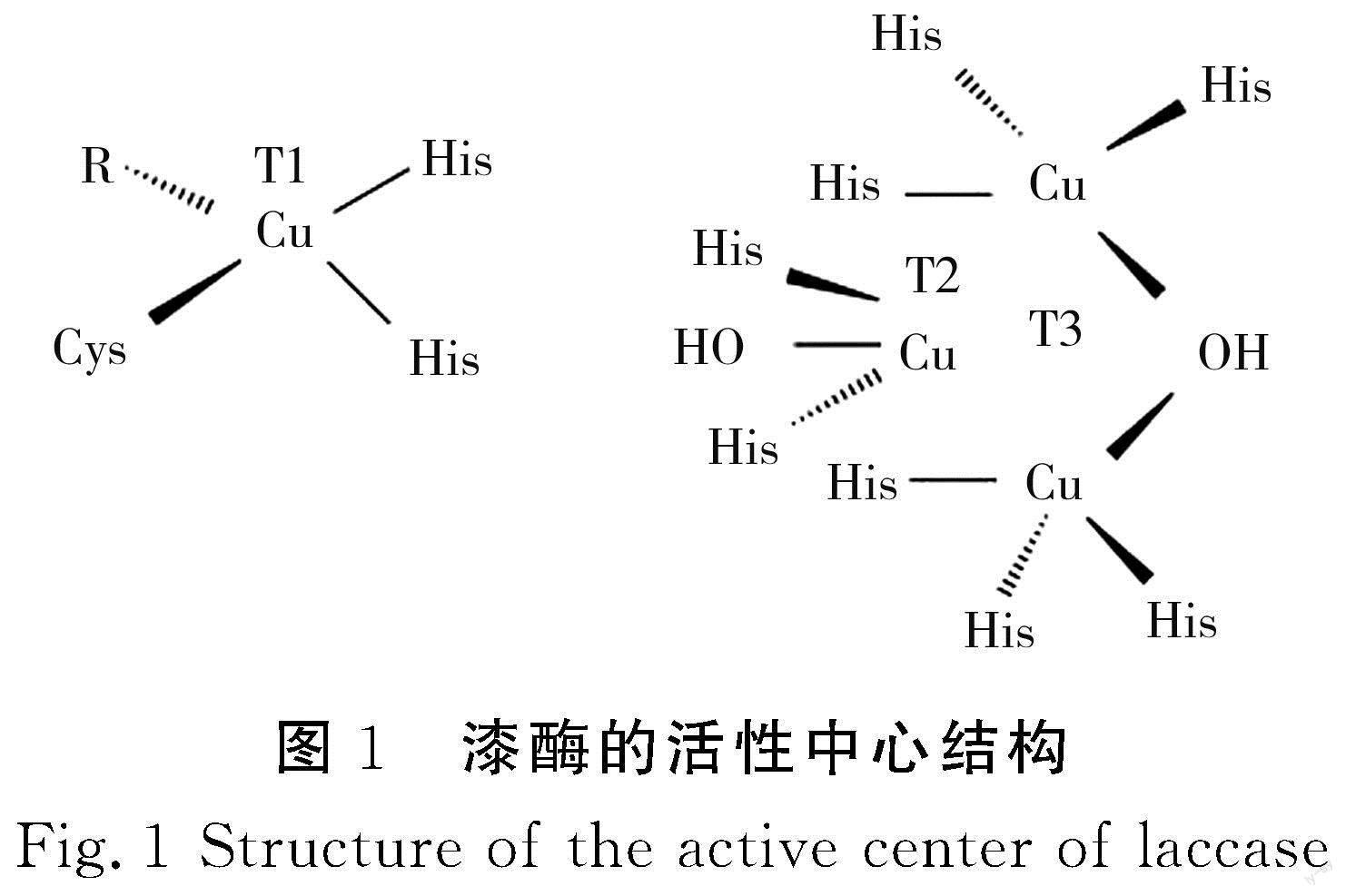
漆酶是含铜离子的糖蛋白,其肽链包含500~600个氨基酸,糖配基占整个分子的10%~45%。一般来说,铜原子是漆酶结构的共同特征,与漆酶的氧化还原功能紧密相关[14]。铜离子是漆酶结构中最重要的组成部分,它们参与构建漆酶活性中心,决定漆酶的特异性和活力,使漆酶具有氧化还原功能;与此同时,铜离子也直接参与键断裂和形成过程,是漆酶结合底物的区域[15]。漆酶通常包含4个铜原子和3个铜原子的结合点,根据磁性和光谱特性的差异,可以分为T1铜原子、T2铜原子、T3铜原子三类[16]。T1铜原子相对独立,与1个半胱氨酸(Cys)的S和2个组氨酸(His)的N配位,形成扭曲的四面体结构。其中还原态底物的结合位点是共价键Cu-S(Cys)的配位,漆酶在该结合位点附近接受来自底物的电子转移,从而将底物彻底氧化,使得T1铜原子在614 nm处产生强烈的蓝色特征吸收带[17],由此漆酶也被称为铜蓝蛋白。T2铜原子具有电子顺磁共振效应(electron paramagnetic resonance,EPR)的性质,无特殊吸收峰,T3铜原子与其紧密相连形成一个三核中心,同时这个三核中心也是漆酶的催化活性中心。此三核中心与8个His配位结合,其中T3铜原子结合6个His,T2铜原子结合2个His。T3铜原子由2个铜原子组成,由于其发生氧化偶联作用,T3铜原子的EPR性质消失,但在330 nm处有宽的吸收峰[18]。同时,一些反应中间体如过氧中间体的吸收,也会致使T3铜原子在400~460 nm或420~460 nm之间出现一些小的吸收带[19]。漆酶的活性中心结构见图1[20]。
2 漆酶的催化机制
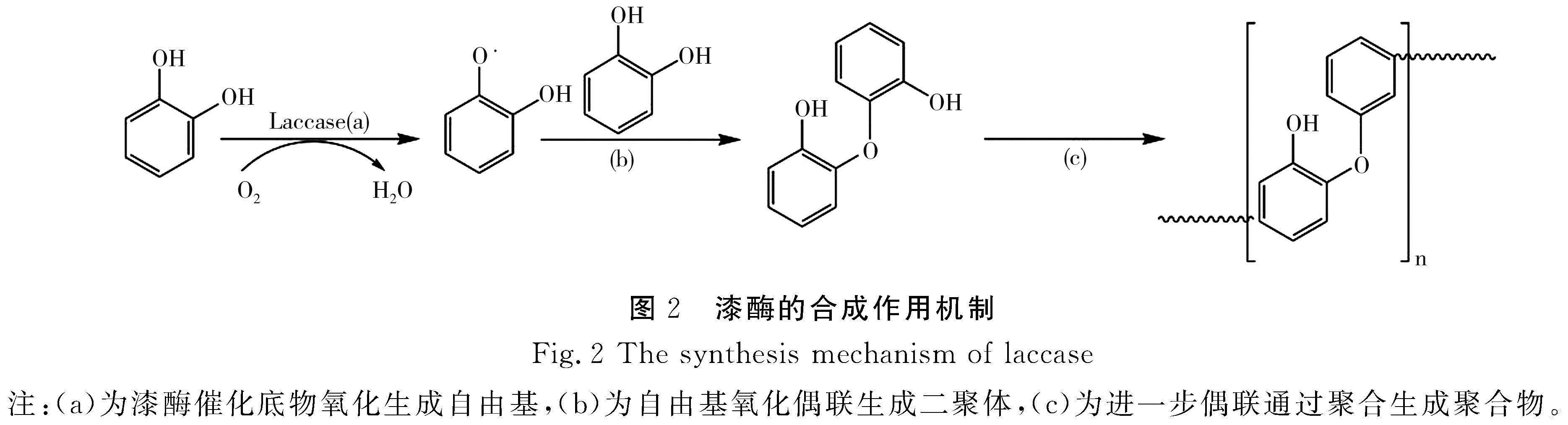
漆酶介导的反应包括4个单电子底物氧化、电子向分子氧的转移以及产生2个水分子的副产物三部分。反应过程中形成的自由基将进行进一步的反应,例如胺化、氧化、环化、二聚或聚合,直到形成最终且更稳定的产物[21-23]。漆酶能够催化氧化酚类和非酚类底物的单电子氧化,生成自由基中间体,之后这些中间体会参与到氧化偶联或底物键断裂的过程,最终导致底物发生氧化、降解或聚合反应等。酶促反应过程主要包括漆酶分子对底物的氧化作用、电子在漆酶分子中的传递、氧分子对漆酶分子的还原以及产物的反作用[24],在此过程中T1活性位点的铜离子从还原态的底物中吸收电子,这时底物被氧化形成自由基中間体,从而导致不同非铜簇的次级反应,如羟化、歧化和聚合反应等。在漆酶分子的整个催化循环反应过程中,主要表现为4个底物分子被氧化形成自由基中间体,单个分子的氧被还原成2个分子的水 [25]。开始时反应底物与处于酶活性中心的T1铜原子位点相结合,T1铜原子接受来自还原态底物的电子转移,同时该底物被氧化形成自由基;然后,T1铜原子将单个电子通过Cys-His途径传递到由T2和T3铜原子组成的三核中心上,分子氧在三核中心处接受电子,被还原成水[19]。漆酶的催化机制通常涉及从底物中提取单个电子以产生活性自由基。这些自由基是重要的中间产物,通过偶联反应产生二聚物、低聚物、聚合物等(见图2)[1]。
3 影响漆酶催化氧化的因素
温度、pH和金属离子等都会对漆酶的催化活性产生影响。漆酶的最适反应温度在25~85 ℃之间,其中大部分在50~60 ℃仍能保持稳定,不同来源的漆酶及其不同的反应底物也会造成最适温度的差异。漆酶的最适pH范围为4~6,一般来说,酸性pH时漆酶的催化活性更高[25]。金属离子如 K+ 、Ag+ 、Cu2+、 Mg2+、Ca2+、Zn2+等对漆酶活性也会产生重要影响。漆酶活性增加可能是由于这些金属离子与电子传递系统中的Cu2+产生竞争,导致酶和底物之间的正合作关系。当然,一定浓度的Cu2+可以促进漆酶活性的增加[26]。Zhuo等[27]探究几种金属离子对漆酶活性的影响,结果发现在实验10 d后Cu2+、Fe2+、Mn2+、Cd2+ 均会使胞外漆酶活性有所增加,其中Cu2+效果最显著。然而有些金属离子却会抑制酶促反应,比如铜离子螯合剂。也有一些金属离子会对漆酶活性产生抑制作用。研究发现,Co2+、Ni2+、Cd2+、Fe3+等对漆酶活性的抑制作用很强,其原因可能是在反应过程中,这些金属离子占据漆酶的活性中心,使漆酶的结构发生变化,造成底物与漆酶正常结合受阻,从而抑制了漆酶活性[28]。
4 漆酶催化修饰对食品分子性能的影响
漆酶对蛋白质、多糖、多酚类等食品分子结构和性质会产生影响或者使其一些方面的性能得到改善,见表1。
4.1 蛋白质
漆酶可以改善蛋白质的性质和功能。Li等[29]研究发现马铃薯蛋白的交联可单独通过漆酶或漆酶-阿魏酸体系实现。马铃薯蛋白在交联后表现出相似或略微增强的溶解度。交联后观察到马铃薯蛋白的乳化特性得到改善。经过毛云芝菌漆酶6 h处理的交联马铃薯蛋白也表现出良好的发泡性,这些蛋白质表现出增强分子灵活性和轻度交联程度的特征。通过测定漆酶催化醇溶蛋白氧化过程中的耗氧量、醇溶蛋白分子量、力学性能、水稳定性、热性能和醇溶蛋白纤维的形态,以证明漆酶作为醇溶蛋白交联剂的作用。经漆酶处理的小麦醇溶蛋白纤维的机械性能和水稳定性显著提高。用漆酶处理的小麦醇溶蛋白的纤维具有更光滑和更均匀的表面,可以通过扫描电镜观察到漆酶介导的改性小麦醇溶蛋白纤维[30]。此外,漆酶对蛋白质与淀粉的共同体系也会产生影响。Fan等[31]研究漆酶(LAC)对蛋白质交联和黑青稞面条(BHBN)体外淀粉消化的影响,结果表明,当LAC的添加量从0%增加到0.4%时,体外淀粉消化曲线显示,初始60 min内淀粉体外消化速率(k1)从0.016 1 min-1显著下降到0.008 3 min-1(P<0.05),300 min时最大水解度(C∞)从58.55%显著下降至48.48%(P<0.05)。扫描电子显微镜(SEM)显示,LAC诱导形成了越来越连续和紧凑的蛋白质网络,从而更紧密地包裹淀粉颗粒。同时,在还原和非还原条件下观察到十二烷基硫酸钠可提取蛋白(SDSEP)含量呈显著下降趋势(P<0.05),表明LAC的添加促进了BHBN中蛋白质的交联程度。当LAC添加量增加(0%~0.4%黑青稞粉)时,二酪氨酸的含量增加了12%,同时游离巯基和酚类物质减少(分别为17%和42%)。这些发现表明,LAC诱导的酚氧化可以通过将酚转化为自由基来促进蛋白质交联,从而在BHBN中引发二硫键和非二硫键(二酪氨酸)的形成。最后,LAC导致致密的蛋白质网络结构,保护淀粉在淀粉水解的第一阶段免受消化酶的攻击,并降低BHBN中淀粉的消化率。
4.2 多糖
漆酶可以改善多糖的性质和功能。使用漆酶作为催化剂,在均相反应条件下用4-己氧基苯酚(HP)功能化壳聚糖。X射线衍射(XRD)显示与纯壳聚糖相比,漆酶/HP 处理的壳聚糖的结晶度有所降低。随着初始HP和壳聚糖比值的增加,漆酶/HP处理的壳聚糖中接枝HP含量先上升后下降。漆酶/HP处理提高了壳聚糖中共聚物的热稳定性[32]。此外,研究漆酶对无麸质面团流变学特性的影响发现,随着漆酶活性的增加(0~3 U/g 面粉),面团的硫醇和总酚含量分别降低了28%和93%。T. versicolor漆酶能够交联酚类和硫醇,产生范围广泛的同型和异型偶联物。由于漆酶催化了蛋白质和多糖与酚类物质的酯化交联,经漆酶处理的面团的G′和G″均显著增加。Tan δ随着漆酶活性的增加而降低,表明面团的弹性增加。面团黏弹性的改善可使面团在醒发过程中保留足够的二氧化碳,并生产出更易接受的无麸质面包[33]。以耐热漆酶作为生物催化剂,将阿魏酸的氧化产物与柑橘果胶结合,从而获得功能性增强的新型果胶。结果证明阿魏酸的氧化产物和果胶的羧基之间形成了共价键,并且改性果胶的总酚含量显著高于天然果胶。这种酶促过程将为果胶基聚合物提供新的思路[34]。
4.3 多酚
漆酶也可以改善多酚的性质和功能。Nemadziva等[35]使用小漆酶SLAC(天蓝色链霉菌 A3(2)原生的双结构域细菌漆酶)合成了β-β咖啡酸二聚体木层孔菌素A(Phellinsin A)。与咖啡酸相比,该二聚体的DPPH自由基清除能力提高了1.5 倍,而Trolox等效抗氧化能力(TEAC) 提高了 1.8 倍。 Phellinsin A还表现出在水性介质中改善的溶解度和在酸性pH值(pH值2.2和pH值5.5)下的显著稳定性。此外,Wang等[36]选择没食子酸(GA)作为多酚模型,利用漆酶促进没食子酸(GA)和大豆分离蛋白(SPI)的交联,在中性pH条件下使用漆酶制备SPI-GA复合物。SPI-GA复合物改变了二级结构,β折叠减少,α螺旋和β转角增加。漆酶催化的SPI-GA 复合物的 DPPH自由基清除能力、ABTS自由基清除能力和还原能力显著提高。据报道,将没食子单宁(GT)作为介质的漆酶介质系统(LMS)引入酸溶胀胶原(ASC)薄膜中可以增强其强度。假设LMS 中的漆酶(LAC)将GT氧化为活性醌,与LAC的直接催化相比,后者更容易攻击ASC,从而促進ASC的有效交联和相关性能。结果发现,一方面,交联对LAC和GT-LAC(即GT作为LMS中的介质)的ASC薄膜特性产生影响。当LAC剂量<12 U/g时,它对基于ASC薄膜的性能有积极的影响,例如机械性能、阻隔性能、耐水性和热稳定性。另一方面,GT-LAC薄膜比LAC薄膜表现出更紧密的结构,更高的热稳定性、机械性能和耐水性,证实了原先的假设,即在酸性条件下,相对高分子量的GT作为介质有可能提高LMS中LAC对胶原蛋白的交联效率。GT介导的LAC交联可以改善胶原材料的性能,使其成为增强可食用胶原包装的潜在、有效且重要的方法[37]。
5 漆酶催化生物分子修饰在食品胶体体系中的应用
漆酶催化生物分子修饰在食品胶体体系中的应用十分广泛,发挥着巨大潜能作用,见表2。
5.1 乳化剂
Sato等[38]探究了漆酶和阿魏酸处理对酪蛋白酸钠在不同 pH 值(3,5,7)下稳定的水包油乳液特性的影响。结果发现漆酶处理和pH对性能产生强烈影响,从而影响酪蛋白酸钠乳液的稳定性、结构和流变学。由于结构化程度更高,漆酶处理导致乳液显示出剪切稀化行为。在接近蛋白质pI处,O/W乳液在pH为3和5时显示出相分离,但漆酶处理提高了乳液的稳定性,尤其是在pH为3时,添加阿魏酸和漆酶产生具有更大液滴的乳液尺寸,但具有更窄的液滴尺寸分布,增加了黏度、假塑性和黏弹性(凝胶状行为)。结果表明,漆酶和阿魏酸对蛋白质的交联通过改变蛋白质在乳液结构和流变学上的功能机制来改善蛋白质的乳化性能,酪蛋白酸钠在用漆酶处理后可以成功地用于酸性产品。此外,用漆酶交联的US-α-LA(经超声预处理的α-乳清蛋白)和US-α-LA 制备的各种乳液凝胶中,超声预处理和漆酶交联相结合提高了凝胶强度、持水力,并改变了α-LA 乳液凝胶的流变学性质。交联US-α-LA 和US-α-LA的漆酶比对照具有更均匀和更致密的微观结构。此外,具有漆酶交联US-α-LA的乳液产生了一种自支撑弹性凝胶,稳定性较好,超过1个月没有出现任何分离。由此可得出漆酶交联US-α-LA后形成了更稳定的乳液凝胶[39]。研究发现云芝漆酶对含有亲脂模型着色剂(尼罗红)的结构化水包油乳液颜色稳定性产生影响。结果表明漆酶可用于乳液中以提高在环境压力(例如温度、离子强度或 pH 值变化)下的物理稳定性。然而,由于其会促进褪色,它的使用还是会受到限制[40]。
5.2 纳米粒子
漆酶诱导的交联反应也被用于促进食品分子形成纳米颗粒。研究发现漆酶可用于交联乳清蛋白和甜菜果胶中,在有机相中微乳化为液滴。液滴通过漆酶诱导的交联和生物聚合物的原位凝胶化转化为纳米粒子。咖啡因在生物聚合物的共轭散装凝胶中的截留推迟了动态流变法指示的胶凝时间并降低了最终凝胶的强度。红外光谱表明蛋白质和果胶在阿魏酸基团的参与下发生交联。在合成过程中,咖啡因被封装为颗粒内的模型生物活性化合物。所产生的共轭颗粒为球形并且具有纳米级尺寸[41]。此外,漆酶已用于木质素纳米颗粒的制备,具有更好的稳定性[42]。
5.3 凝胶
漆酶能促进蛋白凝胶特性的改变。Ruzengwe等[43]研究漆酶交联对热诱导原位形成的班巴拉花生蛋白凝胶(BPI)的流变学和微观结构特性的影响。对BPI进行漆酶修饰可改善凝胶特性,其改善率与酶的剂量有关。在凝胶形成和稳定之前,通过流变学分析漆酶的添加(1~3 U/g)诱导蛋白质初步的结构分解(G″>G′)。随着漆酶活性的增加(分别为0~3 U/g蛋白质),凝胶点温度从85 ℃显著降低到29 ℃,这表明形成了结构相对良好的凝胶。还有在高酶活性(>2 U/g 蛋白质)下缓慢发生蛋白质结构的初始分解,同时,观察到凝胶点温度显著降低。并且在此活性下形成的凝胶外观均匀,具有紧凑的板条状结构。漆酶催化BPI的交联与模型反应中硫醇和酚类含量减少、表面疏水性增加和氨基酸(谷胱甘肽、半胱氨酸和赖氨酸)交联现象一致。疏水相互作用是BPI凝胶形成中的主要非共价相互作用。因此,证实用漆酶修饰BPI的确促进了具有均匀和致密网络的凝胶的形成。据报道,来自Trametes versicolor的漆酶被用于制备大米谷蛋白/甜菜果胶复合凝胶。200 mmol/L钙离子可改善复合凝胶的流变学、结构特性以及保水能力[44]。
在漆酶交聯阿拉伯木聚糖形成功能水凝胶的研究中,发现使用漆酶制备4%的阿拉伯木聚糖(AX)凝胶,会对阿魏酸二聚体异构体的比例以及所形成凝胶(LAX)的流变学、结构和光谱特性产生重要影响。LAX表现出较高的硬度值和更紧凑的结构网眼尺寸。显微镜显示LAX凝胶存在连接链,在2 895 cm-1处的拉曼谱带强度较低,表明与AX相比其氢键增强。此研究可以应用于食品和生物技术的 AX凝胶化[45]。此外,漆酶催化阿魏酰基共价交联,在从玉米麸皮中提取的阿魏酰化葡糖醛酸阿拉伯木聚糖中形成二氢阿魏酸,从而形成坚固的水凝胶[46]。
漆酶交联也被用来诱导双网络凝胶。Liu等[47]利用漆酶和葡萄糖酸-δ-内酯(GDL)成功制备了双诱导酪蛋白和阿拉伯木聚糖复合凝胶(酪蛋白/AX凝胶)。与单一酪蛋白凝胶相比,酪蛋白/AX凝胶的流变学和结构特性得到改善,这可能归因于AX和酪蛋白分子共价和非共价相互作用的共存可以赋予凝胶三维网络结构和更理想的物理化学性质,包括更强的凝胶强度、更高的热稳定性、持水性和EGCG-加载效率。
6 展望
酶技术在改变天然食品成分,如蛋白质、多糖和酚类物质的特性方面具有巨大的潜力,能够增强其功能特性。漆酶作为绿色催化剂,其催化的反应具有温和的催化条件、高效的转化能力、广泛的底物范围以及能催化某些特殊反应等特点,是优质的酶类选择,预期在未来会有广泛的应用。本文重点介绍了漆酶的结构、作用机制以及在食品分子结构和功能方面的应用,也重点介绍了漆酶对于食品胶体系统(例如乳液、纳米颗粒和凝胶)功能特性的改善。目前,漆酶这种氧化还原酶在食品中应用的研究还比较有限。一系列食品分子酶促交联的反应条件有待通过实验进一步探索,如体外消化、细胞培养和动物饲养实验等,这对于评估潜在功效和安全性至关重要。目前,关于漆酶在食品工业中的应用,部分学者正在进行大量研究活动,相信在不久的将来,会开发出更多具有实用价值的应用。目前来看,漆酶促进合成具有良好功能特性的新化合物以及蛋白质和多糖等聚合物的交联从而得到目标产物,或许在将来有更好的应用前景[48]。但是目前也存在许多的问题阻碍着漆酶的工业化应用,酶的成本、回收利用等因素会限制酶促交联技术的发展。缺少充足的漆酶供应来源、一些酶促反应的介质并不适合工业化应用等[49] ,同样会对酶促交联发展造成不利影响。因此,今后的研究应不断寻找新的漆酶底物、降低漆酶的应用成本以及开创更加高效且经济的介质系统。最后,扩大漆酶的生产规模,尤其是扩大其应用衍生产品的规模,对于降低成本和扩大市场至关重要[50]。
参考文献:
[1]TUKAYI K, BLESSING N, MARILIZE L R H. Laccase catalysis for the synthesis of bioactive compounds[J].Applied Microbiology and Biotechnology,2017,101(1):13-33.
[2]刘宁,贾慧,申珅,等.真菌漆酶:多样的生物学功能及复杂的天然底物[J].农业生物技术学报,2020,28(2):333-341.
[3]FOEGEDING E A, DAVIS J P. Food protein functionality: a comprehensive approach[J].Food Hydrocolloids,2011,25(8):1853-1864.
[4]PAN H Y, XU X M, TIAN Y Q, et al. Impact of phase separation of soy protein isolate/sodium alginate co-blending mixtures on gelation dynamics and gels properties[J].Carbohydrate Polymers,2015,125:169-179.
[5]KUMAR R, CHOUDHARY V, MISHRA S, et al. Adhesives and plastics based on soy protein products[J].Industrial Crops & Products,2002,16(3):155-172.
[6]LIU F, ZHANG S, LI J, et al. Recent development of lactoferrin-based vehicles for the delivery of bioactive compounds: complexes, emulsions, and nanoparticles[J].Trends in Food Science & Technology,2018,79:67-77.
[7]JABERIAN H, PIRI K, NAZARI J. Phytochemical composition and in vitro antimicrobial and antioxidant activities of some medicinal plant[J].Food Chemistry,2013,136(1):237-244.
[8]KIM K, RYU J H, LEE D Y, et al. Bio-inspired catechol conjugation converts water-insoluble chitosan into a highly water-soluble, adhesive chitosan derivative for hydrogels and LbL assembly[J].Biomaterials Science,2013,1(7):783-790.
[9]CHIOU B S, AVENA-BUSTILLOS R J, SHEY J, et al. Rheological and mechanical properties of cross-linked fish gelatins[J].Polymer,2006,47(18):6379-6386.
[10]PATEL A K, SINGHANIA R R, PANDEY A. Novel enzymatic processes applied to the food industry[J].Current Opinion in Food Science,2016,7:64-72.
[11]WANG X, CHEN S S, WU D B, et al. Oxidoreductase-initiated radical polymerizations to design hydrogels and micro/nanogels: mechanism, molding, and applications[J].Advanced Materials,2018,30(17):1705668.
[12]LIVNEY Y D. Nanostructured delivery systems in food: latest developments and potential future directions[J].Current Opinion in Food Science,2015,3:125-135.
[13]MCCLEMENTS D J. Encapsulation, protection, and release of hydrophilic active components: potential and limitations of colloidal delivery systems[J].Advances in Colloid & Interface Science,2015,219:27-53.
[14]孙凯,程行,余家琳,等.漆酶催化生物体内有机物合成与分解代谢的双功能机制及其在生物技术领域中的应用[J].农业环境科学学报,2019,38(6):1202-1210.
[15]李平,易弋,邓春,等.漆酶的结构及其应用研究进展[J].中国酿造,2016,35(5):10-15.
[16]QUINTANAR L, YOON J, AZNAR C P, et al. Spectroscopic and electronic structure studies of the trinuclear Cu cluster active site of the multicopper oxidase laccase: nature of its coordination unsaturation[J].Journal of the American Chemical Society,2005,127(40):13832-13845.
[17]SOLOMON E I, SUNDARAM U M, MACHONKIN T E. Multicopper oxidases and oxygenases[J].Chemical Reviews,1996,96:2563-2605.
[18]GARAVAGLIA S, CAMBRIA M T, MIGLIO M, et al. The structure of Rigidoporus lignosus laccase containing a full complement of copper ions, reveals an asymmetrical arrangement for the T3 copperpair[J].Journal of Molecular Biology,2004,342(5):1519-1531.
[19]MORPURGO L, AGOSTINELLI E, SENEPA M, et al. A room temperature electron paramagnetic resonance study of native and fluoride reacted Vietnamese and Japanese lacquer-tree laccases: differences from liquid-nitrogen spectra[J].Journal of Inorganic Biochemistry,1985,24(1):1-8.
[20]吳怡,马鸿飞,曹永佳,等.真菌漆酶的性质、生产、纯化及固定化研究进展[J].生物技术通报,2019,35(9):1-10.
[21]FOROOTANFAR H, FARAMARZI M A. Insights into laccase producing organisms, fermentation states, purification strategies, and biotechnological applications[J].Biotechnology Progress,2016,31(6):1443-1463.
[22]MOGHARABI M, FARAMARZI M A. Laccase and laccase-mediated systems in the synthesis of organic compounds[J].Advanced Synthesis & Catalysis,2014,356(5):897-927.
[23]REISS R, IHSSEN J, RICHTER M, et al.Laccase versus laccase-like multi-copper oxidase: a comparative study of similar enzymes with diverse substrate spectra[J].PLoS One,2013,8(6):65633.
[24]BALDRIAN P. Fungal laccases-occurrence and properties[J].FEMS Microbiology Reviews,2006,30(2):215-242.
[25]龔睿,孙凯,谢道月.真菌漆酶在绿色化学中的研究进展[J].生物技术通报,2018,34(4):24-34.
[26]常晨,梁敏,包怡红.漆酶及其在酿酒工业中的应用研究进展[J].中国酿造,2017,36(7):18-21.
[27]ZHUO R, YUAN P, YANG Y, et al. Induction of laccase by metal ions and aromatic compounds in Pleurotus ostreatus HAUCC 162 and decolorization of different synthetic dyes by the extracellular laccase[J].Biochemical Engineering Journal,2017,117:62-72.
[28]NILADEVI K N, JACOB N, PREMA P. Evidence for a halotolerant alkaline laccase in Streptomyces psammoticus: purification and characterization[J].Process Biochemistry,2008,43(6):654-660.
[29]LI M, KARBOUNE S, LIGHT K, et al. Oxidative cross-linking of potato proteins by fungal laccases: reaction kinetics and effects on the structural and functional properties[J].Innovative Food Science & Emerging Technologies,2021,71:102723.
[30]CUI L, WANG P, FAN X, et al. Laccase-mediated enhancement of the properties of regenerated fibers from wheat gliadin[J].Journal of Cereal Science,2020,96:103129.
[31]FAN J X, GUO X N, ZHU K X. Impact of laccase-induced protein cross-linking on the in vitro starch digestion of black highland barley noodles[J].Food Hydrocolloids,2022,124:107298.
[32]LIU N, NI S, RAGAUSKAS A J, et al.Laccase-mediated functionalization of chitosan with 4-hexyloxyphenol enhances antioxidant and hydrophobic properties of copolymer[J].Journal of Biotechnology,2018,269:8-15.
[33]MANHIVI V E, AMONSOU E O, KUDANGA T. Laccase-mediated crosslinking of gluten-free amadumbe flour improves rheological properties[J].Food Chemistry,2018,264:157-163.
[34]KARAKI N, ALJAWISH A, MUNIGLIA L, et al. Functionalization of pectin with laccase-mediated oxidation products of ferulic acid[J].Enzyme and Microbial Technology,2017,104:1-8.
[35]NEMADZIVA B, LE ROES-HILL M, KOORBANALLY N, et al. Small laccase-catalyzed synthesis of a caffeic acid dimer with high antioxidant capacity[J].Process Biochemistry,2018,69:99-105.
[36]WANG H, YOU S, WANG W, et al. Laccase-catalyzed soy protein and gallic acid complexation: effects on conformational structures and antioxidant activity[J].Food Chemistry,2022,375:131865.
[37]DUAN S, WANG W, LI S, et al. Moderate laccase-crosslinking improves the mechanical and thermal properties of acid-swollen collagen-based films modified by gallotannins[J].Food Hydrocolloids,2020,106:105917.
[38]SATO A C K, PERRECHIL F A, COSTA A A S, et al. Cross-linking proteins by laccase: effects on the droplet size and rheology of emulsions stabilized by sodium caseinate[J].Food Research International,2015,75:244-251.
[39]QAYUM A, HUSSAIN M, LI M, et al. Gelling, microstructure and water-holding properties of alpha-lactalbumin emulsion gel: impact of combined ultrasound pretreatment and laccase cross-linking[J].Food Hydrocolloids,2020,110:106122.
[40]CHAN C K Y, ZEEB B, MCCLEMENTS D J, et al.Impact of laccase on the colour stability of structured oil-in-water emulsions[J].Food Research International,2017,97:223-230.
[41]GAZME B, MADADLOU A.Fabrication of whey protein-pectin conjugate particles through laccase-induced gelation of microemulsified nanodroplets[J].Food Hydrocolloids,2014,40:189-195.
[42]MATTINEN M L, VALLE-DELGADO J J, LESKINEN T, et al. Enzymatically and chemically oxidized lignin nanoparticles for biomaterial applications[J].Enzyme and Microbial Technology,2018,111:48-56.
[43]RUZENGWE F M, AMONSOU E O, KUDANGA T. Gelation profile of laccase-crosslinked Bambara groundnut (Vigna subterranea) protein isolate[J].Food Research International,2023,163:112171.
[44]WANG Y R, YANG Q, LI S Y J, et al. Structural, gelation properties and microstructure of rice glutelin/sugar beet pectin composite gels: effects of ionic strengths[J].Food Chemistry,2021,346:128956
[45]MARTNEZ-LPEZ A L, CARVAJAL-MILLAN E, MARQUEZ-ESCALANTE J, et al.Enzymatic cross-linking of ferulated arabinoxylan: effect of laccase or peroxidase catalysis on the gel characteristics[J].Food Science and Biotechnology,2018,28(2):311-318.
[46]MUNK L, MUSCHIOL J, LI K, et al. Selective enzymatic release and gel formation by cross-linking of feruloylated glucurono-arabinoxylan from corn bran[J].ACS Sustainable Chemistry & Engineering,2020,8(22):8164-8174.
[47]LIU W, ZHU L, LIU Y, et al. Laccase and glucono-δ-lactone dual-induced gelation of casein and arabinoxylan: microstructures, physicochemical properties, and pH-responsive release behavior[J].Food Hydrocolloids,2023,135:108235.
[48]LI X Q, LI S Q, LIANG X P, et al. Applications of oxidases in modification of food molecules and colloidal systems: laccase, peroxidase and tyrosinase[J].Trends in Food Science & Technology,2020,103:78-93.
[49]陳成龙,孙澍雨,周维增,等.漆酶在催化合成生物活性化合物中的研究进展[J].化学通报,2018,81(10):896-902.
[50]BACKES E, KATO C G, CORRE R, et al. Laccases in food processing: current status, bottlenecks and perspectives[J].Trends in Food Science & Technology,2021,115:445-460.

