根治性切除术后复发性肝细胞癌的临床诊疗进展
罗元凯 杨旸 陈木河 白骁 李勇
肝细胞癌(hepatocellular carcinoma,HCC)仍然是一个全球性的健康威胁,发病率位居人类恶性肿瘤的第7位,其在中国的发病率很高,占全世界病例的50%以上[1]。对于HCC患者,手术切除是最常见的根治性治疗方法;然而,即便HCC患者早期获得了标准的外科根治性治疗,术后仍然有很高的复发率。一般来说,40%~50%的复发发生在HCC切除术后3年内,60%~80%发生在5年内[2-3]。复发性HCC通常出现在原发灶的同一区域或相邻区域,也可能出现在其他区域或远处转移。针对肝外科切除治疗后发生HCC复发的病例,现阶段的临床管理路径的主要依据还是国家卫生健康委颁布的《原发性肝癌诊疗指南(2022年版)》[4]。HCC复发是影响术后生存率的关键事件;然而,复发性HCC的临床管理面临着较多的挑战,其中最主要的是缺乏有针对性的标准管理方案和普遍共识的治疗指南。通过文献综述,文章旨在总结现有关于根治术后HCC复发管理的文献,包括明确肝癌根治性切除的定义、诊断标准、分型分期和分别对应的治疗,以满足针对复发性HCC的管理实践。
1 HCC根治性切除的标准
影响复发性HCC预后的因素对其临床诊疗具有关键意义。肿瘤外科切除确保达到根治性标准是保障预后的首要条件[5]。研究发现,HCC术后复发与肝切除术的类型(范围)、手术入路、切缘距离、手术时长、出血量和围手术期并发症有关,这些可能也会对术后复发性HCC的预后造成显著影响,但相关方面的研究甚少[6]。研究复发性HCC的临床分期,为避免外科手术方式差异对复发性HCC预后造成的影响及规避争议,须明确HCC根治性切除的标准。
区分HCC术后复发和非根治性切除术后残留的肿瘤组织是必要的。如姑息性切除以减轻肿瘤负担,则为非根治性切除。肝脏恶性肿瘤没有完全切除或者切缘阳性所导致的残余肿瘤,则不属于文章定义的复发性HCC。目前,在国际研究和指南中,还没有统一或公认的定义来描述HCC的“根治性切除”。此外,值得注意的是,个体化的治疗方案和术后管理是非常重要的,术中和术后的要求和标准可能会因患者的具体情况而有所不同。我国学者综合既往多数研究的结果和文献定义达成共识,提出根治性切除的术中和术后标准[1,7]:(1)术前影像和术中探查显示所有肿瘤病变均被完全切除(包括卫星灶、小脉管癌栓、新病灶等);肿瘤切缘>1 cm,或切缘<1 cm,但切除的标本切缘阴性。(2)没有发现血管或胆管侵犯、淋巴结或远处转移;在腔静脉、门静脉、胆管或肝静脉内未发现肉眼可见的癌栓。(3)排除其他疾病导致的血清甲胎蛋白(α-fetoprotein,AFP)异常升高,术后2个月内AFP水平恢复至正常;术后2个月内的影像学检查未见肿瘤复发征象。
2 诊断
目前临床上诊断复发性HCC主要依据根治性切除的既往手术史和之后再次出现的HCC。我国学者目前达成的共识认为复发性HCC与原发性HCC诊断标准相同,符合指南的临床诊断标准,即可做出临床诊断;或可以通过肿瘤组织切除或穿刺方式进行病理确诊[1,7]。
在影像学上,复发灶具有与原发肿瘤相似的特征,如动脉期强化和门静脉期减弱。要求超声造影、CT、MRI或肝胆特异性对比增强MRI中2种或2种以上影像学检查显示符合HCC的典型表现,多种影像学检查可优势互补[4]。目前国际上推荐使用特异性对比剂进行增强MRI检查,以更好地区分HCC治疗后的坏死性病变、出血性病变、再生结节和肿瘤复发[8]。肝脏影像报告及数据系统(liver imaging reporting and data system,LI-RADS)是专门针对HCC关于影像检查技术、分析方法及诊断报告的详细介绍和规范要求。LI-RADS将肝癌风险人群按良恶性的可能程度分成6个等级或无法评估,以及将HCC治疗效果按肿瘤存活可能性分成3类或无法评估(见图1)[9]。LEE等[10]为确定LI-RADS-5类对HCC的诊断性能,纳入了14项研究,包括2 708项观察结果,涉及1 841个HCC,汇总其每次观察得出的敏感度和特异度分别为70%(61%~78%)和91%(89%~93%)。HCC作为仅依靠影像学检查即可做出临床诊断的恶性肿瘤,LI-RADS在原发性HCC中扮演着重要角色,已被完全纳入美国肝病研究学会(American Association for the Study of Liver Diseases,AASLD)2018年肝细胞癌临床实践指南,同样也适用于复发性HCC的诊断,值得在临床应用上进一步推广普及。
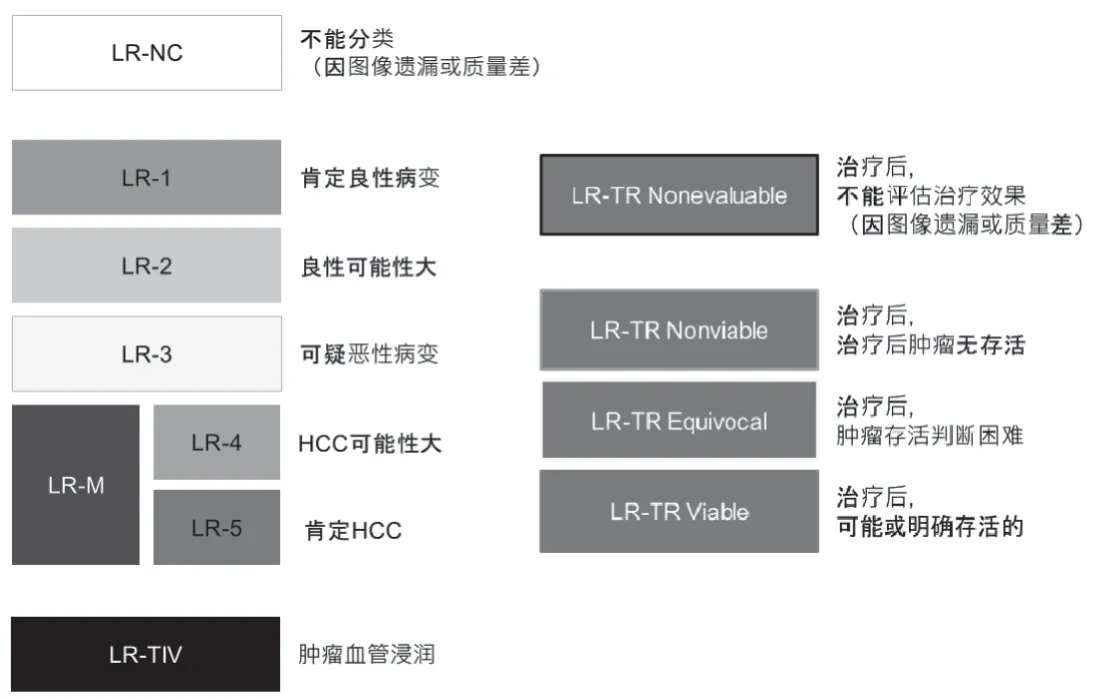
图1 LI-RADS的良恶性可能性分类和治疗后肿瘤存活判断分类
通常,复发性HCC的肿瘤标志物水平会升高,液体活检是一种合适的方法。循环肿瘤DNA(circulating tumor DNA,ctDNA)突变分析可以在术后发现早期复发病灶,血清肿瘤标志物如AFP和α-胎球蛋白(α-fetoprotein lens culinaris agglutiin3,FP-L3)等也可以作为复发性HCC的指标之一,其中通常,随着时间变化的数值趋势比单次数值更有帮助,如AFP明显升高(≥200 ng/mL)高度提示是HCC,AFP升高(≥100 ng/mL)则中到高度可能是HCC,这对早期诊断、预测预后和选择治疗方式具有积极意义[4]。然而,对于复发性HCC,目前单独依靠临床上常用的血清学分子标志物尚不足以达到理想的结果,这些数值可能随着肝脏疾病活动性、肿瘤特异性和患者生活方式等而有所差异。
此外,还有一些特定的情况需要考虑。一般来说,复发性HCC的诊断可能会更加复杂,因为复发性HCC的患者曾经存在过原发性HCC,可能已经接受过一些治疗,如手术切除、放疗、化疗或介入治疗等,这可能会对检查检验结果产生影响。因此,在诊断复发性HCC时,医生需要综合考虑患者的临床病史、影像学检查结果和肿瘤标志物等多个方面的信息。
3 分型
虽然HCC不同的治疗方式有不同的复发风险和生存预期,但复发性HCC自身的肿瘤表型和分子异质性也有着不可忽视的影响,与HCC复发相关的危险因素在很大程度上与肿瘤特异性参数有关。最近的一项回顾性多中心研究报告称,756例接受根治性肝切除术的患者中,复发率为45.5%[3]。其中,HCC复发风险增加以及预后较差的因素包括肿瘤多结节性、大病灶(≥5 cm)、大血管或微血管淋巴管侵犯、术前高AFP水平、巴塞罗那临床肝癌分期系统(Barcelona clinic liver cancer,BCLC)分期较晚。由于术后的高复发率和肿瘤多样性,复发性HCC长期预后及管理仍具有挑战性。因此,HCC疗效的提高很大程度上取决于准确预测和有效控制复发。
根据HCC复发的位置分型,肝内复发是指局限于肝脏部位出现新的肿瘤灶。这可能是由于原发肿瘤细胞在手术前已经存在但未被检测到,或者手术切除后肝内其他部位发生了新的癌性病变,肝内复发占复发性HCC的68%~96%[1,11]。与之相对的是肝外复发,是指HCC在手术后扩散到其他器官或组织,如肺、骨、淋巴结等。单纯的肝外复发仅占8.1%,通常发生在手术后的较长时间内。肝外转移常同时合并有肝内复发,即混合型复发[12]。
肝内复发又可根据起源方式分型,鉴定HCC复发的起源可以极大地帮助准确选择有效的治疗方法。分别为单中心起源(也称单克隆起源)和多中心起源(也称多克隆起源)。前者是原发性HCC病灶切除后,现有手段难以查见的残留肿瘤细胞继续生长或在术前术中已发生的肝内其他部位微小癌灶通过肝内播散或浸润引起的肝内转移(intrahepatic metastasis,IM)。后者是由原本正常的肝细胞发生的恶性转变,形成不源于原发癌灶的多中心发生(multicentric occurrence,MO)的复发性HCC。针对HCC复发起源的鉴别,最早的方法是基于HCC复发时间(time to recurrence,TTR),即将在术后较早复发的HCC定义为IM,而术后较晚复发的HCC定义为MO,一般认为早期复发的HCC预后较差。多数研究以TTR 2年为界,即术后2年内的复发定义为早期复发,而2年之后的为远期复发。然而,也有部分研究将术后1年内甚至6个月内的复发定义为早期复发[13]。因此,对于早期和远期复发的时间界定目前存在争议,需要进一步研究证据来确定[1,14]。我国学者基于近10余年的大样本肝癌专病队列运用多重生物学分析方法构建了肝癌术后“复发四分型”新模式:Ⅰ型—肝内单发寡复发型;Ⅱ型—肝内多发寡复发型;Ⅲ型—进展复发型(复发伴随大血管侵犯或肝外转移);Ⅳ型—超进展复发型。4种类型复发患者表现出了截然不同的无瘤生存期(disease free survival,DFS)和总生存期(overall survival,OS),如即使是早期复发,肝内单发复发型通常预后较好,有机会进行潜在的治愈性治疗。相比之下,复发肿瘤负荷大和(或)存在肝外转移的患者(Ⅲ~Ⅳ型),无论TTR如何,治愈率仍然较低,预后较差,这对预测复发性HCC的预后有重要的指导意义[15]。
基于分子病理学手段、基因组学技术以及肿瘤的分化情况,相关领域的学者对复发性HCC的起源鉴别方法进行了较多的探索和尝试,如DNA甲基化模式检测、线粒体D环区突变模式分析等检测以及比较基因组杂交分析(comparative genomic hybridization,CGH)、miRNA谱试分析等基因组和转录组学分析方法加以区分[16-17]。但这些鉴别方法的敏感度和特异度均不理想,部分手段还会受主观因素的影响。此外技术流程较复杂,需要获取复发和原发的肿瘤样本并进行分析和比较[18-19]。由于可靠性不足和技术难度较大,这些手段尚未得以在临床广泛应用,亟待进一步研究和改进。
4 临床分期
正确的临床分期是制定个体化治疗流程和预测预后的关键。迄今为止,还没有权威的专门针对复发性HCC的临床分期标准。BCLC被认为是原发性HCC最合理的分期标准[20]。然而,它是否适用于复发性HCC尚不清楚。尽管如此,原发性HCC分期方案(如BCLC分期系统)通常被外推运用于帮助预测结果和指导复发性HCC的临床决策。YAO等[21]研究了BCLC分期对复发性HCC的适用性,并证明了在不同BCLC分期的复发性HCC个体具有与原发性HCC相似的总体生存期等预后指标,从而验证了BCLC分期系统在复发性HCC背景下的可行性。作者认为BCLC分期系统或许适用于复发性HCC,但不够精确,在这种情况下,进一步研究复发性HCC的流行病学、生物学和临床特征至关重要。制定复发性HCC的临床分期标准,有助于为患者制定更精准、个体化的治疗方案,提高治疗效果。
目前流行的权威分期方案,如BCLC和中国肝癌分期方案(China liver cancer staging,CNLC),并不是为了指导复发性HCC的治疗或决策而制定的。因此,这些分期系统和诊疗指南不应笼统地应用于复发性HCC患者。近来的研究数据表明原发肿瘤的形态学参数以及复发时间、肝外扩散以及复发结节的大小和数量是复发性HCC长期结果的主要决定因素,更有助于预测复发后的总生存期和无瘤生存期[21]。TOYAMA等[22]为进一步开发新的分期系统,纳入了861例HCC病例,基于复发次数、Child-Pugh评分、<3 cm且无血管侵犯的结节以及AFP水平,开发了一个既可适用于原发性HCC也可适用于复发性HCC的评分系统,可反映HCC患者进展情况、治疗反应和肝功能,与其他评分系统相比具有更强的判别能力。
最佳的复发性HCC分期策略应尽可能多地纳入疾病相关信息。原则上应考虑肿瘤特异性特征(即结节的大小和数量、复发部位以及血管浸润等其他提示侵袭性的病理特征)、肝脏功能情况(如基于影像学和血清学检查的肝硬化以及肝炎病毒活性评估),以及治疗史的详细信息。此外,分期系统应明确区分单中心起源和多中心起源的复发性HCC,而且对患者进行预后分层,并提供治疗手段的建议。
5 治疗策略
PAPACONSTANTINOU等[20]设计了一个复发性HCC的管理流程图(图2),但是尚未得到大规模的验证以及广泛普及,目前仅供参考。另一个诊疗流程图对单中心和多中心起源的复发做了区分(图3),但它是针对肝移植治疗后复发的HCC,具备一定的参考价值和认可度[23]。
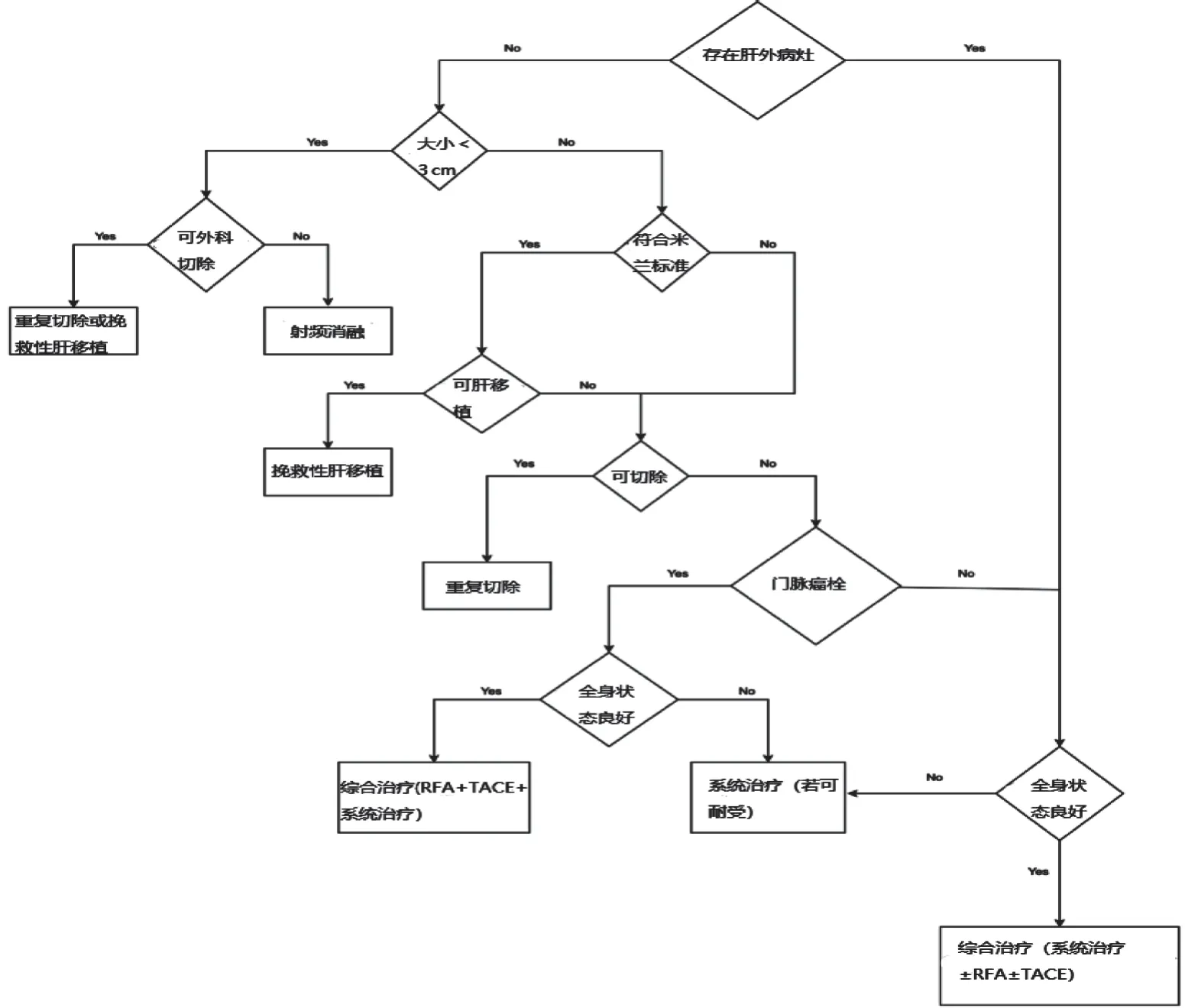
图2 复发性HCC的管理流程建议图。射频消融(radiofrequency ablation,RFA);经导管肝动脉化疗栓塞(transarterial embolization,TACE)
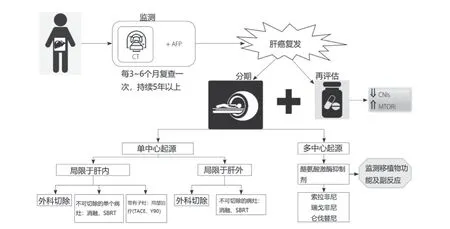
图3 肝移植后复发性HCC的诊治建议。钙调神经磷酸酶抑制剂(calcineurin inhibitors,CNIs);哺乳动物雷帕霉素靶向抑制剂(mammalian target of rapamycin inhibitor,MTORi);立体定向放疗(stereotactic body radiation therapy,SBRT);钇90局部内放射治疗(Y90 selective internal radiation therapy,SIRT)
复发性HCC的治疗策略需要多学科联合支持,可以采用的手段包括射频消融、外科再切除、肝移植、靶向和免疫治疗,同时考虑肿瘤大小、位置和肝功能代偿情况以及基础性疾病。国内有学者针对切除术后复发性HCC建立了再切除的生存预测模型,推荐预测生存较好者行再次外科切除术[24]。由于术后复发患者肝剩余体积减小,肝储备功能受损,腹腔术区存在粘连,以及患者通常对再次手术心存顾虑;因此,再切除术前需进行全面评估。现有研究结果表明,再切除术后5年生存率为35.2%~72.0%[25-26]。如果复发灶是肝内复发,且患者的肝功能良好,再切除是一种有效的治疗方法。此外,再切除对远期复发疗效相对较理想,部分患者甚至可以从第3次或更多次肝切除中生存获益,TTR越短的复发性HCC越不适宜该治疗[27]。再次切除肿瘤组织或许可以延长患者的生存时间。然而,仅有手术切除可能无法完全控制复发,因此需要结合其他治疗方法。
对于局限于肝内复发的HCC,射频消融、TACE和局部放疗等可以考虑。射频消融是一种通过高温破坏肿瘤组织的方法,具有并发症相对可控、住院周转快、手术费用低等优点。TACE可以通过导管直接输送化疗药物到肿瘤部位并长时间留存,同时对肿瘤供血血管有栓塞作用。放疗可以通过放射线引起永久性DNA损伤,导致肿瘤细胞的坏死和凋亡。国内学者对240例复发性HCC平均分2组进行再切除与经皮消融治疗,结论表明对于早期复发性HCC,2组患者的生存结局和安全性没有显著差异;对于癌灶直径>3 cm或AFP水平>200 ng/mL的患者,重复肝切除术可能有着更好的局部疾病控制和生存结局[28]。然而,恶性肿瘤具有转移和扩散的特性,局部治疗存在天然的局限性,因此需要结合全身系统性治疗。
靶向和免疫治疗是一种针对肿瘤特定分子靶点和细胞信号通路,或通过调节患者的免疫系统、肿瘤微环境来抑制肿瘤细胞的治疗方法。靶向治疗药物如索拉非尼、仑伐替尼等,免疫治疗药物如程序性死亡受体-1(programmed cell death protein 1,PD-1)抑制剂和细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抑制剂可以抑制肿瘤生长和扩散,延长患者的生存时间。总体上,靶向治疗的总体生存时间约为1年,且客观反应率偏低,仍急需新药物的替代[29]。目前,国内和国际针对靶向和免疫治疗的研究,还有大量的临床试验和实践正在进行中。
7 小结与展望
复发性HCC的研究中存在一些问题和挑战,同时也有一些未来的研究方向可以探索。目前对于根治性切除的定义较为模糊,对HCC的复发机制的认识相对有限,进而在某种程度上限制了对复发性HCC分期分型以及治疗的研究进展。未来的研究可以探索分子机制、细胞信号通路、肿瘤微环境等方面的变化,以揭示复发的机制,鉴别复发性HCC的类型,并针对早期复发和晚期复发开展更多相关的高质量临床研究和研发相应的新药。
目前的主流的临床分期系统如BCLC和CNLC等并没有明确区分单中心和多中心起源的复发性HCC,也没有对肿瘤特征如微血管侵犯等情况进行细分。复发性HCC可能具有不同的生物学特征和预后,这需要未来基于大样本、多组学的研究加以进一步解决,探索建立个体化的临床分期。
当前针对复发性HCC的不同治疗手段有各自的局限性,单独应用尚难以取得令人满意的疗效。优化和明确根治性切除的手术标准、科学选择手术时机及研发新的抗复发技术,可从源头上减少复发风险。同时,开发早期诊断标志物对于复发性HCC的早诊早治非常重要。未来的研究可以探索新的分子标志物、影像学技术、液体活检等方法,以提高复发性HCC的早期诊断水平。
综上所述,未来的研究方向包括深入了解复发机制、设计区别单中心和多中心起源复发的临床诊疗路径以及开发早期诊断标志物。这些研究将有助于提高复发性HCC的诊断和治疗水平,最终改善患者的预后和生存率。

