比较蛋白质组学揭示茉莉酸甲酯诱导的雷公藤甲素生物合成△
张逸风,赵瑜君,苏平,吴晓毅,夏梦,高伟*,黄璐琦*
1.中国中医科学院 中药资源中心 道地药材品质保障与资源持续利用全国重点实验室,北京 100700;2.首都医科大学 中医药学院,北京 100069
雷公藤为卫矛科植物雷公藤Tripterygium wilfordiiHook.f.的全根或根的木质部,具有祛风除湿、通络止痛的功效。其主要活性成分雷公藤甲素具有显著的抗肿瘤、抗炎、免疫抑制等药理活性[1-2],可用于治疗类风湿性关节炎、系统性红斑狼疮、肝癌、胰腺癌等[3]。然而,当前雷公藤甲素的获取仍主要依赖于从植物中直接提取分离,其在基原植物中的质量分数仅为0.000 1%[4]。随着新药开发、基础科研和临床需求不断增加,药物基原植物和土地资源破坏日益加剧,急需寻求新的资源获取途径。
近年飞速发展的合成生物学为雷公藤甲素等中药活性成分异源获取带来可能。Paddon 等[5]通过整合青蒿素生源途径基因至大肠埃希菌底盘,使青蒿素前体青蒿酸产量达到25 g·L–1,并通过简单的化学反应获得青蒿素。Hong 等[6]解析了士的宁生物合成下游8 个关键酶参与的10 步生物合成途径,实现了烟草从头合成士的宁、马钱子碱等活性成分。因此,异源合成首先需要解析完整的生物合成途径。雷公藤甲素的生物合成首先经过甲羟戊酸(MVA)和2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径生成牻牛儿基牻牛儿基焦磷酸(GGPP),后经柯巴基焦磷酸合酶TwTPS7(v2) 和次丹参酮二烯合酶TwTPS27(v2)生成二萜骨架次丹参酮二烯[7],再由CYP82Ds、CYP71BEs 等进行骨架修饰[8-9]。尽管近年来在雷公藤甲素生物合成途径解析方面取得了较好的进展,但其生源途径仍未完全解析。
蛋白质是基因转录、翻译和加工后的产物,其作为生命活动的主要承担者能够直接参与代谢过程。通过蛋白质水平的研究能够有效反映不同生理或病理状态下蛋白质的表达情况,相较于研究基因转录水平的表达其具有更直接的优势。目前,植物蛋白质组学研究主要应用于大豆、水稻、番茄等[10-11],在药用植物领域应用较少。本研究应用比较蛋白质组学技术探究雷公藤甲素生物合成关键酶,为中药活性成分生源途径解析研究提供参考。
1 材料
1.1 样品
雷公藤悬浮细胞由中国中医科学院中药资源中心实验室继代保存。
1.2 菌株和载体
大肠埃希菌Escherichia coli Trans1-T1 感受态细胞、pEASY®-Blunt Zero载体均购自北京全式金生物技术有限公司;pENTR ™/SD/D-TOPO®Vector、pENTR™/D-TOPO® Vector 均购自美国Invitrogen 公司;pK7GWIWG2D质粒为本实验室保存。
1.3 试药
Murashige&Skoog(MS)基本培养基(美国PhytoTechnology Laboratories 公司);激动素(KT)、2,4-二氯苯氧乙酸(2,4-D)、吲哚-3-丁酸(IBA)、茉莉酸甲酯(MeJA)、卡那霉素、壮观霉素均购自美国Sigma 公司;Phusion®High-Fidelity PCR Master Mix with HF Buffer(美 国New England Biolabs 公司);KAPA SYBR®FAST Universal 2×qPCR Master Mix(美国KAPA Biosystems 公司);琼脂糖凝胶DNA 回收试剂盒、RNA 纯化试剂盒、FastKing RT Kit(With gDNase)均购自天根生化科技(北京)有限公司;E.Z.N.A Plasmid Maxi Kit、E.Z.N.A Plasmid Mini Kit 均购自美国Omega 公司;Gateway®LR Clonase™ Ⅱ Enzyme Mix(美国Invitrogen公司);Eastep®Super 总RNA 提取试剂盒(上海普洛麦格生物产品有限公司);二奎啉甲酸(BCA)试剂盒(北京索莱宝科技有限公司)。
1.4 仪器
Veriti™型96 孔梯度聚合酶链式反应(PCR)仪(美国Applied Biosystems 公司);LightCycler 480 型荧光定量PCR 仪(瑞士Roche 公司);ZHWY-200D型恒温振荡摇床(上海智城分析仪器制造有限公司);MM400 型混合型研磨仪(德国Retsch 公司);DYY-6D 型核酸电泳仪(北京市六一仪器厂);BGgdsAUTO520 型凝胶成像分析系统(香港基因有限公司);AC2-4S1 型生物安全柜(新加坡ESCO 科技有限公司);5810R型低温冷冻离心机(德国Eppendorf公司);BT25S型十万分之一天平(德国赛多利斯公司);S210 型pH 计(美国Mettler-Toledo 公司);ACQUITY UPLC™ Ⅰ-Class System 型超高效液相色谱(美国Waters 公司);NanoDrop One 型核酸/蛋白质分析仪、EASY-nLC1000 型高效液相色谱(美国Thermo Scientific公司)。
2 方法
2.1 雷公藤悬浮细胞诱导与取样
雷公藤悬浮细胞继代培养,转接入含0.5 mg·L–12,4-D+0.5 mg·L–1IBA+0.1 mg·L–1KT的MS液体培养基(pH 5.8),在120 r·min–1、25 ℃黑暗培养。于继代培养12 d后,诱导组加入终浓度为50 μmol·L–1的MeJA,对照组加入等体积溶剂,混匀后继续培养。分别于处理后0、24、48、72、240、360 h 取样,各样品组设置3个重复。
2.2 雷公藤甲素测定
2.2.1 雷公藤甲素提取 雷公藤悬浮细胞新鲜样品于液氮环境下充分粉碎,冷冻干燥36 h,精密称定样品干燥粉末50 mg,置于2 mL 离心管中,精密加入80%甲醇1 mL,在25 ℃超声提取60 min,功率为100 W,频率为40 kHz,样品取出放冷至室温。6000×g离心10 min,上清液过0.22 μm 聚四氟乙烯(PTFE)微孔滤膜,即得供试品溶液,使用超高效液相色谱法(UPLC)分析[7]。
2.2.2 UPLC检测条件 使用ACQUITY UPLC™ Ⅰ-Class System 连接光电二极管阵列检测器(PDA);ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱(0~5 min,30%~35%B;5~8 min,35%B;8~15 min,35%~70%B;15~21 min,70%~90%B);流速为0.4 mL·min–1,进样量为1 μL;柱温为40 ℃;检测波长为200~500 nm。
2.3 代谢物分析
以Ultimate 3000 超高效液相色谱仪(含自动进样器、柱温箱、在线真空脱气机、低压四元梯度泵、PDA 检测器)和LTD Orbitrap velos pro 质谱仪 [高分辨静电场轨道肼质谱,电喷雾离子源(ESI)] 进行检测。色谱条件:Agilent SB-C18色谱柱(150 mm×4.6 mm,2.7 μm);柱温为30 ℃;样品盘温度为4 ℃;流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~65 min,5%~100%B);流速为0.3 mL·min–1;进样体积为5 μL。ESI 参数设定:正离子扫描模式;毛细管温度为350 ℃;毛细管电压为35 V;喷雾电压为3.5 kV;鞘气(N2)流速为40 psi(1 psi≈6.895 kPa);辅助气(N2)流速为10 psi。样品一级质谱在全扫描模式下进行全扫描(分辨率为30 000,扫描范围为m/z150~1500),数据采集和分析采用Xcalibur ™ 2.2 软件。使用Metaboanalyst 在线代谢组数据综合分析平台进行数据分析和处理,经过归一化、去噪后,将数据转化成标准的数据矩阵。采用多元统计分析中的偏最小二乘法-判别分析(OPLS-DA)对不同类型的样品数据进行聚类分析。
2.4 蛋白质组学分析
2.4.1 蛋白质的裂解和定量 取全部样品,于液氮环境中研钵磨碎成粉末状,加入5 倍体积的丙酮-三氯乙酸(9∶1),涡旋混匀,在–20 ℃静置4 h;4 ℃、5000×g离心40 min,弃上清液;加入预冷的丙酮,洗涤3 次,通风橱中干燥沉淀;取干燥后的粉末,分别加入SDT 裂解液 [含2%十二烷基硫酸钠、100 mmol·L–1二硫苏糖醇(DTT)、100 mmol·L–1三羟甲基氨基甲烷盐酸盐(Tris-HCl)、pH 7.6]500 μL,涡旋振荡彻底重悬沉淀,在100 ℃沸水煮8 min;超声破碎提取蛋白质(功率为80 W,工作时间为10 s,间歇时间为15 s,共破碎10 次),在100 ℃煮15 min;13 000×g离心50 min,取上清液,BCA 试剂盒检测蛋白质含量;分装并于–80 ℃保存蛋白质样品。
2.4.2 蛋白质过滤辅助样品制备(FASP)酶解 每份样品分别取200 μg,加入DTT(100 mmol·L–1),100 ℃沸水煮8 min,取出后冷却;加入尿素缓冲液(含8 mol·L–1尿素、150 mmol·L–1Tris-HCl,pH 8.0)200 μL混匀,转入30 kDa蛋白质超滤管,5000×g离心20 min;加入缓冲液200 μL,13 000×g离心20 min,弃滤液;加入碘乙酸铵(50 mmol·L–1碘乙酸铵溶于前述缓冲液)100 μL,600 r·min–1振荡1 min,黑暗条件下室温孵育30 min,13 000×g离心15 min;加入尿素缓冲液100 μL,13 000×g离心15 min,重复2 次;加入碳酸氢铵水溶液100 μL,13 000×g离心10 min,重复2次;加入胰蛋白酶缓冲液(胰蛋白酶4 μg溶于碳酸氢铵水溶液40 μL)40 μL,600 r·min–1振荡1 min,37 ℃孵育16~18 h。换新收集管,13 000×g离心10 min,收集滤液,C18-SD Extraction Disk Cartridge脱盐处理,280 nm下测定吸光度(A)。
2.4.3 高效液相色谱-质谱法(HPLC-MS/MS)分析 取酶解产物2 μg进行HPLC-MS/MS分析。采用纳升流速HPLC 液相系统连接EASY-nLC1000 分离。色谱柱为Thermo EASY column SC200 RP-C18(100 mm×150 μm,1.8 μm),流动相A 为0.1%甲酸-乙腈水溶液(含乙腈2%),流动相B 为0.1%甲酸-乙腈水溶液(含乙腈84%)。Thermo EASY column SC001 traps(20 mm×150 μm,1.8 μm,RP-C18)上样,经色谱柱分离,流速为0.4 μL·min–1。梯度洗脱(0~100 min,0~45%B;100~108 min,45%~100%B;108~120 min,100%B)。酶解产物经HPLC分离后,经Q-Exactive 质谱仪分析;120 min,正离子检测,母离子扫描范围为m/z300~1800,多肽和多肽碎片的m/z按每次全扫描后采集20 个碎片图谱[MS2scan,高能碰撞解离(HCD)],MS1 在m/z200 时分辨率为70 000;MS2 在m/z200 时分辨率为17 500。
2.4.4 Label-free 定量及数据分析 将原始文件导入Maxquant 1.3.0.5 软件,输入自建的雷公藤转录组数据库P16208_382410.fasta,各数据库合并后蛋白质数目为382 410,进行非标定量分析(LFQ)。主要参数设置为主检索ppm 6;丢失碎片2;MS/MS允许ppm 20;胰蛋白酶;固定修饰类型:脲甲基化;可变修饰:氧化反应;乙酰基;反向诱导数据模式;肽段FDR 0.01;蛋白质FDR 0.01。
2.5 生物信息学分析
生物信息学用于分析差异蛋白质的功能及定位。蛋白质序列经过美国国家生物技术信息中心(NCBI)蛋白质数据库及雷公藤P16208_382410数据库比对进行初步分析。基因本体(GO)数据库(http://www.geneontology.org/page/go-database)和InterProScan数据库用于进一步的功能注释。京都基因与基因组百科全书(KEGG)数据库(http://www.kegg.jp)用于标注蛋白质分布。
2.6 实时荧光定量聚合酶链式反应(qRT-PCR)基因表达分析
取MeJA处理后0、24、48、72、240、360 h的样品,RNA提取方法参照试剂盒说明书,第一链cDNA反转录参照FastKing RT Kit(With gDNase)说明书。依据KAPA SYBR®FAST Universal 2×qPCR Master Mix,使用qRT-PCR 仪进行检测。反应体系包括2×Fast qPCR Master Mix 10 μL、10 µmol·L–1正向引物(F)0.4 μL、10 µmol·L–1反向引物(R)0.4 μL、cDNA 1.0 μL,无菌水补足至20 μL。反应程序为95 ℃ 3 min;95 ℃ 3 s,60 ℃ 30 s,40 个循环。以β-actin作为管家基因,采用2–ΔΔCt法分析结果。引物设计见表1。

表1 MeJA处理后不同时间雷公藤细胞样品qRT-PCR分析引物
2.7 基因的体内功能研究
2.7.1 目的基因全长的克隆 根据转录组数据设计引物,cDNA 扩增得到目的序列全长,引物见表2,反应体系为Phusion Mix(2×)25 μL、正向引物(10 μmol·L–1)2.5 μL,反向引物(10 μmol·L–1)2.5 μL,质粒模板1 μL,加入无菌水至50 μL。使用Veriti™ 96 孔PCR 仪进行反应,反应程序为98 ℃30 s;98 ℃ 10 s,56 ℃ 45 s,72 ℃ 15 s,35 个循环;72 ℃ 7 min。DNA 片段连接Blunt-zero 克隆载体,转化E.coliTrans1-T1感受态细胞,经单克隆阳性PCR及测序验证,获得目的基因全长。

表2 雷公藤细胞中目的基因克隆引物
2.7.2 干扰表达载体的构建 根据相应基因序列,设计扩增400~500 bp特异性片段的引物,引物见表3。采用Gateway 方法构建干扰表达载体,分为入门载体构建和表达载体构建。
入门载体构建:PCR 扩增目的片段,纯化产物2 μL、pENTR ™ SD/D-TOPO®vector 0.5 μL、salt solution 0.5 μL 混匀,22 ℃反应2.5 h,转化E.coli Trans1-T1 感受态细胞,以带卡那霉素抗性的固体平板筛选,单菌落使用M13 正、反向引物(表3)进行阳性克隆验证并测序,获得带有目的片段的入门载体。
表达载体构建:入门载体300 ng、表达载体pK7GWIWG2D 300 ng、TE Buffer(pH 8.0)0.6 μL、Gateway®LR Clonase Enzyme Mix 1 μL 配制反应体系,25 ℃反应4 h,转化E.coliTrans1-T1 感受态细胞,以含100 mg·L–1壮观霉素抗性的固体平板筛选后,单菌落使用pK7正向引物(表3)、相应序列反向引物进行阳性克隆验证并测序,获得带有目的片段的干扰表达载体。使用Plasmid Maxi Kit(OMEGA)进行高浓度的质粒提取。
2.7.3 雷公藤悬浮细胞预培养及转化 雷公藤悬浮细胞200 mg 转继代到MS 固体培养基,25 ℃避光预培养7 d后使用基因枪分别将含有目的基因(TwTF1、TwTF2、CYP82AQ2、CYP71BE89和Tw2ODD)的质粒转化悬浮细胞[12]。转化空载体pK7GWIWG2D 及未转化质粒的悬浮细胞(WT)作为对照组,每组设置5个重复。
2.7.4 表达载体转化验证、基因表达分析及雷公藤甲素含量检测 转化细胞继续暗培养1 周后,提取悬浮细胞样品总RNA 并反转录成cDNA。使用Kanamycin 的正反引物(表3)进行克隆,通过PCR扩增后电泳检测是否含有1397 bp卡那霉素片段,验证表达载体是否成功转入悬浮细胞。检测干扰基因表达水平,方法同2.6 项下。雷公藤甲素提取与检测方法同2.2项下。
3 结果与分析
3.1 悬浮细胞响应MeJA诱导积累雷公藤甲素
为了观察MeJA 对植物悬浮细胞中雷公藤甲素积累的影响,使用50 μmol·L–1MeJA 处理后,检测0~360 h样品中雷公藤甲素含量,同时使用未处理的悬浮细胞作为对照组。在最初的48 h 内,雷公藤甲素的含量几乎没有变化,对照组和MeJA 处理组间差异无统计学意义。诱导后48 h,雷公藤甲素含量逐渐增加,并且MeJA 处理组增加幅度更明显,至240、360 h,MeJA 处理组较对照组雷公藤甲素含量分别提升了2.96、4.23 倍(图1)。这进一步证实了MeJA 能促进雷公藤悬浮细胞中雷公藤甲素的生物合成。
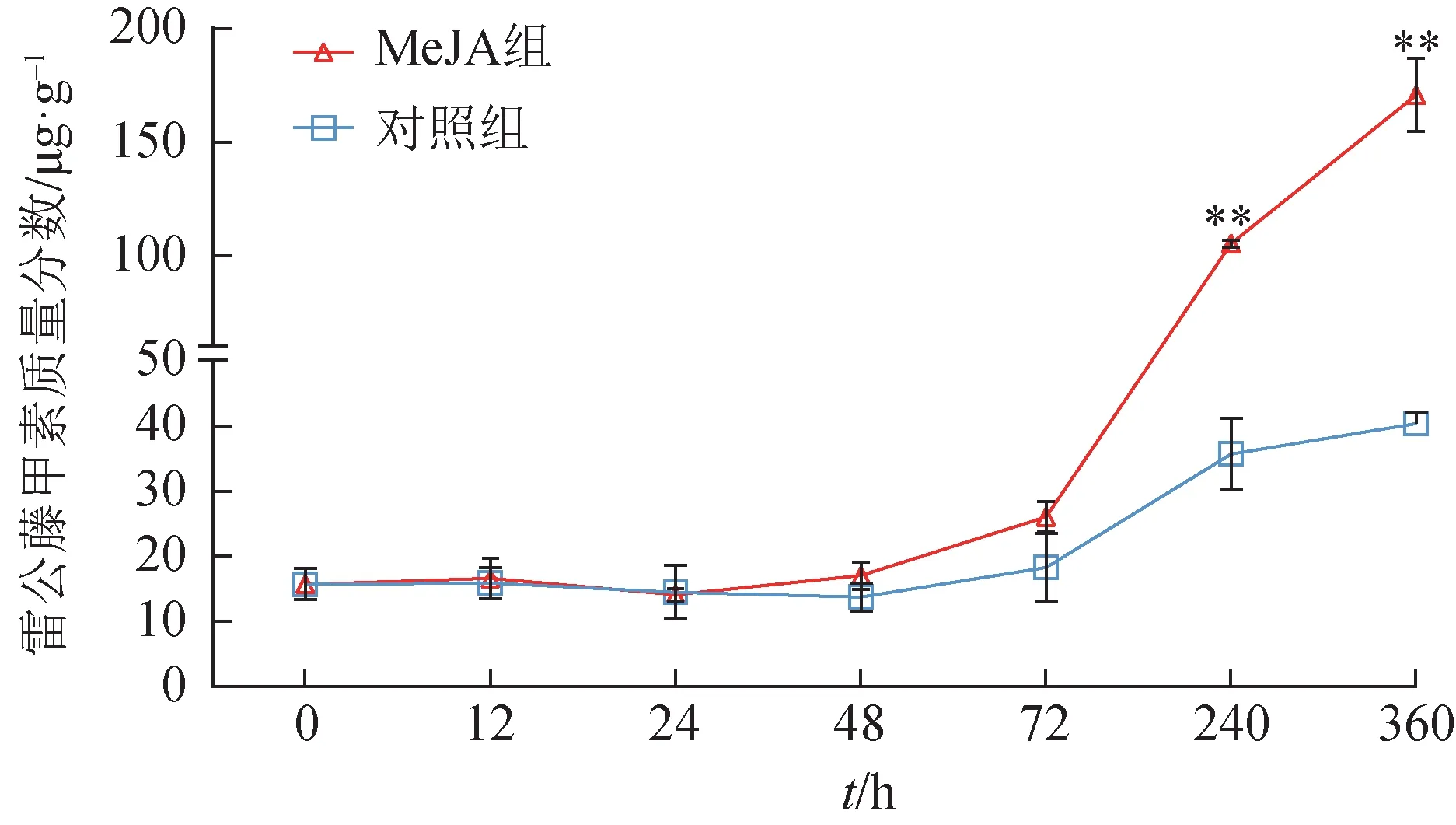
图1 MeJA诱导雷公藤悬浮细胞中雷公藤甲素质量分数积累曲线(±s,n=3)
3.2 蛋白质组学样品筛选及数据分析
采用无标记比较蛋白质组学技术检测雷公藤甲素相关的蛋白质受MeJA 诱导后的变化情况。在对样品进行蛋白质组测序之前,采用高分辨率质谱法检测雷公藤悬浮细胞中的化学成分,并采用OPLSDA 对样品的所有峰值进行化学计量分析。经MeJA处理48、240 h的6个样品(分别标记为MJ48-1~MJ48-3和MJ240-1~MJ240-3)差异最大。其中,69.9%的化学成分可用于明确区分2组样品(图2)。根据雷公藤甲素累积曲线和OPLS-DA 结果,选择MJ48 组和MJ240组样品进行无标记定量并比较差异蛋白质。

图2 MeJA诱导雷公藤悬浮细胞样品OPLS-DA
3.3 比较蛋白质组数据分析
蛋白质组数据中MJ48 和MJ240 2 组分别检测到15 812、15 698 个特异肽段,分别注释到2608、2562 个蛋白质(在线数据库ID:IPX000154000)。其中,142 个蛋白质为MJ48 特有,96 个蛋白质为MJ240特有。在2组共有的2466个蛋白质中,138个蛋白质差异有统计学意义(ratio<0.5 或>2.0,P<0.05)。与MJ48相比,64个蛋白质在诱导后240 h表现为丰度增加,74个蛋白质表现为丰度降低(图3)。

图3 MeJA处理后不同时间的雷公藤细胞蛋白组数据及差异蛋白聚类分析
3.4 差异蛋白质功能分析
对检测到的376 个差异蛋白质进行GO 功能分析,可依据生物过程(BP)、分子功能(MF)和细胞组分(CC)进行分类。以GO2为分类标准,三大类又可进一步分为13、5 和6 小类。在BP 的各项分布中,代谢过程和细胞过程占比较大,分别占总数的40%、29%和8%。MF 分类中占比依次为催化活动(54%)、联结(35%)和结构分子活性(7%)。而在376 个差异蛋白质中,141 个蛋白质定位于细胞(46%)、91 个蛋白定位于细胞器(30%)、36 个蛋白质属于高分子复合物(12%)。
对功能分类中不同表达模式的蛋白质进行进一步分析。依据MJ48 和MJ240 蛋白质丰度变化规律,以不同颜色表示不同表达模式蛋白质,绘制蛋白质表达模式图,见图4A。依据蛋白质表达情况,分为蛋白质丰度上调组、丰度下调组、仅MJ48表达组和仅MJ240表达组。以蛋白质丰度表达模式绘制各功能占比,见图4B。图4B显示,与雷公藤甲素生物合成相关的功能以蛋白质丰度下调(紫色)和仅MJ48表达(蓝色)标注的蛋白质数量占比较大,以代谢过程相关的蛋白质为例,蛋白质丰度下调或MJ48特有的蛋白质数量占该功能蛋白质总数的58%,后期需要重点关注。同时,差异蛋白质参与催化活动和代谢过程的蛋白质数量较多,表明MJ48 和MJ240 2 组间可能存在不同的代谢活动,从而影响代谢物的产生。

图4 MeJA处理后不同时间的雷公藤细胞差异蛋白质的生物信息学分析
3.5 差异蛋白质的代谢途径分析
KEGG通路分析结果表明,376个差异蛋白质共参与118 个代谢途径。图4C 根据蛋白质数量从高到低列举了20 个与二萜生物合成途径相关的初生及次生代谢途径,涉及二萜、倍半萜、三萜以及萜类骨架生物合成通路。
萜类骨架生物合成途径检测到8 个萜类骨架蛋白质,其中,植物1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)和3-羟基3-甲基戊二酰辅酶A 还原酶(HMGR)仅出现在MJ48 组,2-C-甲基-D-赤藓醇-4-磷酸胱氨酰转移酶(MCT)和牻牛儿基牻牛儿基焦磷酸合酶(GGPS)仅在MJ240 组。另外4 个蛋白质4-羟基-3-甲基丁-2-烯基二磷酸还原酶(HDR)、3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)、4-羟基-3-甲基丁-2-烯基二磷酸合酶(HDS)和1-脱氧-D-木酮糖-5-磷酸盐还原异构酶(DXR)出现在下调组,蛋白质丰度分别降低至MJ48 的0.18、0.24、0.49、0.19倍。上述8 个萜类骨架蛋白质均参与萜类生物合成上游MVA 或MEP 途径,生成萜类中间体IPP 和DMAPP用于继续萜类的下游生物合成途径。
3.6 差异基因转录表达分析
为了验证蛋白质组数据的真实性,利用qRTPCR检测了上述8种萜类骨架酶编码基因在MeJA 诱导后的转录表达情况。表达模式可分为2 类,表达上调和表达差异无统计学意义(图5)。大多数基因归为上调组:TwDXR、TwDXS、TwHMGS、TwHDS、TwGGPS、TwHDR、TwMCT。其中,TwDXR、TwDXS、TwHMGS、TwHDS和TwGGPS在诱导后48 h 表达量出现单峰,TwHDR在诱导后24 h 出现单峰,TwMCT在24 和240 h 有2 个高峰。而TwHMGR表达量差异无统计学意义。Liu 等[13]经检测发现TwHMGR的表达高峰出现在诱导后4 h,并且诱导后12 h 恢复至正常水平。这些结果与相应的蛋白质丰度高度一致,表明蛋白质组学数据质量较高,有助于探索参与雷公藤甲素生物合成的潜在蛋白质。
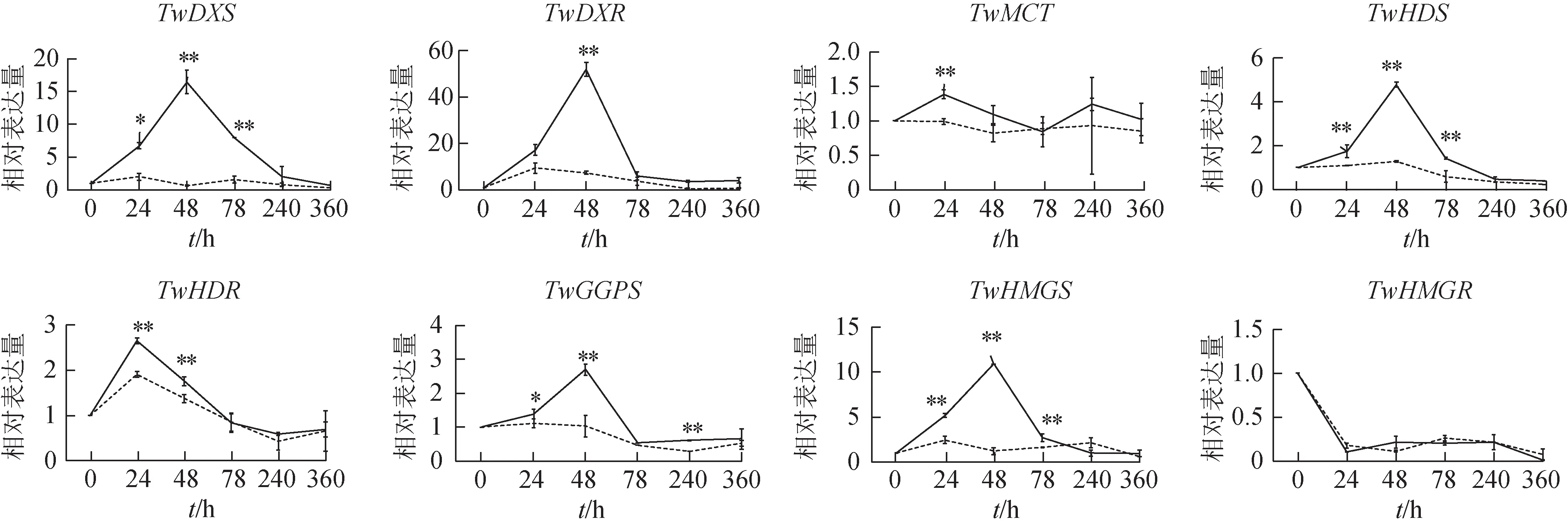
图5 MeJA诱导的萜类骨架基因相对表达水平(±s,n=3)
本研究检测到了8 个细胞色素P450(CYPs)、3个转录因子(TFs)和2-氧戊二酸依赖的双加氧酶(2ODD),对其编码基因受MeJA 诱导后转录水平的表达进行检测,见图6。依据MeJA 组和对照组表达量,表达模式分为3类。第1类7个基因MeJA诱导后表达量高于对照组,包括4 个CYPs(CYP82AQ2、CYP71BE89、TwCYP-3和TwCYP-4)、2个TFs(TwTF1和TwTF2)和Tw2ODD。第2 类MeJA 处理组表达量低于对照组,包含2个CYPs(TwCYP-5和TwCYP-6)、1 个TF(TwTF3)。剩下的2 个CYPs(TwCYP-1 和TwCYP-2)在两组间差异无统计学意义。结合前期生物信息学分析结果,认为第1类基因为后期实验重点研究对象。以上20个基因编码的蛋白质在比较蛋白质组中的信息见表4、表5。
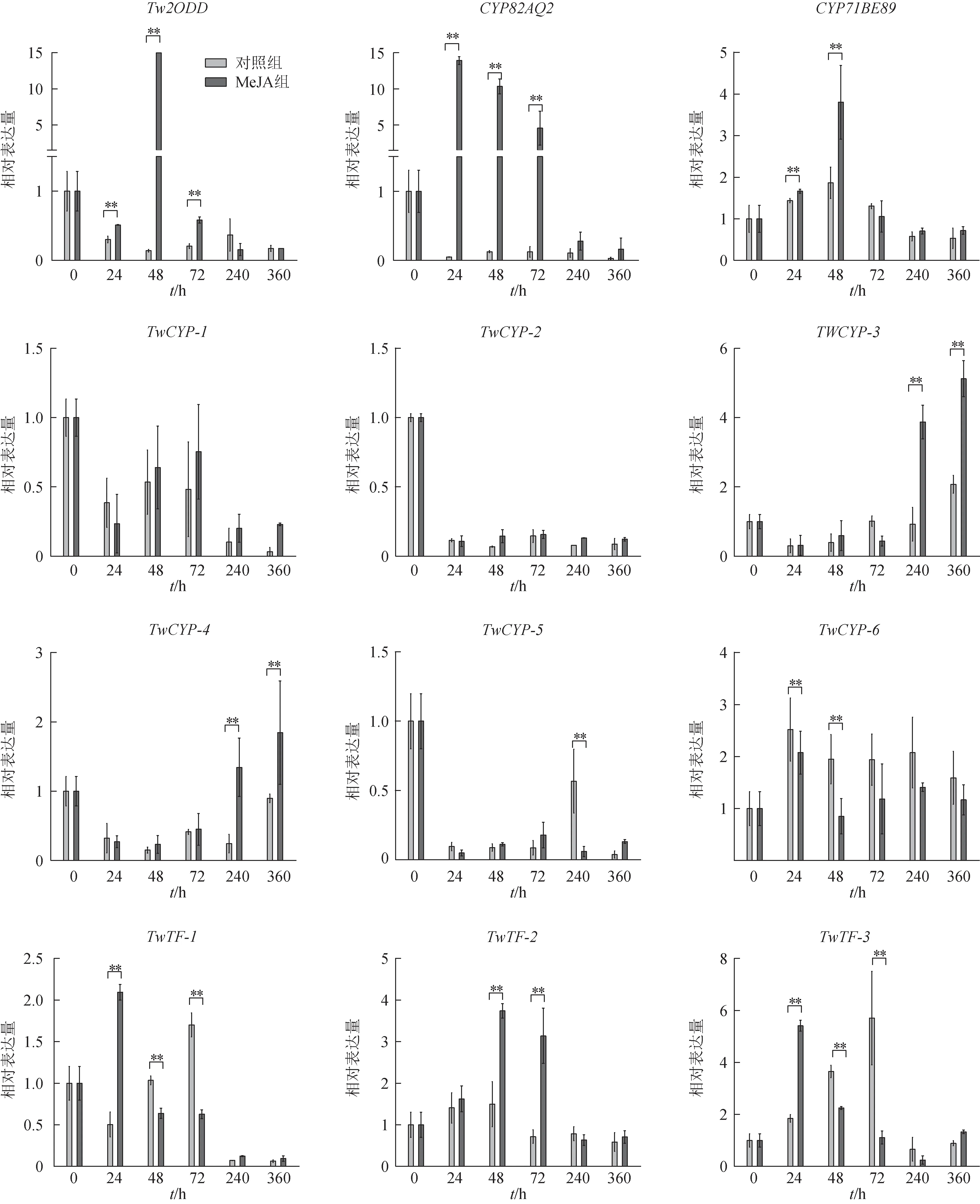
图6 MeJA诱导的基因相对表达水平(±s,n=3)

表4 MJ48和MJ240中均表达的蛋白质信息
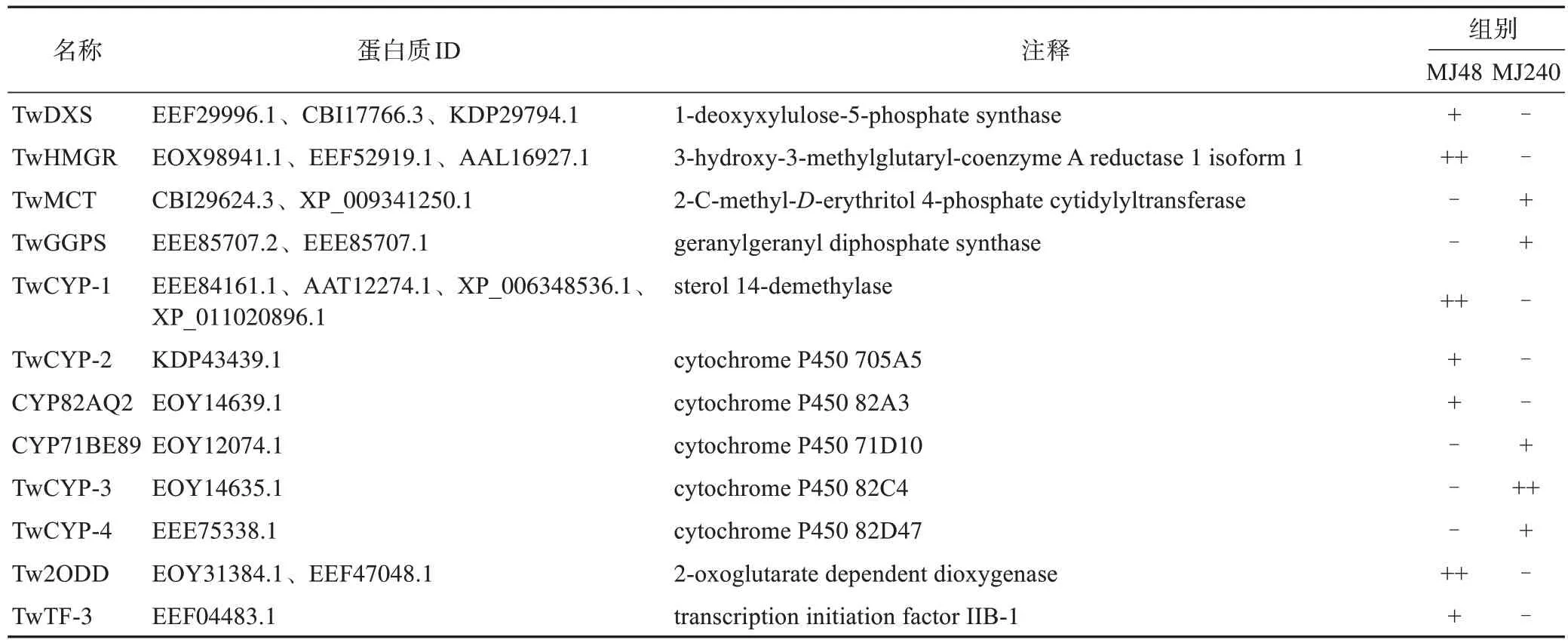
表5 仅MJ48或MJ240组中蛋白质信息
3.7 候选基因植物体内功能表征
为了研究基因功能,选择了与雷公藤甲素生物合成二萜合酶基因TwTPS7v2、TwTPS9v2和TwTPS27v2表达模式(图6C)一致的基因作为候选基因,均表现为MeJA 诱导早期基因表达上调[7],通过植物体内功能表征观察其对雷公藤甲素生物合成的影响。克隆获得了长度为590 bp的TwTF1、1640 bp的TwTF2、1734 bp 的CYP82AQ2、1620 bp 的CYP71BE89和1255 bp 的Tw2ODD。使用Gateway 分别构建含目的基因特异性片段TwTF1(460 bp)、TwTF2(477 bp)、CYP82AQ2(453 bp)、CYP71BE89(491 bp)、Tw2ODD(503 bp)的RNAi 载体,基因枪介导转化雷公藤悬浮细胞。各转化组样品中均检测到1397 bp的载体片段,而未转化质粒的对照组相应位置无条带(图7A),验证了基因成功转入到悬浮细胞中。
基因干扰后,CYP82AQ2-RNAi组、CYP71BE89-RNAi 组、Tw2ODD-RNAi 组基因表达量较WT 组和空载组有明显抑制(P<0.05,P<0.01),抑制率分别为33.4%、28.5%和77.9%;TwTF1-RNAi 组、TwTF2-RNAi组与对照组差异无统计学意义,见图7B。同时,各组基因干扰后雷公藤甲素的含量表现不同程度降低。WT 组、pK7GWIWG2D 组、TwTF1-RNAi 组、TwTF2-RNAi组、CYP82AQ2-RNAi组、CYP71BE89-RNAi和Tw2ODD-RNAi组雷公藤甲素质量分数分别为(42.3±2.9)、(38.6±1.9)、(32.9±3.1)、(37.5±12.8)、(24.8±4.3)、(32.1±1.4)、(12.1±3.0)μg·g–1。与WT 和pK7GWIWG2D 对照相比,CYP82AQ2-RNAi、CYP71BE89-RNAi和Tw2ODD-RNAi组中雷公藤甲素含量差异有统计学意义(P<0.01),抑制率分别为41.4%、24.1%和71.4%;TwTF1-RNAi 和TwTF2-RNAi 差异无统计学意义(图7C)。由此说明,CYP82AQ2、CYP71BE89和Tw2ODD的 转录表达 下调,直接抑制了雷公藤甲素的积累,表明这3 条基因与雷公藤甲素生物合成具有直接相关性。
4 讨论
雷公藤甲素是雷公藤的主要活性成分之一,其能够与着色性干皮病B(XPB,一种TFIIH亚族)结合从而抑制ATPase的活性[14],并促使RNAPⅡCDK7退化发挥抗肿瘤的作用[15],随着药理作用的不断发现而受到越来越多的关注[2]。针对雷公藤甲素生物合成途径仍未知的问题,本研究借助比较蛋白质组学寻找雷公藤甲素生物合成相关的蛋白质。
蛋白质作为基因功能的执行者,参与多种生命活动,而单纯从基因和mRNA层面无法解释其复杂的翻译后修饰、蛋白质间相互作用等过程。因此直接从蛋白质层面研究蛋白质组学受到越来越多的关注。蛋白质组的出现使研究转向mRNA和蛋白质丰度,研究不同的基因表达如何调节蛋白质功能[16]。由于需要一系列的过程产生和维持细胞功能,包括生成转录组、加工和降解mRNA、翻译、定位、修饰和凋亡自身蛋白质,可以用蛋白质丰度反映这些过程的动态平衡。蛋白质组学为蛋白质丰度的研究提供了可能,这种蛋白质层面的研究可以说明不同方面的基因表达如何调节细胞蛋白质丰度。现有数据证实,mRNA生成之后的后转录、翻译和蛋白质降解调节都是为了保证蛋白质丰度的稳定状态[16]。本研究利用比较蛋白质组学研究重在找出有意义的差异蛋白质,因而具有更好的可实现性。
MeJA是植物中的一种重要物质,其可以扩散到植物的其他部位,影响植物的系统信号传导,激活参与次生代谢的基因表达,增加萜类、类黄酮和生物碱的含量[17]。Miller 等[18]使用MeJA 处理云杉并持续4 d 监测萜类挥发物,发现萜类化合物在处理后45 h 显著增加。本研究比较分析了MeJA 诱导48、240 h的雷公藤悬浮细胞蛋白质组学数据,结果表明MeJA可以促进萜类化合物的积累和基因表达,并在MeJA 诱导下的雷公藤甲素积累曲线中得到了证实(图1)。借助生物信息学,从376个差异蛋白质中初步筛选出了20 个可能与雷公藤甲素生物合成有关的蛋白质。进一步的转录表达分析和植物细胞体内RNAi 结果聚焦于3 个蛋白质(1 个Tw2ODD 和2 个CYPs)。基因表达与雷公藤甲素在植物不同组织中的积累规律一致,也表明CYP71BE89、CYP82AQ2和Tw2ODD与雷公藤甲素生物合成的相关性。
CYP71BE89 属于CYP71BE 亚家族,文献报道雷公藤基因组中可能存在CYP71BE家族基因扩张[9],同时,CYP71BE85 和CYP71BE86 被报道参与同构型松香烷型二萜雷公藤内酯酮的生物合成。此外,该亚家族中部分CYP 的功能在其他物种已被鉴定。CYP71BE5 作为α-愈创木烯-2-氧化酶,能氧化α-愈创木烯(倍半萜烯烃)的C-2 位生成化合物 (–)-莎草奥酮[19]。CYP71BE52在丹参中催化铁锈醇C-2α位氧化为鼠尾草酚[20]。CYP71BE54促进 (–)-脱氧鬼臼毒素的去甲基化,形成 (–)-4′-去甲基脱氧鬼臼毒素[21]。CYP82AQ2 比CYP82 家族中的其他蛋白质更接近CYP82A 和CYP82D 亚家族,是CYP82AQ 亚家族中的第二个酶,有待进一步的探究。而Tw2ODD是本课题组此前报道的赤霉素13 位氧化酶[22],可催化活性赤霉素相互转化,从蛋白质互作和生理水平影响雷公藤甲素的生物合成。
因此,本研究利用蛋白质组学技术研究了受MeJA 诱导的雷公藤悬浮细胞中蛋白质的变化情况,利用萜类骨架基因验证了数据的准确性,并揭示了后期可用于进一步基因功能表征的候选基因。
[利益冲突]本文不存在任何利益冲突。

