基于抗氧化谱效关系的肉苁蓉质量标志物研究△
李莹曼,宋紫腾,侯淇允,张林林,许浚,4*,张铁军*
1.天津中医药大学,天津 301617;2.天津药物研究院 天津市中药质量标志物重点实验室,天津 300462;3.天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300462;4.中国中药协会 药食同源物质评价和利用专业委员会,北京 100061
肉苁蓉是列当科肉苁蓉属植物肉苁蓉Cistanche deserticolaY.C.Ma 或管花肉苁蓉C.tubulosa(Schenk) Wight的干燥带鳞叶的肉质茎,始载于《神农本草经》,列为上品[1]。其性温,味甘、咸,归肾、大肠经,具有补肾阳、益精血、润肠通便的功效,为补肾填精之要药[2-3]。肾主藏精,精血同源,若精血亏虚则影响人体的整体生命活动;精生髓藏于骨,脑为髓海,若肾精不足,则骨失所养、脑海亏虚,导致骨质疏松、牙齿脱落、记忆力减退、痴呆、免疫功能下降等退行性变化[4-6]。肉苁蓉含有苯乙醇苷类、环烯醚萜类、木脂素类等多种结构类型成分,包括松果菊苷、毛蕊花糖苷、异毛蕊花糖苷、京尼平苷酸、8-表马钱子酸、管花苷A 等[7],目前《中华人民共和国药典》2020 年版对肉苁蓉的质量控制仅规定了松果菊苷和毛蕊花糖苷的含量,不能完全体现中药多成分、多靶点的作用特点,不利于其质量控制和评价。
为提升中药质量控制水平,优化中药质量评价,刘昌孝院士提出中药质量标志物(Q-marker)的新概念[8]。其中“有效性”是Q-marker“五原则”中的核心要素[9],也是中药质量评价的核心。针对质量标准与药效相关性较差的研究现状,挖掘中药的Qmarker,建立更科学合理的质量标准,对中药的质量提升具有重大意义。谱效关系是将中药指纹色谱峰与特定的药效学数据联系起来,寻找中药的有效物质,以此反映中药的内在质量[10]。建立谱效数学模型能够从“整体观”角度阐明中药的Q-marker,为后期的中药质量控制、质量标准的制定和有效成分的筛选提供更多参考。本研究采用指纹图谱结合活性氧自由基(ROS)半数抑制浓度(IC50)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的含量开展中药谱效关系的研究,运用主成分分析(PCA)、皮尔逊相关性分析(PCC)和偏最小二乘法-回归分析(PLS)综合分析肉苁蓉的Q-marker,为其质量控制提供依据。
1 材料
1.1 样品
肉苁蓉采收自新疆维吾尔自治区于田县和内蒙古肉苁蓉良好农业规范(GAP)种植基地,经天津药物研究院有限公司张铁军研究员鉴定为管花肉苁蓉Cistanche tubulosa(Schenk) Wight 和肉苁蓉C.deserticolaY.C.Ma,具体信息见表1。

表1 肉苁蓉药材产地及批号
1.2 试药
对照品松果菊苷(批号:111670-201907,纯度:91.8%)、毛蕊花糖苷(批号:111530-201914,纯度:95.2%)均购自中国食品药品检定研究院;异毛蕊花糖苷(批号:61303-13-7)、红景天苷(批号:10338-51-9)、8-表马钱子酸(批号:82509-41-9)、京尼平苷酸(批号:Z24A10X95926)、管花苷B(批号:112516-04-08)、2-乙酰基洋丁香酚苷(批号:94492-24-7)均购自上海源叶生物科技有限公司,纯度≥98%;肉苁蓉苷A(批号:MUST-20062806,纯度:98.51%)、管花苷A(批号:MUST-19110102,纯度:98.57%)均购自成都曼思特生物科技有限公司;色谱纯乙腈、甲酸均购自天津市康科德科技有限公司;纯净水(杭州娃哈哈集团有限公司);维生素E(VE,北京Solarbio 公司);二甲基亚砜(DMSO,美国Sigma 公司);CellTiter 96®AQueous 单溶液细胞增殖检测试剂盒(G3580,美国Promega 公司);CAT 检测试剂盒(S0051)、SOD 活性检测试剂盒(S0101M)、ROS 检测试剂盒(S0033S)均购自上海碧云天生物技术有限公司。
1.3 仪器
H-class-PDA 型超高效液相色谱仪(美国Waters公司);Sartorius BT25S 型电子天平(德国赛多利斯公司);H1650 型高速台式离心机(湖南湘仪实验室仪器开发有限公司);SpectraMax M5 型酶标仪(美谷分子仪器有限公司);WYS-41XDY 型生物显微镜(天津微仪光学仪器有限公司)。
1.4 细胞
人胚肾细胞HEK293 细胞购自中国科学院细胞库。
2 方法
2.1 指纹图谱的建立
2.1.1 供试品溶液的制备 称取肉苁蓉药材2 g,加10倍量水,加热回流3次,每次1 h,1.0×105r·min–1离心15 min(离心半径为300 mm),合并上清液,浓缩,制成质量浓度100 mg·mL–1母液,稀释10倍,0.22 µm微孔滤膜滤过,即得。
2.1.2 混合对照品溶液的制备 分别取8-表马钱子酸、红景天苷、松果菊苷、肉苁蓉苷A、京尼平苷酸、毛蕊花糖苷、管花苷A、异毛蕊花糖苷、2′-乙酰基洋丁香酚苷、管花苷B 对照品适量,精密称定,加入50%甲醇溶液使溶解,制备成质量浓度为20 µg·mL–1的混合对照品溶液。
2.1.3 色谱条件 ACQUITY UPLC® BEH C18色谱柱(100 mm×2.1 mm,1.7 µm);流动相为乙腈(A)-0.1%甲酸溶液(B),梯度洗脱(0~6 min,5%~8%A;6~10 min,8%~15%A;10~13 min,15%~19%A,13~20 min,19%~25%A);检测波长为237 nm;流速为0.4 mL·min–1;柱温为40 °C;进样量为3 µL。
2.1.4 参照峰的选择 在肉苁蓉超高效液相色谱法(UPLC)色谱图中,选择峰面积占比最大、保留时间适中且具有良好的分离度的峰作为指纹图谱的参照峰。
2.1.5 方法学考察 精密度试验:取T1 样品按2.1.1 项下方法制备供试品溶液,连续进样6 次,记录指纹图谱,结果显示各峰相对峰面积RSD 为0.10%~4.61%,相对保留时间的RSD 为0.08%~1.32%,表明仪器精密度良好。
重复性试验:取T1 样品按2.1.1 项下方法平行制备6 份供试品溶液,连续进样。结果显示各色谱峰的相对峰面积RSD为1.35%~4.80%,相对保留时间RSD为0.10%~1.80%,符合指纹图谱的要求,表明仪器的重复性良好。
稳定性试验:取T1 样品按2.1.1 项下方法制备供试品溶液,分别在0、2、4、8、12 h 进样检测,记录指纹图谱。计算各色谱峰相对峰面积RSD 为0.53%~4.82%,相对保留时间的RSD 为0.09%~2.17%,符合指纹图谱的要求,表明供试品在12 h内稳定。
2.2 肉苁蓉抗氧化作用的研究
2.2.1 肉苁蓉母液的制备 取2.1.1 项下母液,滤过除菌,临用时用培养基稀释至所需浓度即可。
2.2.2 肉苁蓉对HEK293 细胞活力的影响 设置正常组(细胞悬液)、肉苁蓉给药组(25、50、100、200、400 µg·mL–1),每个质量浓度设置6 个复孔,培养24 h,每孔加入CellTiter 96® AQueous 单溶液试剂20 µL 检测细胞存活率,继续培养2 h,使用酶标仪检测490 nm 下各孔吸光度(A),按公式(1)计算细胞存活率(%)。
2.2.3 肉苁蓉对H2O2诱导HEK293 细胞的ROS 的影响 将细胞分为正常组(细胞悬液)、肉苁蓉给药组(6.25、12.50、25.00、50.00、100.00 µg·mL–1肉苁蓉和60 µm·L–1H2O2),培养24 h。按照ROS 检测试剂盒操作步骤进行后续操作,通过显微镜直接观察细胞染色情况,并使用酶标仪检测各组荧光强度。参数设置使用488 nm 激发波长,525 nm 发射波长。实验重复3次。
2.2.4 肉苁蓉对H2O2诱导HEK293 细胞的SOD 的影响 将细胞分为正常组(细胞悬液)、模型组(60 µm·L–1H2O2)、VE组(60 µm·L–1VE和60 µm·L–1H2O2)、肉苁蓉给药组(100 µg·mL–1肉苁蓉和60 µm·L–1H2O2),培养24 h 后收集细胞,加SOD 样品制备液裂解细胞,4 ℃、12 000 r·min-1离心5 min(离心半径为300 mm),取上清液作为待测样品,按照SOD 检测试剂盒操作步骤进行后续操作。实验重复3次。
2.2.5 肉苁蓉对H2O2诱导HEK293细胞的CAT的影响 按2.2.4 项下方法及分组给药处理后加入裂解液,4 ℃、12 000 r·min–1离心10 min(离心半径为300 mm),取上清,按照CAT 检测试剂盒操作步骤进行后续操作。实验重复3次。
2.2.6 统计学分析 采用SPSS 26.0 软件进行统计学分析,各组数据均以(±s)表示,对符合正态分布的数据进行单因素方差分析,如果方差齐,采用Least-Significant Difference法,如果方差不齐,采用Dunnett′s T3 法。使用GraphPad Prism 8 作图,以P<0.05为差异有统计学意义。
2.3 肉苁蓉抗氧化的谱-效关联分析
2.3.1 PCA 将已建立指纹图谱的10 批肉苁蓉共有峰的峰面积进行Z值标准化处理,制作成10×17阶数据矩阵,将其导入SPSS 26.0软件进行PCA。
2.3.2 PCC 运用SPSS 26.0 进行双变量分析,研究肉苁蓉指纹图谱与抗氧化之间的谱效关系,显著性检测采用双侧检验(T)以P<0.05 为差异具有统计学意义的标准。
2.3.3 PLS 将肉苁蓉标准化峰面积和抗氧化的实验结果导入SIMCA-P 14.1 软件,将峰面积设为X变量,药效指标设为Y变量,进行PLS。
2.4 肉苁蓉Q-marker抗氧化活性验证
2.4.1 活性成分母液的制备 精密称定京尼平苷酸、8-表马钱子酸、松果菊苷、毛蕊花糖苷、异毛蕊花糖苷、管花苷A 适量,分别加入DMSO 使其溶解成10 mmol·L–1的对照品溶液。
2.4.2 活性成分对HEK293 细胞毒性的影响 将HEK293细胞孵育24 h后,每孔分别加入不同浓度的2.4.1 项下活性成分溶液(0.781、1.563、3.125、6.250、12.500、25.000、50.000、100.000 µmol·L–1)100 µL,持续刺激细胞24 h 后加入CellTiter 96®AQueous单溶液试剂检测细胞存活率。
2.4.3 活性成分对H2O2诱导HEK293 细胞的抗氧化损伤作用 细胞分组如下:正常组、模型组、VE组同2.2.4项下分组,实验组(0.781、1.563、3.125 µm·L–1活性成分和60 µm·L–1H2O2),培养24 h。分别按2.2.3、2.2.4、2.2.5 项下方法测定细胞内ROS 水平、SOD和CAT含量。
3 结果
3.1 指纹图谱的建立
按2.1 项下方法制备10 批供试品溶液,采用2.2 项下的色谱条件进行检测,获得各批次样品的指纹图谱(图1),选择11 号峰(C11)作为指纹图谱的参照峰。将肉苁蓉供试品指纹图谱的液相数据.AIA文件导入“中药色谱指纹图谱相似度评价系统”(2012 版)。在共有模式下标定了17 个共有色谱峰,与混合对照品图谱(图2)比对,共指认出10个共有峰。

图1 10批肉苁蓉UPLC指纹图谱

图2 10批肉苁蓉共有色谱峰的指认图谱
3.2 肉苁蓉抗氧化作用的研究
3.2.1 肉苁蓉对HEK293 细胞活力的影响 与正常组细胞相比,肉苁蓉质量浓度为50~100 µg·mL–1时未产生细胞毒性,细胞存活率均大于90%。随着肉苁蓉的质量浓度的增加,细胞活力随之下降。因此,后续实验选择质量浓度为100 µg·mL–1的肉苁蓉给药。
3.2.2 肉苁蓉对H2O2诱导HEK293 细胞的ROS 的影响 通过GraphPad Prism 8软件计算肉苁蓉在不同浓度下的ROS IC50,结果见图3、表2。
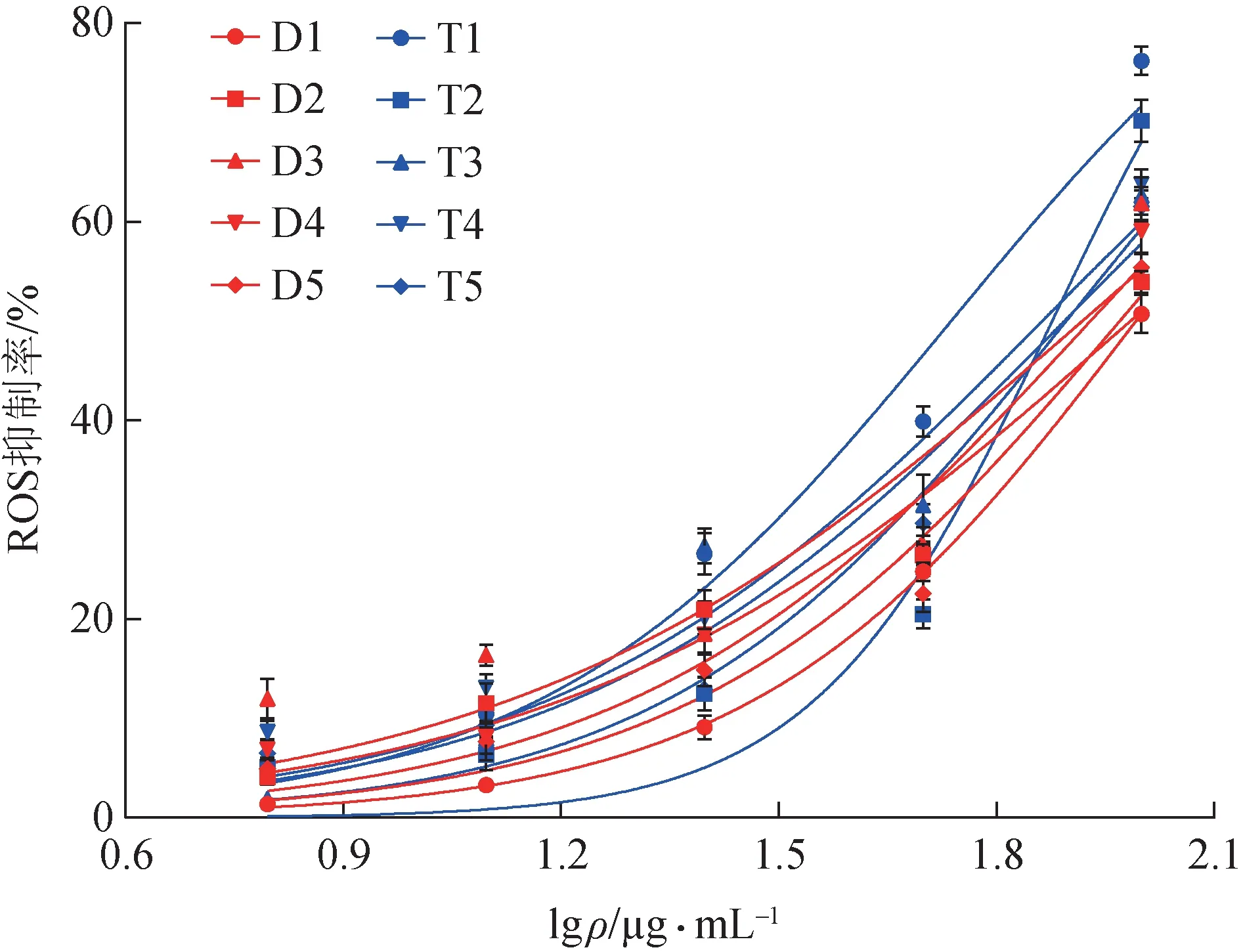
图3 10批肉苁蓉对ROS抑制率曲线(±s,n=6)

表2 10批肉苁蓉对ROS的IC50数据 µg·mL–1
3.2.3 肉苁蓉对H2O2诱导HEK293 细胞的SOD 的影响 如图4 所示,与正常组相比,模型组细胞中SOD 活性显著降低,肉苁蓉给药组SOD 活性均有不同程度的升高(P<0.001),说明肉苁蓉可以提高胞内SOD酶活力。

图4 10批肉苁蓉对HEK293细胞氧化损伤后SOD含量的影响(±s,n=6)
3.2.4 肉苁蓉对H2O2诱导HEK293细胞的CAT的影响 如图5 所示,H2O2可导致细胞内CAT 酶活性显著下降(P<0.001),活力仅达到正常组的30%,说明H2O2严重损伤了细胞的抗氧化系统,肉苁蓉给药后,细胞内CAT酶活力明显升高(P<0.001)。

图5 10批肉苁蓉对HEK293细胞氧化损伤后CAT含量的影响(±s,n=6)
3.3 基于谱效关联分析的肉苁蓉Q-marker筛选
3.3.1 PCA 以特征值>1 和累积方差贡献率>85%为标准,提取得到4个主成分,其中前3个主成分的碎石图(图6)曲线较陡,代表其方差贡献率较大。4 个主成分的累积方差贡献率为87.640%,表明这4个主成分可以代表原有变量87.640%的信息。初始特征值和方差贡献率见表3。

图6 10批肉苁蓉的PCA碎石图

表3 10批肉苁蓉4个主成分的PCA特征值和方差贡献率
用凯撒正态化最大方差法处理得到旋转成分矩阵,见表4。根据各色谱峰在4 个主成分上的载荷值,可提取出每个主成分所反映的信息,即载荷值越大,说明该色谱峰对该主成分的影响越大。在主成分1 中,峰1~3、5、7、11、13~15 的载荷绝对值最大;在主成分2 中,峰6、16 的载荷绝对值最大;峰17解释主成分3的信息,峰8对主成分4的影响最大,因此选择峰1~3、5~8、11、13~17 这13 个化学成分作为肉苁蓉的主要物质基础,进行后续的谱效分析。

表4 10批肉苁蓉的PCA因子载荷矩阵
3.3.2 PCC ROS IC50为药效负向指标,因此相关系数为负则代表因变量与药效呈正相关,肉苁蓉的13 个色谱峰相关系数均为负,说明都与清除ROS IC50呈正相关,其中峰14、3、7、11、1、13 与ROS IC50呈极强相关(P<0.01),峰2、5、15 呈强相关(P<0.05);13个色谱峰均与SOD呈正相关,其中峰13、3、15、11、2 与SOD 呈极强相关(P<0.01),峰1、14、7、5、6 呈强相关(P<0.05);有11 个峰与CAT 呈正相关,峰5 与CAT 呈强相关(P<0.05)。结果见表5。

表5 肉苁蓉抗氧化Pearson相关系数
结合ROS IC50、SOD、CAT 的PCC 结果,选择峰1~3、5、7、11、13~15 作为肉苁蓉发挥抗氧化作用的活性成分群。
3.3.3 PLS 在PLS 中,13 个色谱峰的ROS IC50回归系数均为负,与药效活性呈正相关,其中VIP值>1的色谱峰依次为14、3、11、1、7、13、2、5、15(图7A);在SOD 酶活力研究中,所有峰的系数为正,即所有峰与药效呈正相关,其中VIP 值>1 的色谱峰依次为13、3、15、11、2、1、14、7(图7B);在CAT 酶活力研究中,除峰6、16 外,其余色谱峰均与药效呈正相关,其中VIP值>1的色谱峰依次为:5、13、14、11、7(图7C)。筛选出峰1~3、5、7、11、13~15 所代表的化合物为PLS 模型中潜在的抗氧化活性成分。

图7 10批肉苁蓉的抗氧化PLS(±s,n=6)
3.4 肉苁蓉Q-marker活性验证
3.4.1 活性成分对HEK293 细胞毒性的影响 根据谱效关联分析的结果,选择京尼平苷酸、8-表马钱子酸、松果菊苷、毛蕊花糖苷、管花苷A、异毛蕊花糖苷6个成分进行活性验证。肉苁蓉6个活性成分浓度在0.781~3.125 µmol·L–1时未出现细胞毒性,细胞存活率均大于90%。随着浓度增加,细胞活力受到抑制。因此,后续给药浓度选择0.781、1.563、3.125 µmol·L–1。
3.4.2 活性成分对H2O2诱导HEK293 细胞的抗氧化损伤作用 通过检测各活性成分对细胞内ROS 的清除作用和SOD、CAT 酶活力的调控能力来验证其是否具有抗氧化的作用。在ROS 清除实验中,京尼平苷酸的中、高剂量组与模型组相比差异有统计学意义(P<0.01,P<0.001,图8A),8-表马钱子酸、松果菊苷、管花苷A、毛蕊花糖苷、异毛蕊花糖苷的低、中、高剂量组与模型组相比差异均有统计学意义(P<0.001,图8B、图8C),说明6个单体均有一定程度的清除ROS的作用;在SOD和CAT酶活力测定实验中,活性成分的低、中、高剂量组的酶活力均比模型组高,说明6 个单体均能提高SOD 和CAT酶活力。

图8 肉苁蓉活性成分对H2O2诱导HEK293细胞的抗氧化损伤的影响(±s,n=6)
4 讨论
本研究对乙腈-水、乙腈-0.1%甲酸水、0.1%甲酸乙腈-0.1%甲酸水3个流动相进行了考察,当选择乙腈-0.1%甲酸水时,峰形较好、分离效果最佳、基线较平稳,最终采用乙腈-0.1%甲酸水作为流动相。考察了在不同流速(0.2、0.3、0.4 mL·min–1)下色谱峰的分离效果,在流速为0.4 mL·min–1的条件下,各色谱峰分离度较好,出峰时间适中。考察了色谱柱在35、40、45 ℃下的分离效果,结果表明3 个柱温条件下,指纹图谱分离效果相近,为了便于实验条件控制,最终将柱温设为40 ℃。使用光电二极管阵列(DAD)检测器在190~400 nm 范围内扫描肉苁蓉3D 指纹图谱,在237 nm 波长下呈现的峰信息量大,基线较平稳,因此选择237 nm 为检测波长。最终确定了最佳色谱条件,建立了一种简单、可靠的指纹图谱方法,峰容量更大,分离效果更好。
现代研究发现通过提高机体的抗氧化能力可以有效缓解肾虚病症[11-14],课题组前期通过线虫实验发现肉苁蓉可以延长线虫寿命,提高运动能力,降低脂褐素水平,其作用机制可能是通过提高SOD、CAT 酶活力,降低ROS 水平,抵抗氧化损伤延缓衰老[15]。细胞内的ROS 水平是反映细胞氧化损伤程度的一个重要标志[16],H2O2是一种膜易透性强氧化剂,可通过增加细胞内的ROS 造成细胞氧化损伤。因此,本研究采用H2O2制备HEK293 细胞氧化损伤模型;SOD 是ROS 自由基清除酶系统中最关键的生物酶,在超氧化物歧化为氧和过氧化氢的过程中起催化剂的作用,从而减少ROS 的合成和氧化应激[17];CAT 是最关键的H2O2清除酶,也是ROS 清除酶系统中的主要生物酶之一[18]。基于此,本研究采用H2O2制备HEK293 细胞氧化损伤模型,分别以ROS IC50、SOD 和CAT 的含量作为药效指标综合评价肉苁蓉的抗氧化作用。
本研究通过建立谱效关系分析肉苁蓉的活性成分,由于各种数学统计模型都存在一定缺陷,发展多种数据分析技术联用及交叉验证是有必要的。PCA 是一种运用降维思想的数据统计方法,可提取出携带大量原始变量信息的主成分;PCC 可以描述两变量间线性关系的密切程度、相关性大小及方向;PLS 分析集成了多元线性回归、PCA 和典型相关分析的优点,是一种模型拟合度好、预测能力强的数据处理方法[19]。因此,本研究首先通过PCA 对数据降维处理,提高谱效关系研究结果的科学性与准确性[20]。再选用PCC 结合PLS 筛选肉苁蓉的抗氧化活性成分,两种检测方法得到的检测结果基本一致,共筛选出9个活性成分,其中有6个成分已用对照品指认,课题组运用液质联用技术对其中3 个未知成分进行表征,鉴定色谱峰C2、C3为8-表马钱子酸异构体,C7为紫葳新苷Ⅱ异构体,故后续活性验证中只考察了京尼平苷酸、8-表马钱子酸、松果菊苷、管花苷A、毛蕊花糖苷、异毛蕊花糖苷6个成分,通过单体活性试验,验证了这6个成分均具有抗氧化活性。
从质量传递与溯源的角度,药物经吸收入血后的效应成分才是质量传递体系的最终环节,也是Qmarker 确定的重要依据。Li 等[21]应用超高效液相色谱飞行时间质谱法(UPLC-Q-TOF-MS)探索肉苁蓉在大鼠体内的代谢产物,发现松果菊苷、毛蕊花糖苷、异毛蕊花糖苷、管花苷A 的原型及代谢产物。刘悦[22]研究了肉苁蓉总苷在体内的作用过程,在入血成分中鉴定出8-表马钱子酸和京尼平苷酸的代谢产物,在肝匀浆中鉴定出8-表马钱子酸的原型及代谢产物。环烯醚萜类化合物可以降低机体氧化应激作用[23],其中京尼平苷酸通过激活丝氨酸/苏氨酸蛋白激酶/核转录因子E2 相关因子2/8-羟基鸟嘌呤DNA 糖苷酶修复酶(Akt/Nrf2/OGG1)途径减轻H2O2诱导的HaCaT 细胞中的氧化应激[24]。松果菊苷可以降低心肌细胞的ROS,从而提高线粒体膜电位,减少mtDNA、蛋白质和脂质的氧化损伤,有效抑制线粒体氧化损伤,减少体外和体内细胞凋亡[25]。毛蕊花糖苷和异毛蕊花糖苷对自由基带来的氧化损伤具有强烈的保护作用,前者还可以改善D-半乳糖诱导的衰老小鼠的空间学习和记忆能力,抑制糖羰基化,增加谷胱甘肽过氧化物酶的活性,降低衰老相关酶胺氧化酶的活性来减少氧化应激[26]。管花苷A具有自由基清除活性,对大鼠肝微粒体脂质过氧化的抑制作用显著[27-28]。现代研究表明,上述成分可能是肉苁蓉抗氧化的主要活性成分,为本研究筛选的Q-marker的真实性提供了有效依据。
综上所述,本研究采用指纹图谱结合多种数据统计方法构建谱效关系,对肉苁蓉抗氧化的Qmarker 进行预测分析,初步确认了京尼平苷酸、8-表马钱子酸、松果菊苷、毛蕊花糖苷、异毛蕊花糖苷、管花苷A 为肉苁蓉抗氧化的Q-marker,为肉苁蓉质量标准的完善及药效物质的进一步阐明提供科学依据。
[利益冲突]本文不存在任何利益冲突。

