基于“性-效-物”的小儿消积止咳口服液质量标志物研究△
宋紫腾,吴美琪,韩彦琪,许浚*,张铁军*
1.天津药物研究院 天津市中药质量标志物重点实验室/中药现代制剂与质量控制技术国家地方联合工程实验室/药物成药性评价与系统转化全国重点实验室,天津 300462;2.和光中药科技(天津)有限公司,天津 300462;3.沈阳药科大学 中药资源教研室,辽宁 沈阳 110016
小儿消积止咳口服液(以下简称XEXJ)收载于《中华人民共和国药典》(以下简称《中国药典》)2020 年版(一部),由炒山楂、槟榔、枳实、蜜枇杷叶等10 味中药组成,具有清热肃肺、消积止咳的功效,临床用于小儿饮食积滞、痰热蕴肺所致的咳嗽、喉间痰鸣、腹胀、口臭等症状[1]。XEXJ 是依据“食积咳嗽”论治理论研制的儿科用中药制剂[2],临床研究证实其疗效确切[3]。由于XEXJ 药效成分复杂,物质基础研究相对较少,限制了其有效性和安全性评价。
刘昌孝等[4]在2016 年提出了中药质量标志物(Q-marker)这一概念,其核心内容基于特有性、可测性、有效性、传递性和中医药理论关联性的五要素,其中有效性是Q-marker 的核心内容,包括药性与药效两方面,可反映中药有效性的本质特征。将药性和药效均纳入中药质量评价,能够反映中药质量的完整性。以“性-效-物”的思路发现Q-marker,为建立更科学的质量控制方法提供了新的思路[5]。本研究在本课题组前期对XEXJ化学物质组辨识与表征研究的基础上,基于“性-效-物”三元论,利用计算机模拟、网络药理学、G蛋白偶联受体和酶抑制活性检测等方法,探究并确定其Q-marker,以期为其质量标准提升和药效作用机制的系统阐释提供参考。
1 材料
1.1 仪器
CKX41SF 型倒置显微镜(Olympus 公司);Penta 型高通量实时荧光检测分析系统(FLIPR)、SpectraMax M5 型多功能酶标仪均购于Molecular Devices 公司;ECHO550 型纳升级声波移液系统(Labcyte 公司);ENVISION 型多功能酶标仪(Perkin Elmer 公司);DK-600 型电热恒温水槽(上海精宏实验设备有限公司)。
1.2 试药
DMEM/F12 培养基(批号:10565-018)、DMEM 培养基(批号:11965-084)、Hank's 平衡盐溶液(HBSS,批号:14025-092)、4-(2-羟乙基)-1-哌嗪乙磺酸溶液(HEPES,批号:15630-080)均购自Gibco 公司;胎牛血清(FBS,批号:FB-1058/500)、透析的胎牛血清(DFBS,批号:04-011-1A)均购自Biosera 公司;遗传霉素(批号:ant-gn-5,InvivoGen公司);二甲亚砜(DMSO,批号:34869-L)、卡巴胆碱(批号:1092009)、肾上腺素(批号:E4642)、WB4101(批号:B018)均购自Sigma公司;FLIPR®钙4 实验试剂盒(批号:R8141,Molecular Devices 公司);异丙肾上腺素(批号:HY-B0468,MCE公司);3-异丁基-1-甲基黄嘌呤(IBMX,批号:410957,CabioChem公司);环磷酸腺苷(cAMP)检测试剂盒(批号:264,PerkinElmer 公司);环氧合酶-2(COX-2)抑制剂筛选试剂盒(批号:S0168,上海碧云天生物技术有限公司)。
XEXJ(批号:304200133,山东鲁南厚普制药有限公司);对照品芦丁(批号:100080-200707)、连翘酯苷A(批号:111810-201707)、金丝桃苷(批号:111521-201205)、槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷(批号:111854-201905)、异槲皮苷(批号:111809-201403)、柚皮苷(批号:110722-201815)、枸橼酸(批号:100396-201603)、绿原酸(批号:110753-200413)、氢溴酸槟榔碱(批号:111684-202003)、桔梗皂苷D(批号:111851-201708)、芥子碱硫氰酸盐(批号:111702-202006)、3,29-二苯甲酰基栝楼仁三醇(批号:111931-201804)、松脂醇二葡萄糖苷(批号:111537-201706)均购自中国食品药品检定研究院;橙皮苷(批号:P06D9F77001)、槲皮苷(批号:P19D10F106420)、去甲基川陈皮素(批号:W15A10Z95342)、连翘脂素(批号:Z04J9X62808)均购自上海源叶生物科技有限公司;连翘酯苷B(批号:ps10061801,成都普思生物科技有限公司);新橙皮苷(批号:MUST-17040707)、芸香柚皮苷(批号:MUST-17030408)、辛弗林(批号:MUST-14082611)、松脂素-β-D-吡喃葡萄糖苷(批号:MUST-16011707)、山柰酚(批号:MUST-20082818)均购自成都曼斯特生物科技有限公司;连翘苷(批号:140118,成都普菲得生物技术有限公司)。
1.3 细胞
CHO-K1/M3 稳定细胞株、HEK293/β2 稳定细胞株、CHO-K1/α1A 稳定细胞株均购自ChemPartner公司。
2 方法
2.1 分子对接
2.1.1 配体小分子库的建立 基于以下原则建立小分子库,分别与酸、甘、苦、辛受体进行对接实验:1)根据《中国药典》2020 年版[1]的性味归经将各单味药按照性味分类,见表1。2)基于本课题组前期对XEXJ 化学物质组辨识结果[6],选择药味中具有代表性的单体成分进行实验,所有化合物具体信息见增强出版附加材料。从不同药味的药材中分别选取了42、33、74、61个小分子,建立酸、甘、苦、辛配体小分子库,小分子库具体信息见增强出版附加材料。

表1 基于药味的XEXJ中单味药归类
2.1.2 化合物与味觉受体的分子对接验证 从Protein Data Bank 数据库(https://www.wwpdb.org/)中下载酸(6D1W)、甘(5X2M)受体的结晶复合物,同时利用同源模建的方法构建苦味受体(TAS2R10)和嗅觉受体(OR7D4)的三维结构。将受体依次导入Schrödinger 2020 Maestro 12.4,通过Protein Preparation Wizard 进行受体预处理,在电场力OPLS3e 的条件下,对受体蛋白进行能量最小化处理,应用Binding Site Detection 计算可能的活性空腔,通过Receptor Grid Generation 生成受体格点文件。准备化合物的.sdf 格式文件,导入Schrödinger 2020 Maestro 12.4 软件中,通过Ligprep 进行配体预处理,在Ligand Docking 中选择第一步生成的受体格点文件,与处理后的化合物进行分子对接。
2.2 网络药理学分析
2.2.1 目标化合物的选取及靶点筛选 根据化学物质组和分子对接结果选取了黄酮、三萜、生物碱、苯乙醇苷、木脂、有机酸等类的32 个化学成分为研究对象(表2)。应用Chem Office 2019 绘制化合物结构式并保存为.sdf格式,登录SwissTargetPrediction(http://new.swisstargetprediction.ch/)和Pharm Mapper(http://www.lilab-ecust.cn/pharmmapper/)服务器,导入化合物的.sdf 文件,采用反向药效团匹配方法得到虚拟匹配筛选结果。在中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)检索,获取化合物相关靶点信息。整合3 个数据库靶点结果,得到化合物潜在作用靶点库。
2.2.2 疾病靶点的预测分析 登录GeneCards 数据库,依次检索关键词“dyspepsia”“cough”“respiratory tract inflammation”“fever”,下载对应文件并整理得到疾病靶点数据库。再将2.2.1 项下化合物的作用靶点与疾病靶点取交集,得到药物疾病共有靶点,通过Bioinformatics &Evolutionary Genomics 在线制图软件实现数据可视化。
2.2.3 构建蛋白质-蛋白质相互作用(PPI)网络及筛选关键蛋白靶点 将交集靶点导入STRING 11 数据库(http://string-db.org/)中,获得PPI 网络,结果导入Cytoscape 3.8.0 软件中,以度(degree)值调整节点大小和颜色深浅,获得化合物与疾病靶点的PPI网络。
2.2.4 通路分析及生物信息学分析 运用OmicsBean数据库(http://www.omicsbean.cn/login/)对交集靶点进行基因本体(GO)功能分析和京都基因与基因组百科全书(KEGG)通路富集分析,依据P值和度值进行排序。
2.2.5 化合物-靶点-药理作用-药味网络构建 建立化合物-靶点、靶点-药理作用、药理作用-药味的相互对应关系,导入Cytoscape 3.8.0 构建化合物-靶点-药理作用-药味网络。
2.3 G蛋白偶联受体和酶抑制活性检测
2.3.1 待测化合物的选取 根据药材功效及网络药理学分析结果选择化合物分别进行胆碱能受体毒蕈碱3(CHRM3)、肾上腺素受体β2(ADRB2)、ADRA1A、COX-2 受体检测(表3)。待测化合物检测浓度均为100、10 μmol·L–1,XEXJ的检测浓度为储备液稀释100、1000倍。

表3 受体实验化合物或药物信息
2.3.2 细胞培养 CHO-K1/M3 稳定细胞株用DMEM/F12 完全培养基(含G418 500 μg·mL–1、1%双抗和10%FBS)、HEK293/β2 和CHO-K1/α1A稳定细胞株均用DMEM 完全培养基(含G418 500 μg·mL–1、1% 双抗和10%FBS),于37 ℃、5%CO2培养箱中培养。
2.3.3 CHRM3 激动实验 以卡巴胆碱(检测浓度为2 μmol·L–1)作为阳性激动剂。取CHO-K1/M3稳转细胞株种板,密度为10 000 个/孔,每孔50 μL,培养16~24 h。根据试剂盒说明书准备assay buffer,配制1×FLIPR®钙4 试剂染料。取出细胞板,移除上清液,加1×FLIPR®钙4 试剂染料,于37 °C 培养箱中孵育1 h。向细胞板中每孔加化合物15 μL,检测荧光信号,计算样品激动率。
2.3.4 ADRB2 激动实验 以异丙肾上腺素(检测浓度为1 μmol·L–1)为阳性激动剂。取HEK293/β2 稳转细胞株,用stimulation Buffer(含5 mmol·L–1HEPES 70 μL、0.5 mmol·L–1IBMX 14 μL、0.1% BSA(来自试剂盒)186.67 μL、1×HBSS 13 729.3 μL)将细胞密度调整为20 000 个/mL。依次取化合物100 nL 及细胞悬液10 μL 至检测板。600 r·min–1(离心半径为42.5 mm)离心3 min,室温孵育60 min。加入4×Eu-cAMP示踪液5 μL 和4×ULight™-anti-cAMP 液5 μL。600 r·min–1(离心半径为42.5 mm)离心3 min,室温孵育60 min。在多功能酶标仪上读取cAMP信号,计算样品激动率。
2.3.5 ADRA1A 拮抗实验 以肾上腺素(6.6 nmol·L–1)为阳性激动剂、WB4101(1 μmol·L–1)为阳性拮抗剂,取CHO-K1/α1A 稳转细胞株种板,密度为15 000 个/孔,每孔50 μL 细胞,培养16~24 h。按照FLIPR®钙4试剂盒说明书准备assay buffer,配制1×染料;取出细胞384 孔板,移除上清液,加入1×染料,于培养箱中孵育1 h 后每孔加化合物15 μL,15 min 后,每孔加激动剂Epinephrine 22.5 μL,检测荧光信号,计算样品抑制率。
2.3.6 COX-2活性抑制实验 以塞来昔布为阳性对照(2.5 μmol·L–1)。按照试剂盒说明书进行具体实验操作,计算样品抑制率。
3 结果
3.1 化合物与味觉受体分子对接结果
分子与受体结合时的能量越低构象形状匹配度越高,通常认为docking score 绝对值≥5 时,分子配体与受体结合作用较强。各化合物与4 个味觉受体的对接结果及示意图如图1、图2所示,有机酸类和香豆素类与酸味受体的打分结果较好,可能是XEXJ的酸味物质基础;糖类、简单苯丙素类及其他类与甘味受体的对接打分较好,可能是其甘味物质基础;生物碱、木脂素、苯乙醇苷和黄酮等类成分与苦味受体结合打分结果较好,可能是其苦味物质基础;生物碱、黄酮、香豆素和三萜等类成分与辛味受体作用打分结果较好,可能是其辛味物质基础。4 种药味物质基础的结构类型和代表性化合物见表4。

图2 XEXJ中化合物与味觉受体分子对接

表4 XEXJ药味对应结构类型及代表性化合物
3.2 网络药理学实验结果
3.2.1 化合物和疾病共有靶点及PPI 网络构建 整合化合物靶点库和疾病靶点库,得到化合物与消化不良相关靶点131个、与咳嗽相关靶点188个、与呼吸道炎症相关靶点230 个、与发热相关靶点241 个,去重后得到最终药物疾病共有靶点261 个,通过Bioinformatics &Evolutionary Genomics 在线制图软件的Draw Venn Diagram 功能实现数据可视化,见图3。
将261 个共有靶点导入STRING 11 并利用Cytoscape 3.8.0 软件构建PPI 网络图(图4),根据度值>二倍中位数筛选出前15 个作为核心靶点,分别为蛋白胰岛素(INS,度值为140)、白蛋白(ALB,度值为136)、甘油醛-3-磷酸脱氢酶(GAPDH,度值为120)、白细胞介素-6(IL-6,度值为114)、肿瘤坏死因子(TNF,度值为99)、表皮生长因子受体(EGFR,度值为95)、SRC 原癌基因(SRC,度值为93)、丝裂原活化蛋白激酶1(MAPK1,度值为89)、半胱氨酸-天冬氨酸蛋白酶3(CASP3,度值为87)、CXCL8(度值为83)、Jun 原癌基因(JUN,度值为81)、雌激素受体1(ESR1,度值为80)、MAPK8(度值为77)、热休克蛋白90-αA1(HSP90AA1,度值为74)、淀粉样β前体蛋白(APP,度值为73),这些靶点有较多相互作用关系,涉及血管及胃肠道平滑肌的收缩和舒张、加速糖酵解、磷酸戊糖循环和肝脏中糖原的合成、发热、炎症反应及免疫调节等方面。
3.2.2 生物信息学分析及通路分析 通过OmicsBean数据库,将核心靶点进行GO 功能富集和KEGG 通路分析。GO 分析包含细胞组分(cellular component)、分子功能(molecular function)和生物过程(biological process)3 个方面,选取P值最小的前10个进行呈现(图5)。结果发现,这些蛋白在细胞组分方面主要参与构成细胞器、细胞囊泡、细胞质基质等过程;在分子功能方面主要参与蛋白结合、酶结合、受体结合、分子转导活性等过程;在生物过程方面主要涉及有机物或含氧化合物的应激反应、对内源性刺激的反应、生物过程和细胞过程的正调控等。KEGG 共富集筛选得到90 条相关信号通路,将P值最小的前20 条通路进行可视化处理(图6)。

图5 XEXJ相关蛋白靶点的GO富集分析
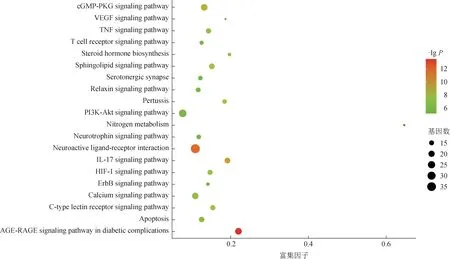
图6 XEXJ相关蛋白靶点KEGG通路富集分析前20条通路
3.2.3 化合物-靶点-药理过程-药味网络构建 根据对应关系在Cytoscape 3.7.0 软件中构建化合物-靶点-药理过程-药味的网络(图7)。该网络有301个节点、90 300条边。
3.3 功能受体实验结果
3.3.1 CHRM3 激动实验结果 如表5 所示,与对照组比较,XEXJ 稀释100 倍(XEXJ-H)和稀释1000 倍(XEXJ-L)时对CHRM3 受体均有显著的激动作用(P<0.001),激动率分别为336.19% 和101.20%。如表6所示,盐酸槟榔碱在高、低浓度下均有显著激动作用(P<0.001),激动率分别为91.85%和106.27%;槲皮苷、异槲皮苷、橙皮苷和新橙皮苷在高浓度下对CHRM3 均有显著激动作用(P<0.01,P<0.001)。
表5 XEXJ对CHRM3的激动作用(±s,n=2)

表5 XEXJ对CHRM3的激动作用(±s,n=2)
注:与对照组比较,***P<0.001;表6~表12同。
表6 化合物对CHRM3的激动作用(±s,n=2)

表6 化合物对CHRM3的激动作用(±s,n=2)
注:与对照组比较,*P<0.05,**P<0.01;表8、表10、表12同。
3.3.2 ADRB2激动实验结果 如表7所示,XEXJ-H和XEXJ-L 组对ADRB2 受体有显著的激动作用(P<0.001),激动率分别为100.27%和100.31%。如表8所示,芦丁、辛弗林、山柰酚、绿原酸、金丝桃苷、3,29-二苯甲酰栝楼仁三醇、槲皮素-3-O-β-D-葡萄糖基-7-O-β-D-龙胆双糖苷、桔梗皂苷D、橙皮苷、槲皮苷、异槲皮苷高,低浓度均能显著激动ADRB2受体(P<0.01,P<0.001);芥子碱硫氰酸盐、枸橼酸高浓度对ADRB2有显著激动作用(P<0.05,P<0.001)。
表7 XEXJ对ADRB2的激动作用(±s,n=2)

表7 XEXJ对ADRB2的激动作用(±s,n=2)
表8 化合物对ADRB2的激动作用(±s,n=2)

表8 化合物对ADRB2的激动作用(±s,n=2)
3.3.3 ADRA1A 拮抗实验结果 如表9 所示,XEXJ-H和XEXJ-L组对ADRA1A受体均有显著的抑制作用(P<0.001),抑制率分别为84.29%和63.89%。如表10 所示,连翘脂素在高浓度下能显著抑制ADRA1A 受体的激动作用(P<0.05);其余化合物的抑制作用不显著。
表9 XEXJ对ADRA1A的抑制作用(±s,n=2)

表9 XEXJ对ADRA1A的抑制作用(±s,n=2)
表10 化合物对ADRA1A的抑制作用(±s,n=2)
3.3.4 COX-2拮抗实验结果 如表11所示,XEXJ-H和XEXJ-L 对COX-2 均有显著的抑制作用(P<0.001),抑制率分别为78.57%和89.13%。如表12所示,连翘酯苷A、松脂素-β-D-吡喃葡萄糖苷连翘脂素、芦丁、金丝桃苷、槲皮素-3-O-β-D-葡萄糖基-7-O-β-D-龙胆双糖苷、槲皮苷、去甲基川陈皮素、山柰酚在高、低浓度给药下均能显著抑制COX-2 的活性(P<0.001);3,29-二苯甲酰栝楼仁三醇只有在高浓度时对COX-2有显著的抑制活性(P<0.001)。
表11 XEXJ对COX-2的抑制作用(±s,n=2)

表11 XEXJ对COX-2的抑制作用(±s,n=2)
表12 化合物对COX-2的抑制作用(±s,n=2)

表12 化合物对COX-2的抑制作用(±s,n=2)
4 讨论
中药五味药性理论是中药药性理论的核心内容之一,五味主要包括酸、苦、甘、辛、咸5 种基本味道,在功效方面表现为辛散、酸收、甘缓、苦坚、咸软,是临证立法、配伍组方的重要依据[7]。《黄帝内经》中酸收的作用表现在酸收心气、酸收肺气、酸收津液、酸收阴气及酸敛咽疮[8-9]。酸味药能收、能涩的作用被临床广泛应用于止咳平喘,以敛肺气。此外,酸能开胃气,少用能健胃开食[10-11]。研究发现,酸味药大多含有鞣质、有机酸等成分[12]。本研究发现,山楂中的有机酸类和枳实中的香豆素类可能是XEXJ 的酸味物质基础。有机酸类中的绿原酸可能作用于PTGS2,干预5-羟色胺能突触通路,调控胃肠道动力和内脏神经[13];柠檬酸可能作用于PDE4B,干预cAMP 信号通路舒张支气管、松弛气道平滑肌[14]。
甘味药补益作用主要体现在补气、补阳、补血、补阴4 个方面;缓急作用主要体现在缓解筋肉之急和缓解药力之急2 个方面;调和作用主要体现在健脾消食和调和诸药2 个方面。甘味药的有效成分以多糖、蛋白质、氨基酸等成分为主[15]。消食药的化学成分以糖类、蛋白质为主,其次为生物碱和苷类,大多数药物具有促进消化的功能,如山楂、谷芽[16]。分子对接发现,山楂中的糖类、莱菔子中的简单苯丙素类和瓜蒌中的核苷类可能是XEXJ 的甘味物质基础。网络药理学结果显示,简单苯丙素类化合物3,6'-二芥子酰基蔗糖及核苷类腺苷通过PDE5A 参与环鸟苷酸-蛋白激酶G(cGMP-PKG)信号通路调控肠道动力[17],还可通过SRC 蛋白调节瞬时受体电位(TRP)通道,阻止Aδ纤维和气道C 纤维活化进而达到止咳作用[18]。
苦味“能泄、能燥、能坚”,即具有清泄火热、泄降气逆、通泄大便、燥湿、坚阴等作用。辛味“能散,能润,能横行”,即具有散表邪、散里寒、散结滞等作用[19]。辛味与苦味配伍中“苦降辛开”法常用于治疗脾胃疾病[20],如大承气汤中大黄、芒硝、枳实、厚朴四药合用,共成“苦降辛开”之剂,在治疗胃动力不足、肠梗阻等疾病中疗效确切[21]。苦味药主要活性成分为生物碱、苷类[22]。辛味药的主要成分为挥发油、生物碱及萜类[23]。分子对接表明,连翘中的木脂素类和苯乙醇苷类,枳实、瓜蒌、蜜枇杷叶和葶苈子中的黄酮类及桔梗中的部分三萜类可能是XEXJ 的苦味物质基础;槟榔中的生物碱类、葶苈子和枳实中的部分黄酮类可能是其辛味物质基础。网络药理学结果表明,连翘脂素、山柰酚、槟榔碱可能通过作用于CHRM1、CHRM2、CHRM3,干预神经活性配体-受体相互作用通路、唾液分泌通路等,影响胃肠道平滑肌的收缩起到促消化作用[24]。山柰酚、芦丁、柚皮苷、金丝桃苷、槲皮苷等可能通过作用于PTGS2、IL-1β、TNF等,干预肿瘤坏死因子信号通路、核转录因子-κB(NF-κB)信号通路等抑制炎性致热因子的分泌发挥解热抗炎作用[25]。辛弗林、连翘脂素可能分别作用于ADRB2、ADRA1A 干预cGMP-PKG 信号通路、钙信号通路发挥止咳及解热作用[26]。
毒蕈碱型胆碱受体(M 受体)广泛分布于神经、心血管、消化和呼吸等系统中,调节许多重要的生理活动,如神经信号的传递、心血管活动、平滑肌收缩及内外分泌功能等[27]。M3受体是调节胃运动的主要受体,激动时可以引起胃肠道平滑肌收缩[28]。槲皮苷、异槲皮苷、柚皮苷、新橙皮苷和槟榔碱可通过激动CHRM3 受体发挥促消化作用;气管平滑肌上主要分布的β肾上腺素能受体为G 蛋白偶联受体(GPCR),呼吸道中以β2 受体为主,激动后引起腺苷酸环化酶活化,细胞内的cAMP 含量增加,游离Ca2+减少,使气管平滑肌产生扩张效应,而支气管收缩会导致呼吸能力下降,可能会引发咳嗽或喘息等其他症状[29]。芦丁、辛弗林、山柰酚等13 个化合物可通过激动ADRB2受体发挥止咳作用;大部分脂肪细胞产热是由交感神经系统通过GPCR 信号传导调节,肾上腺素受体(AR)分为α亚型(包括α1和α2)、β亚型(包括β1、β2、β3)两大类。α1-ARs在许多生理过程中发挥重要作用,包括平滑肌收缩、心肌变时变力、肝糖原代谢等[30]。研究证实,ADRA1A 激活后可通过与Gα偶联产生信号转导促进脂肪细胞产热[31]。受体实验分析连翘脂素可通过抑制ADRA1A 的激活发挥解热作用。除神经条件外,炎症因子的大量释放同样可引起发热,参与调节体温的中枢介质主要有前列腺素合成酶PGE2[32],研究表明脑血管中的内皮细胞通过COX-2 提高了PGE2 的水平而引起发热[33]。受体结果表明,除连翘苷和桔梗皂苷D 外,其余10 个化合物均能显著抑制COX-2酶活性。
综上,本研究采用“性-效-物”三元论的研究思路初步确定了XEXJ 的Q-marker,分别为黄酮类成分橙皮苷、柚皮苷、新橙皮苷、去甲基川陈皮素、槲皮素-3-O-β-D-葡萄糖基-7-O-β-D-龙胆双糖苷、槲皮苷、异槲皮苷、金丝桃苷、山柰酚;苯乙醇苷类成分连翘酯苷A、连翘酯苷E;木脂素类成分连翘脂素、(+)-松脂素-β-D-吡喃葡萄糖苷;三萜类成分桔梗皂苷D、3,29-二苯甲酰基栝楼仁三醇;生物碱类成分辛弗林、槟榔碱;有机酸类成分枸橼酸、绿原酸。
[利益冲突]本文不存在任何利益冲突。

