基于HPLC-Q-TOF MS/MS和网络药理学的参蓉蛹草片质量标志物研究△
于鑫畅,韩彦琪,郝艳琦,刘建庭,许浚,3,蒋庆峰,张铁军,
1.天津中医药大学,天津 301617;2.天津药物研究院 天津市中药质量标志物重点实验室,天津 300462;3.天津药物研究院 药物成药性评价与系统转化全国重点实验室,天津 300462
疲劳(fatigue)是指机体感到极度乏力,维持自愿活动出现障碍,具体体现在躯体上存在无力感、精神上感到疲倦[1]。关于疲劳的中医理论实践丰富,认为疲劳乃“精气夺则虚”,属于气血耗伤引起的虚证[2]。疲劳在中医古籍记载多以“虚劳”“神劳”表述,其病因可归纳为情志过激、外感至损、不良的饮食环境和生活方式等,疲劳脏腑病机则认为“肝虚、肾虚、脾虚皆令人体重烦冤”[2]。疲劳的机制复杂,学说众多,且疲劳多并发症造成社会负担大[3-4],因此抗疲劳对许多重大疾病的愈后过程及维持公众健康具有重要意义。参蓉蛹草片由肉苁蓉、人参、蛹虫草3 味药食同源的药材组成,具有抗疲劳、提高免疫力的功效。目前,关于参蓉蛹草片的药效物质基础不明确、作用机制不清晰、质量标准不完善,缺乏统一规范化的质量评价标准体系,无法有效控制其药品质量。
2016 年刘昌孝院士提出中药质量标志物(Qmarker)的核心概念和理论[5-6],是基于配伍环境、物质有效性、传递与溯源、特有性、可测性的“五原则”发现途径进行的研究,有利于建立以Qmarker 为基础的复方中药质量标准及质量控制体系[7]。
有效性是Q-marker 研究的核心内容之一,网络药理学从生物网络稳态的角度出发,以整体性和系统性为特点,通过数据挖掘、网络构建、拓扑分析找到关键节点,进而预测已知药物防治疾病药效活性成分、作用靶点,以及可能参与调控的细胞信号转导通路与作用机制[8]。本研究采用高效液相色谱-四极杆飞行时间质谱法(HPLC-Q-TOF-MS/MS)明确参蓉蛹草片化学物质组,通过网络药理学和分子对接技术,研究其抗疲劳作用机制,预测潜在的Qmarker,为参蓉蛹草片质量标准制订和质量控制提供基础。
1 材料
1.1 样品
参蓉蛹草片(批号:20211130)由天津药物研究院中药研发中心提供;荒漠肉苁蓉饮片(产地:新疆于田县,批号:20201010、20210830)由合作企业提供;人参(产地:吉林,批号:2011131)、蛹虫草(产地:云南,批号:20210301)均购自安徽普仁中药饮片有限公司,经天津药物研究院张铁军研究员鉴定,均符合《中华人民共和国药典》2020年版(一部)的有关规定。
1.2 试药
对照品毛蕊花糖苷(批号:111530-201914)和三七皂苷R1(批号:110745-201820)购自中国食品药品检定研究院;松果菊苷(批号:M04S11D123213)、京尼平苷酸(批号:Z24A10x95926)、异毛蕊花糖苷(批号:W17J10C90785)、管花苷B(批号:D20A11S121686)、红景天苷(批号:N1109X71936)、8-表马钱子酸(批号:S09GB160642)、人参皂苷Rg2(批号:M07N10S102243)、人参皂苷Rg1(批号:G30N10Y104330)、人参皂苷Rd(批号:Z09A9x67397)、人参皂苷Re(批号:B04D9S76499)、人参皂苷Rb1(批号:G01011Y126429)均购自上海源叶生物科技有限公司;管花苷A(批号:MUST-19110102)、肉苁蓉苷A(批号:MUST-20062806)购自成都曼斯特生物科技有限公司,所有对照品纯度均大于90%;色谱级甲醇购自天津市康科德科技有限公司;质谱级甲酸购自美国Fisher 公司;纯净水购自广州屈臣氏食品饮料有限公司。
1.3 仪器
ExionLC 型高效液相色谱仪(日本岛津公司);X500R QTOF 型质谱仪(美国SCIEX 公司);BCE224I-1CCN 型电子分析天平(美国Sartorius 公司);KQ500DE 型数控超声波清洗器(昆山市超声仪器有限公司)。
1.4 数据库与软件
Pubchem 数据库(https://pubchem.Ncbi.Nlm.Nih.gov/)、SwissTargetPrediction 数据库(http://www.Swisstargetprediction.ch/)、UniProt 数据库(http://www.uniprot.org/)、GeneCards 数据库(https://www.genecards.org/)、OMIM 数据库(https://www.omim.org/)、TTD 数据库(http://db.idrblab.net/ttd/)、Metascape 数据库(https://metascape.org/gp/index.html#/main/step1)、蛋白结构数据库(PDB,http://www.rcsb.org/)、Bioinformatics数据库(http://www.bioinformatics.com.cn/)、Cytoscape 3.8.0 软 件、Schrödinger 2020 Maestro 12.4软件。
2 方法
2.1 对照品和供试品溶液的制备
2.1.1 对照品溶液制备 分别取松果菊苷、毛蕊花糖苷、管花苷A、肉苁蓉苷A、三七皂苷R1、京尼平苷酸、异毛蕊花糖苷、管花苷B、红景天苷、8-表马钱子酸、人参皂苷Rg2、人参皂苷Rg1、人参皂苷Rd、人参皂苷Re、人参皂苷Rb1对照品适量,精密称定,置于10 mL 棕色量瓶中,加甲醇溶解至刻度,制备成混合对照品溶液。
2.1.2 供试品溶液的制备 取参蓉蛹草片适量,研磨成细粉(过五号筛),取约7 g,精密称定,置具塞锥形瓶中,加50%甲醇水溶液50 mL,称定质量,超声处理(功率250 W,频率30 kHz)60 min,放冷,再称定质量,用50%甲醇补足减失的质量,0.45 μm有机膜滤过,取续滤液,即得。
2.1.3 原药材供试品溶液的制备 分别取肉苁蓉粉末(过四号筛)1 g、人参粉末(过四号筛)1 g 和蛹虫草粉末(过四号筛)1 g,精密称定,分别置具塞锥形瓶中,按2.1.2项下方法制备。
2.2 色谱条件
Inertsil™ ODS-3 C18色谱柱(250 mm×4.6 mm,5 μm);流动相为0.1%甲酸甲醇溶液(A)-0.1%甲酸水溶液(B),梯度洗脱(0~10 min,5%A;10~25 min,5%~13%A;25~35 min,13%~21.5%A;35~50 min,21.5~41.5%A;50~80 min,41.5%~100%A;80~90 min,100%A);体积流量为0.8 mL·min–1;柱温为35 °C;进样量为10 μL。
2.3 质谱条件
X500R QTOF型高分辨质谱仪,正、负2种模式扫描测定;电喷雾离子源(ESI);IDA 模式;锥孔电压为30 V,离子源温度为600 ℃,样品锥孔电压为30 V,锥孔气流速为50 L·h–1,氮气脱气温度为350 ℃,脱气流速为600 L·h–1,扫描范围为m/z50~1500,一级电压为10 V,二级电压为35 V。
2.4 参蓉蛹草片化学成分的鉴定
通过HPLC-Q-TOF-MS/MS高分辨的定性能力获取到参蓉蛹草片化学组分数据,再利用SCIEX OS软件分析母离子及二级碎片信息、保留时间,通过对照品和已有文献建立的数据库信息等验证并确定化合物信息[9-23]。
2.5 网络药理学目标成分的选取
目标化合物筛选主要遵循以下3 个原则:1)经过本课题组对于参蓉蛹草片的物质基础研究并以含量优先原则筛选,化学成分的可测性是Q-marker 应用的必备条件[6];2)“有效”是Q-marker 的核心要素,对复方有效性成分的筛选应基于药效活性,选取各类型的代表性化合物,考虑纳入具有明确的药理作用、有临床试验研究、安全性评价、质量标准的可以产生预期药效的化学成分[6];3)血中效应成分是有效性成分质量传递的最终环节,是Q-marker确定的重要依据[6]。
2.6 基于网络药理学预测参蓉蛹草片抗疲劳作用机制
将2.5 项下选取的参蓉蛹草片的活性成分,利用Pubchem 获悉结构,进入SwissTargetPredictio 预测靶点,进行整合。以“chronic fatigue”“fatigue”等为关键词在TTD、OMIM、GeneCards数据库中检索疾病相关靶点。将已获取的成分、疾病相关靶点分别保留唯一值,利用Venny 2.1.0将药物成分作用靶点与疲劳靶点取交集处理后,得到活性成分对疲劳有相关作用的靶点。随即将相关靶点导入String 11.5 数据库,将获得的蛋白质-蛋白质相互作用(PPI)网络分析表导入Cytoscape 3.8.0使之可视化,并通过插件Network Analyzer 分析degree 值,筛选PPI 网络中Q-marker 值大于中位数的关键靶蛋白。利用Metascape 数据库对通过PPI 筛选出关键靶点进行基因本体功能富集分析(GO)和京都基因与基因组百科全书(KEGG)通路富集分析。GO 与KEGG分析均设置P<0.01(表示差异具有统计学意义)。利用Cytoscape软件,建立起成分-靶点-通路网络。
2.7 分子对接验证
第一步获取2.5 项下目标化合物的.sdf 结构,导入Maestro 软件,使用LigPrep 模块,对小分子进行配体预处理,得到结果为“out-maegz”文件。第二步根据拓扑学参数获得关键蛋白,受体蛋白从Protein Data Bank 数据库中检索获得,利用Protein Preparation 模块对受体蛋白进行去水、去配体、加氢、平衡电荷、补全链上缺失原子。受体蛋白能量最小化后得到后缀为.zip 的文件。使用Binding Site Detection、Receptor Gird Generation 模块对配体结合空腔进行选择。第三步是利用Ligand Docking 模块,分别将以上处理后的配体和受体文件导入,默认功能设置,进行半柔性分子对接。
3 结果
3.1 参蓉蛹草片化学成分识别
从参蓉蛹草片中共鉴定出124 个成分,包含氨基酸类、核苷类、苯乙醇苷类、环烯醚萜类、木脂素类、人参皂苷类等类化合物。其中通过对单味药的成分归属发现这些成分中除部分氨基酸、腺苷、甘露醇和糖类之外,其他成分在各个不同中药之间并未产生交叉。其中72 个化学成分来源于肉苁蓉;33 个成分来源于人参;5 个成分来源于蛹虫草,共有成分14 个(表1)。基于质量传递与溯源的Qmarker 研究途径,利用HPLC-Q-TOF-MS/MS 技术对单味药材原有成分及参蓉蛹草片复方中原型成分进行分析和鉴定,明确了成分的量值传递及其变化规律[6]。阐明了参蓉蛹草片的物质基础。对照品总离子流图见图1,参蓉蛹草片总离子流图见图2。
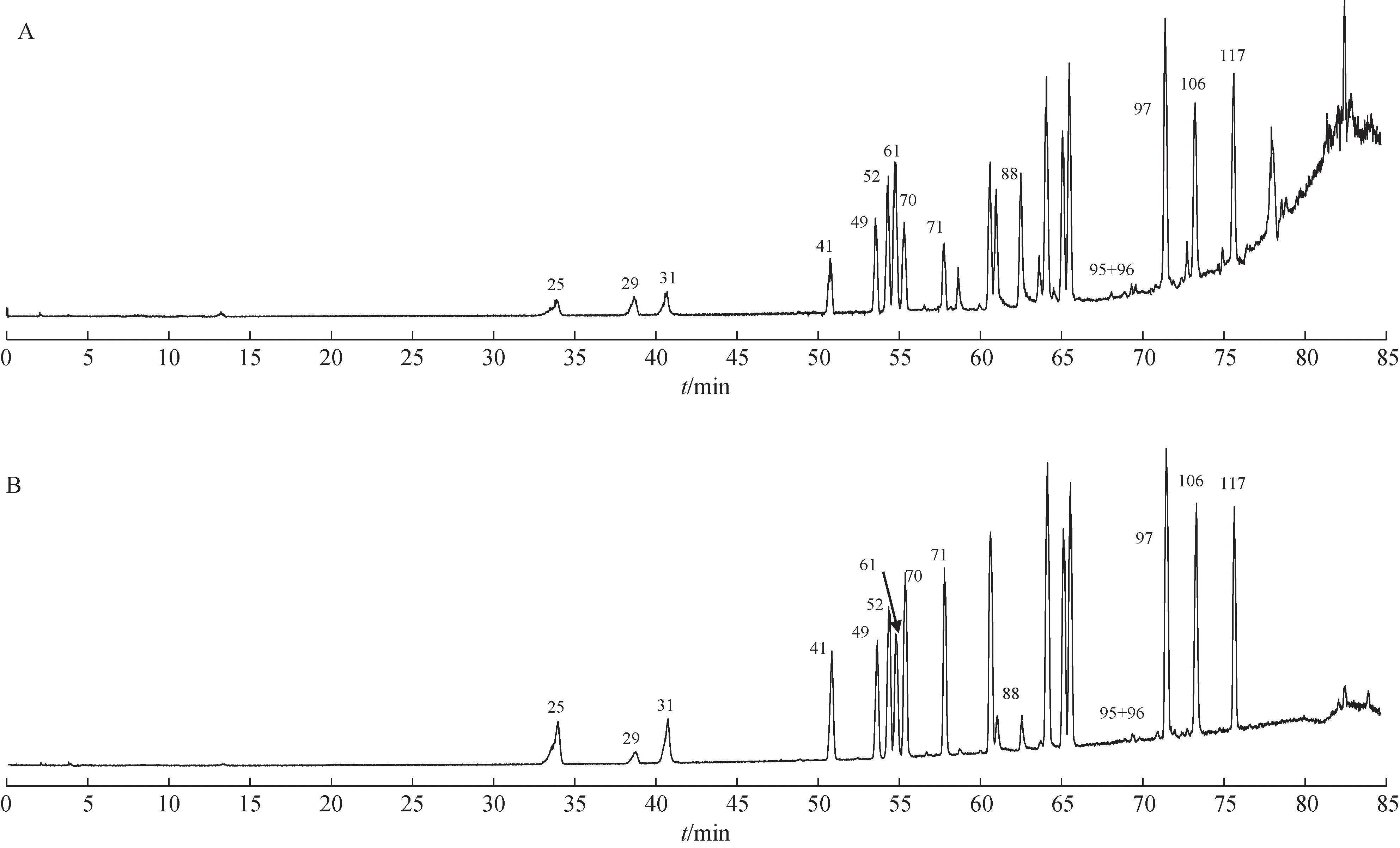
图1 混合对照品总离子流图

图2 参蓉蛹草片总离子流图
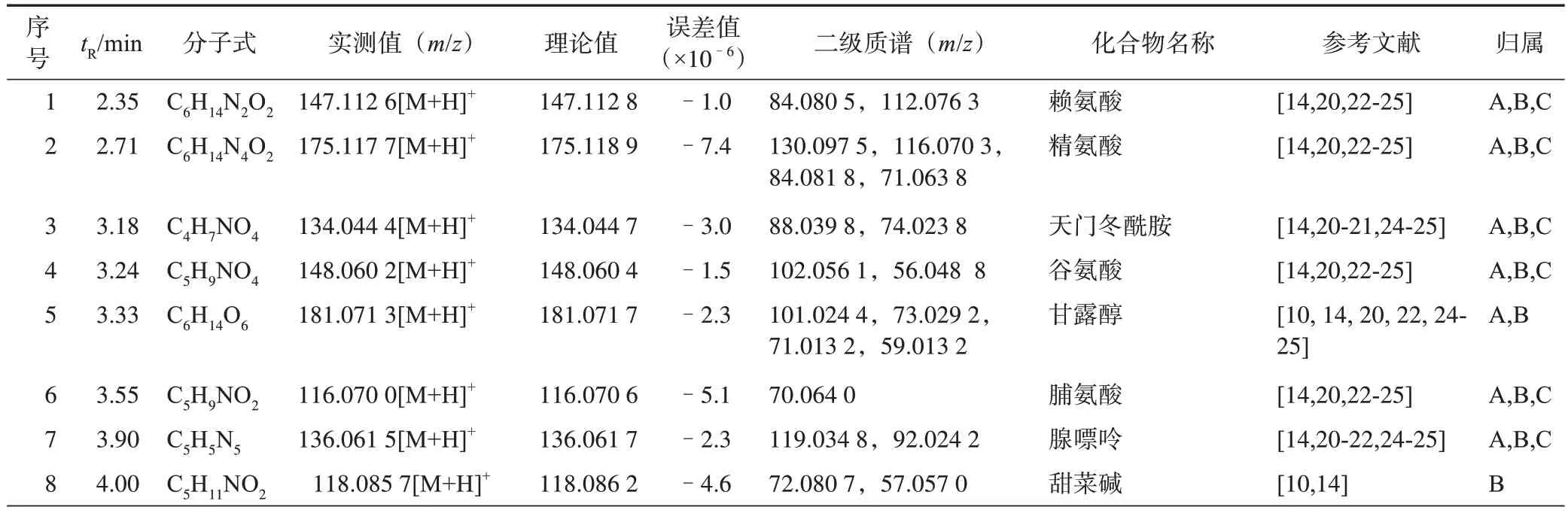
表1 参蓉蛹草片中化学成分质谱数据
以苯乙醇苷类松果菊苷(C35H46O20,785.250 9)为例,大多数苯乙醇苷类化合物在质谱中往往先发生苯丙烯酸酯苷键的断裂如咖啡酰基(C9H8O4,Caf),其可发生中性与负离子两种丢失状态,以及糖的裂解,主要是鼠李糖(C6H12O5,RhA)、葡萄糖(C6H12O6,Glc)。在负离子模式下的质谱数据为785.249 8[M–H]–、623.217 4[M–H–Rha]–;461.167 5[M–H–Caf]–;179.035 8[M–H–Rha–Caf–2Glc]–;161.023 8[M–H–Rha–Caf–2Glc–OH]–,其保留时间与裂解规律均与对照品一致,见图3。
以人参皂苷类人参皂苷Rb1(C54H92O23,1 107.595 6)为例,属于人参二醇型人参皂苷,在ESI 源负离子模式下,主要发生了C-3、C-20 键的断裂,从而产生去糖基化皂苷元。在负离子模式下的质谱数据为其在质谱负离子模式下的裂解规律为1 107.590 1[M–H]–;945.542 3[M–H–Glc]–;783.494 5[M–H–2Glc]–;621.443 0[M–H–3Glc]–;459.399 8[M–H–4Glc]–,见图4。

图4 人参皂苷Rb1质谱数据及可能的裂解途径
3.2 目标成分的选取
按2.5 项下的目标成分选取原则结合现有文献研究[24-33],从已鉴定出的124 个化学成分中共选取了包括苯乙醇苷类、环烯醚萜类、人参皂苷类、核苷类在内的,总计23 个化学成分,作为参蓉蛹草片网络药理学的目标化合物,见表2。

表2 参蓉蛹草活性成分
3.3 基于网络药理学预测参蓉蛹草片抗疲劳作用机制
通过SwissTargetPrediction、TCMSP 数据库对获取到的23 个成分可能的靶点进行处理,删除重复靶点,共得到520 个靶点。通过在TTD、OMIM、GeneCards数据库中检索疾病相关靶点,删除重复靶点,共得到7341 个相关靶点。利用Venny 2.1.0 得到参蓉蛹草片抗疲劳的潜在靶点396个。String 11.5数据库获得PPI 关系图,并筛选出degree 值>21(中位数)的195 个节点,颜色越深代表degree 值越大,PPI网络关系,见图5。
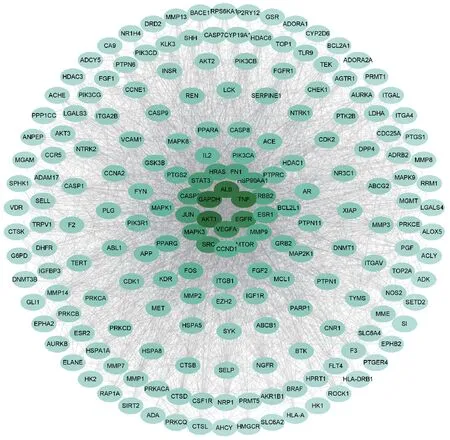
图5 参蓉蛹草片抗疲劳潜在靶点蛋白PPI网络
3.4 GO与KEGG分析
3.4.1 GO 富集分析 GO 富集分析中共包含3 个部分,生物过程(BP)获取到2208个条目;细胞组分(CC)获取到148 个条目;分子功能(MF)获取到227个条目。筛选出排名前10者,并绘制GO功能富集分析组图,以富集到的GO 功能(BP、CC、MF)为横坐标,以在该GO 功能上富集到的基因数目为纵坐标,结果见图6。由此可知,生物过程主要涉及丝裂原活化蛋白激酶级联的调节等;细胞成分主要参与构成膜筏等;分子功能主要参与磷酸转移酶活性等,推测这可能与参蓉蛹草片抗疲劳相关。
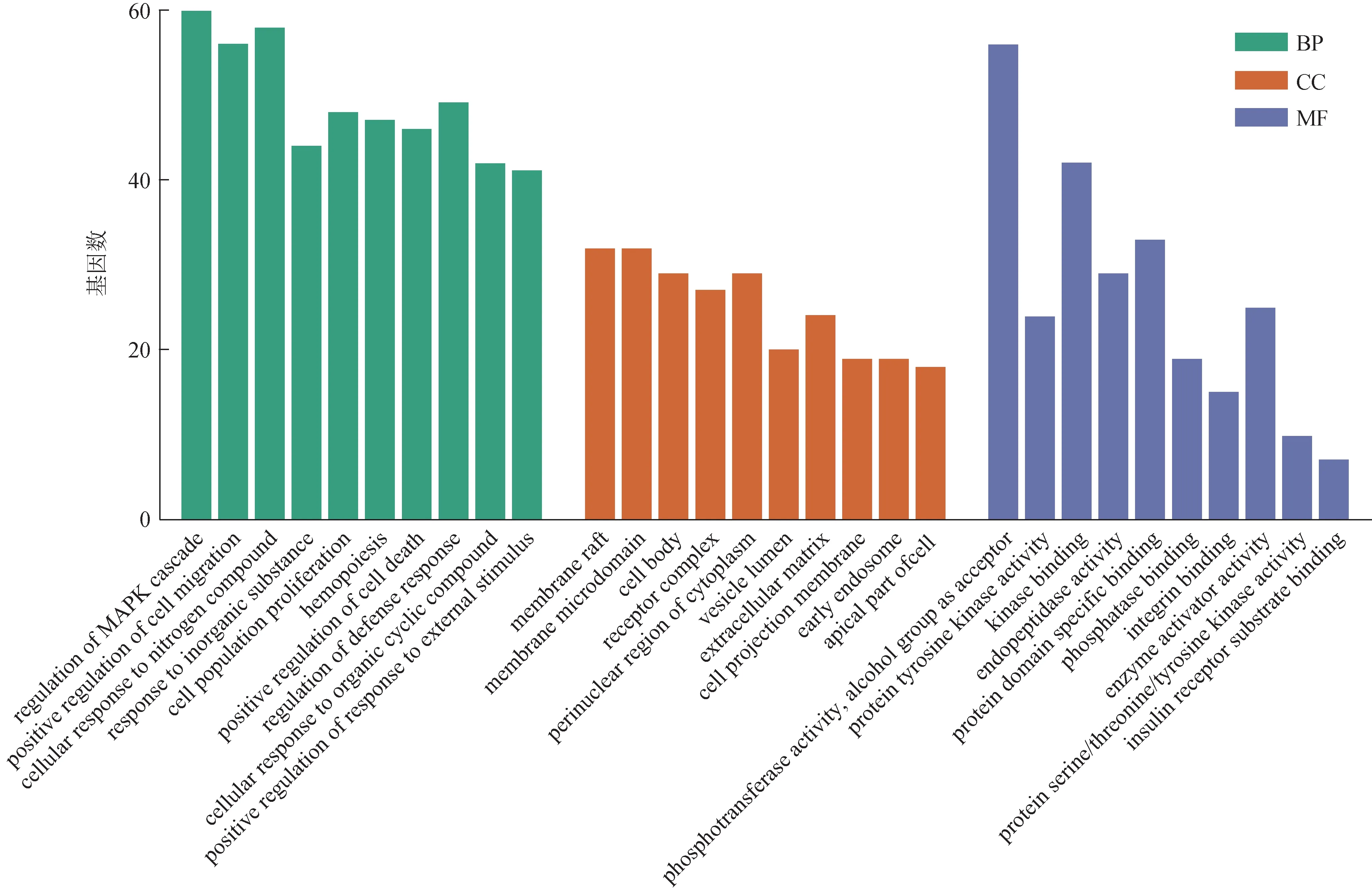
图6 参蓉蛹草片抗疲劳靶点的GO功能富集分析
3.4.2 KEGG 分析 KEGG 通路分析中共有214 条通路被富集到选择富集P值排名前10 与抗疲劳发展相关的条目为纵坐标,以在该通路上富集到的基因数目为横坐标并以气泡大小代表基因数目,以气泡颜色代表P值,进行可视化分析见图7,参蓉蛹草片可能通过作用于与生物代谢相关的通路如磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)信号通路;与免疫功能密切相关的通路如白细胞介素(IL)-17信号通路;与神经内分泌系统相关通路如神经退行性病变-多种疾病的通路等发挥抗疲劳作用。
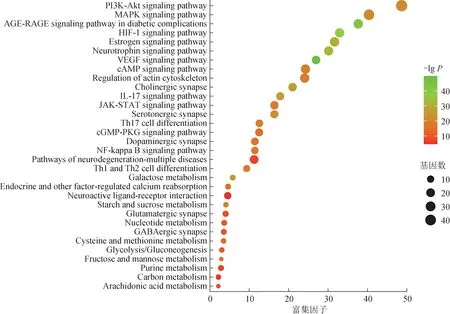
图7 参蓉蛹草片抗疲劳靶点的KEGG可视化气泡图
3.5 化合物-靶点-通路网络构建
通过Cytoscape 3.8.0,根据网络拓扑学分析,建立活性成分-靶点-通路,总共产生251 个节点,1428 条边,并以degree 值来显示(颜色越深,degree值越高)结果见图8。
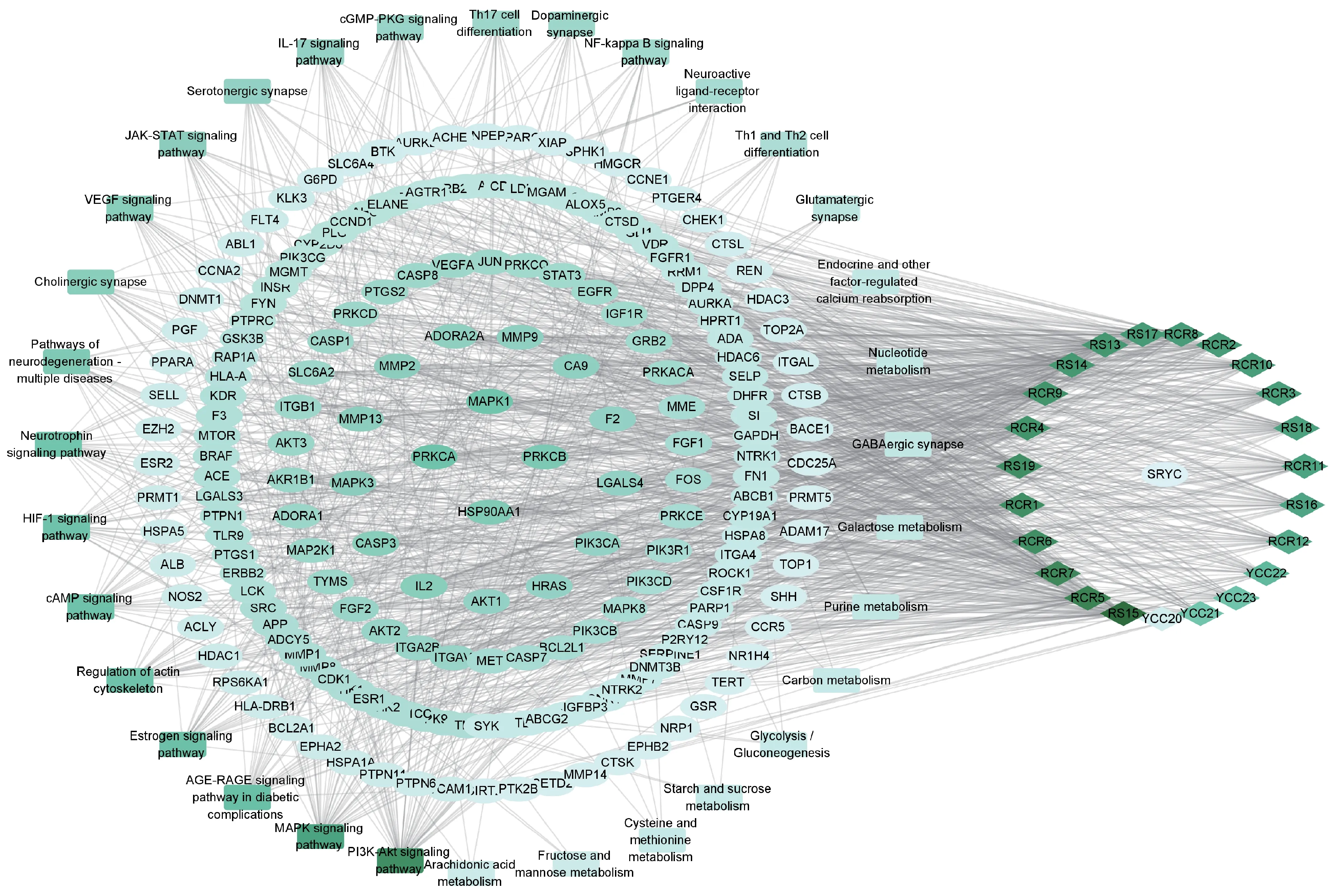
图8 参蓉蛹草片成分-靶点-通路网络
通过网络分析,参蓉蛹草片中的有效活性成分与多个靶基因有关,同时也可以发现该处方在发挥抗疲劳作用过程中与少数关键靶点有较强的联系。
3.6 分子对接结果
将3.2项下23个活性成分与degree值排名前15的关键靶点PRKCA(degree=26)、MAPK1(degree=25)、PRKCB(degree=22)、HSP90AA1(degree=21)、IL2(degree=19)、CASP3(degree=19)、MAPK3(degree=18)、MMP2(degree=18)、MMP13(degree=18)、MMP9(degree=17)、CA9(degree=17)、ADORA2A(degree=17)、HRAS(degree=16)、PIK3CA(degree=16)、F2(degree=16)进行对接,结果以Docking Score 表示,数值越小表示结合越好(一般情况下,Docking Score≤–5时),说明所选的受体与配体可以自发结合,提示成分与各靶点有较强的结合活性,以纵坐标代表成分与靶点之间的累积结合分数的堆叠图见图9。通过分子对接实验结果发现,参蓉蛹草片的23 个化学成分与15 个靶点之间均展现了良好的结合效果,苯乙醇苷类中以松果菊苷,异毛蕊花糖苷、环烯醚萜类中8-表马钱子酸,人参皂苷类中人参皂苷Rg1、人参皂苷Rg2,核苷类中腺苷、虫草素累积结合分数较高,提示成分与多个靶点之间有较强的结合活性,挑选代表性对接结果附对接分数见图10。
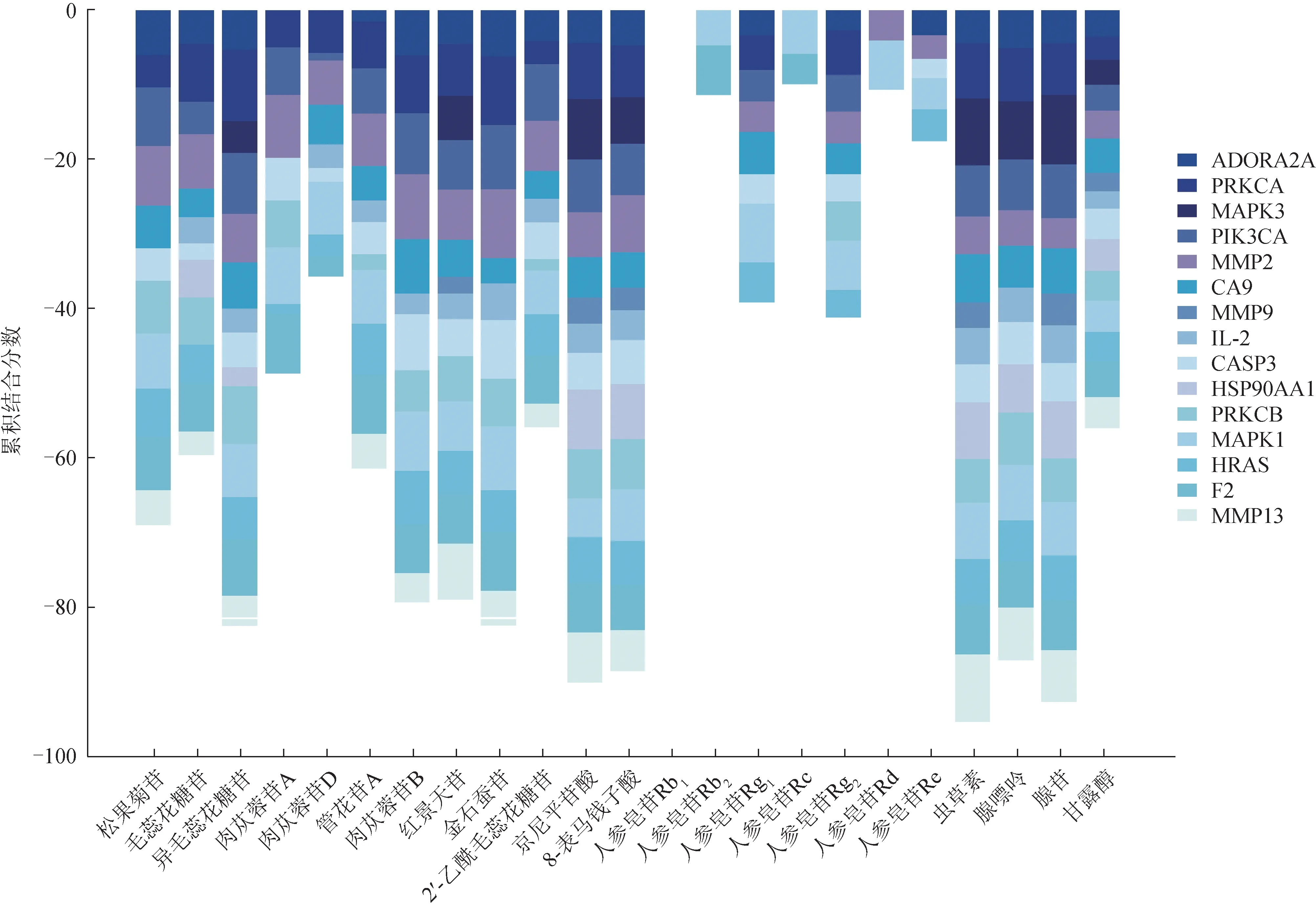
图9 参蓉蛹草片“配体-受体”分子对接结果堆积图
4 讨论
通过HPLC-Q-TOF-MS/MS对参蓉蛹草片化学成分分析,确定参蓉蛹草片中主要化学成分为氨基酸类、苯乙醇苷类、环烯醚萜类、木脂素类、人参皂苷类、核苷类等类成分。王小明[33]通过对荒漠肉苁蓉体内成分分析,发现苯乙醇苷类为其主要的入血成分。陈思慧[29]研究发现,参附汤中人参入血原型成分为人参皂苷类,如人参皂苷Rg1、人参皂苷Rg2、人参皂苷Rb1、人参皂苷Re。曹灵杰[27]通过对蛹虫草的血清药物化学进行研究发现核苷类,如虫草素和腺苷以原型成分被吸收入血。因此,从质量传递与溯源途径分析,以上成分可以作为参蓉蛹草片的Qmarker。基于有效性途径,根据网络药理学分析,参蓉蛹草片苯乙醇苷类、环烯醚萜类、人参皂苷类可能在能量代谢、氧化应激、免疫系统、神经内分泌方面发挥抗疲劳作用。
机体维持正常生命活动的能量物质是三磷酸腺苷(ATP)和糖原,在肌肉工作时,会消耗糖原产生ATP,ATP 被分解供生命活动所需的能量,当机体经过一段时间的运动强度,肝糖原和肌糖原用于肝脏和骨骼肌功能异常,会导致外周疲劳,引起传导阻滞[34-35],肉苁蓉中的松果菊苷、毛蕊花糖苷、异毛蕊花糖苷等苯乙醇苷类会作用于蛋白激酶Cα(PRKCA)、丝裂原活化蛋白激酶1(MAPK1)等蛋白靶点影响PI3K-Akt 信号通路,影响葡萄糖摄取,进而影响糖酵解[10]。张莎莎[36]发现不同浓度虫草素给药小鼠运动疲劳组均能提高肝糖原和肌糖原水平。线粒体钙离子作为调节细胞内能量转换的主要离子,是重要的调控因子[37],肉苁蓉中的松果菊苷通过影响Ca2+通道,有利于横纹肌进行兴奋收缩耦联。因此,参蓉蛹草片中苯乙醇苷类、虫草素可能作为潜在的Q-marker。
免疫系统失调是病理性疲劳[38-39]患者体内存在的异常生物过程之一,这是由于患者存在炎症和自身免疫症状[40-41],有研究表明17 种细胞因子与疲劳严重程度相关,其中的13 种是促炎症细胞因子[42]。肉苁蓉中的毛蕊花糖苷、肉苁蓉苷A 等苯乙醇苷类激活IL-17 通路中基质金属蛋白酶(MMP)2、MMP13、MMP9 蛋白靶点,影响IL-17 信号通路开启宿主防御机制,对细胞外病原体免疫。因此,参蓉蛹草片中苯乙醇苷类可能作为潜在的Q-marker。
对氧化应激与急性运动的研究表明,在人体骨骼肌氧需求量的急剧变化时,氧敏感途径会被激活,线粒体内发生氧化磷酸化形成超氧化物等活性氧簇,从而影响线粒体功能,导致能量合成供应不足、运动能力下降,从而诱发机体疲劳发生,可能会通过增加毛细血管生长来适应[43]。人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re 等人参皂苷类均可以作用于血管内皮生长因子(VEGFA)[44],松果菊苷、肉苁蓉苷A等苯乙醇苷类可作用于PRKCA等影响缺氧诱导因子(HIF-1)信号通路发挥作用,用于适应骨骼肌氧需求量的急剧变化[44]。因此,参蓉蛹草片中苯乙醇苷类、人参皂苷类可能作为潜在的Q-marker。
中枢性疲劳主要与神经调控相关[45],慢性疲劳综合征患者体内存在异常生物学过程之一是中枢神经系统和神经内分泌调节的细微变化[46]。有研究表明多巴胺(DA)是哺乳动物大脑中一种慢速神经递质,控制着包含运动活动在内的多种功能,会促进中型棘状神经元(MSNs)的兴奋性参与调节纹状体运动控制功能[47]。肉苁蓉中的松果菊苷、管花苷A等苯乙醇苷类可以通过作用于腺苷受体A2A(ADORA2A)影响神经内分泌系统有关通路,研究表明ADORA2A与多巴胺D2受体存在直接的拮抗关系[48],也有报道称两者形成功能性异聚体受体复合物[49]。因此,参蓉蛹草片中苯乙醇苷类可能作为潜在的Q-marker。
综上,本研究通过网络药理学、分子对接对参蓉蛹草片中的23 个化学成分进行靶点及通路的分析,并基于成分的特有性、可测性途径进一步预测参蓉蛹草片的Q-marker。苯乙醇苷类、人参皂苷类为参蓉蛹草片代表性化合物并初步预测为参蓉蛹草片的Q-marker,结合课题组后期对参蓉蛹草片指纹图谱研究,多指标含量测定研究进一步预测参蓉蛹草片中松果菊苷、8-表马钱子酸,人参皂苷Rg1、人参皂苷Rb1及人参皂苷Re为参蓉蛹草片的Q-marker。初步阐释了参蓉蛹草片通过多成分、多靶点、多通路发挥抗疲劳的药理作用机制,可为参蓉蛹草片的深入研究和质量控制提供参考。
[利益冲突]本文不存在任何利益冲突。

