利伐沙班对氧化型低密度脂蛋白诱导的人脐静脉内皮细胞功能的影响*
袁 媛,刘 迟,李光慧,张晓丹,王利苹,黄仲义,王 斌,2△
(1.上海市静安区中心医院,上海 200040; 2.复旦大学附属华山医院,上海 200040)
动脉粥样硬化是心脑血管事件的重要发病机制,其发生、发展与内皮细胞功能紊乱、脂质聚积和炎症进展密不可分[1]。有研究显示,由脂质诱发的人内皮细胞损伤是动脉粥样硬化的始动环节[2]。氧化型低密度脂蛋白(Ox-LDL)可通过减少增殖、促进凋亡和引发炎症而引起内皮细胞功能障碍[3]。利伐沙班(RIV)是非维生素K拮抗剂口服抗凝剂(NOAC)的代表药物[4],不仅可预防栓塞性中风,还可减少心血管事件,如冠状动脉及外周血管疾病、血栓栓塞症和动脉粥样硬化[5-6]。部分研究对RIV可能具有减少内皮功能损伤的潜力这一假设进行了验证,发现RIV可减少脂多糖(LPS)、[4-((氨基甲酰基硫基)甲基)苯基]硼酸氢溴酸盐、内毒素或氧甾醇引起的炎性因子或凋亡细胞的数量[7-10]。为此,本研究中探讨了RIV 对Ox-LDL 刺激下内皮细胞功能障碍的影响及可能的机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:Forma3111 型细胞培养箱(美国Thermo 公司);EPOCH 型酶标仪(美国BioTek 公司);BSC - 1600 IIA2 型生物安全柜(苏州安泰空气技术有限公司);FACSClibur 型流式细胞仪(美国BD 公司);2500 型凝胶成像仪(上海天能公司);Mini-PROTEAN 型垂直电泳仪(美国BioRad公司)。
试药:RIV(上海阿达玛斯试剂有限公司,批号为P1263035,纯度为99.9%);Ox-LDL(广州奕源生物工程公司,货号为YB-002);DMEM 培养液(美国Hyclone公司,批号为AF29585038);胎牛血清(批号为42F6590K),胰酶(批号为批号04054),均购自美国Gibco Thermo公司;青霉素(100 U/mL)-链霉素(100 μg/mL)溶液(上海碧云天生物技术有限公司,批号为080420200826);细胞计数试剂盒(CCK-8,北京兰杰柯科技有限公司,批号为71011500);膜联蛋白- 荧光素异硫氰酸酯/碘化丙啶Annexin V-FITC/PI 凋亡试剂盒(批号为A20843),肿瘤坏死因子- α(TNF - α),酶联免疫吸附试验(ELISA)试剂盒(批号为A18211134),白细胞介素6(IL - 6)ELISA 试剂盒(批号为A10610732),均购自广州联科生物科技有限公司;白细胞介素1β(IL - 1β)ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号为VC8IKL2PYR);十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS - PAGE)预制胶(上海天能科技有限公司,批号为072220100803);无蛋白快速封闭液(上海雅酶生物科技有限公司,批号03551200);兔尿激酶型纤溶酶原激活因子受体(uPAR)抗体(武汉三鹰生物技术有限公司,批号为00082384);核因子-κB(NF-κB)p65抗体(批号为16),p-NF-ĸB p65 抗体(批号为17),均购自美国Cell Signaling Technology 公司;β- 肌动蛋白(β- actin)抗体(批号为T0002),山羊抗兔免疫球蛋白G(IgG,批号为56j9958),均购自常州祥泰生物技术有限公司;山羊抗鼠IgG 抗体(美国Jackson公司,批号为140586)。
细胞株:人脐静脉内皮细胞株(HUVEC)由复旦大学药学院微生物与生化药学教研室馈赠。
1.2 方法
细胞培养:从液氮中取出HUVEC 细胞株1 支进行细胞复苏,使用含有10%胎牛血清和1%青链霉素的DMEM 培养液,将复苏后的HUVEC 分装于T25 细胞培养瓶中,将细胞置5% CO2、37 ℃的培养箱中,培养24 h后更换新鲜培养液。当细胞培养至对数生长期(融合度约为80%)时进行传代培养或细胞计数。
细胞分组与处理:条件培养24 h 后,根据不同干预措施将HUVEC 分为空白对照组(A 组,常规培养液),Ox-LDL 组(B 组,含100 μg/mL Ox-LDL 的培养液),Ox - LDL + RIV125 组(C1组,含100 μg/ mL Ox - LDL和125 ng/ mL RIV 的培养液),Ox - LDL + RIV250 组(C2组,含100 μg/mL Ox-LDL 和250 ng/mL RIV 的培养液)和Ox - LDL + RIV500 组(C3组,含100 μg/ mL Ox-LDL和500 ng/mL RIV的培养液)。用RIV 20 mg/ d剂量预防中风时,患者血浆浓度峰值为249(184~343)ng/mL,谷浓度为44(12~137)ng/mL[11]。10 mg/d或20 mg / d 剂量治疗静脉血栓时,患者最大血浆浓度为101(7~273)ng/mL或215(22~535)ng / mL,最低血浆浓度为14(4~51)ng / mL 或32(6~239)ng/mL[12]。经换算,C1组、C2组、C3组分别给予125,250,500 ng/mL质量浓度RIV。
CCK-8法检测细胞存活率:取对数生长期细胞,以1 000个/孔的浓度接种到96孔板,每孔200 μL培养液,置培养箱中培养24 h,弃去上清液,进行分组处理,每组设6个复孔,继续培养48 h,弃去培养液,每孔加入100 μL培养液和10 μL CCK - 8 溶液,避光持续培养1.5 h。利用酶标仪于450 nm 波长处读取吸光度,重复3 次。以A 组的细胞存活率为100%,计算各组细胞存活率。
流式细胞仪检测细胞凋亡率:取对数生长期细胞,以2.5×104个/孔的浓度接种至12 孔板,每孔1 mL 培养液,置培养箱中培养24 h,弃去上清液,进行分组处理,每组设3 个复孔,继续培养48 h,收集各组细胞,置1.5 mL离心管中,使用预冷的无菌磷酸盐缓冲液(PBS)离心洗涤,使用Annexin V-FITC/PI 凋亡试剂盒,将细胞重悬于500 μL 1×结合缓冲液中,并于每管中加入5 μL Annexin V - FITC 和10 μL PI,室温避光孵育5 min。利用流式细胞仪检测细胞的荧光情况,采用FlowJo V10软件分析。以Annexin V-FITC 染色阳性和PI染色阴性或阳性的细胞百分比计算细胞早期和晚期的凋亡率。
ELISA 测定细胞炎性因子水平:取对数生长期细胞,以1.0×105个/孔接种至6孔板,每孔2 mL培养液,置培养箱中培养24 h 弃去上清液,进行分组处理,每组设3 个复孔,继续培养48 h,收集各组细胞培养上清液,离心(离心力为1 000g)20 min,进一步除去杂质和细胞碎片,取上清液。按ELISA 试剂盒说明测定IL - 1β,IL-6,TNF-α水平。
免疫印迹(Western blot)法测定NF-κB信号通路与uPAR蛋白的表达:取对数生长期细胞,以1.0×105个/孔接种至6孔板,每孔2 mL培养液,置培养箱培养24 h,置无菌操作台,弃去上清液,用预冷的无菌PBS 洗涤2遍,每孔分别加入100 μL裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂)于冰上裂解,收集裂解液,于4 ℃离心(离心力为14 000g)5 min 后留取上清液,采用BCA 法测定蛋白浓度[13],根据样品浓度与一定浓度的上样缓冲液混合,4 ℃低速离心后,高温变性,混匀,分装,置-20 ℃冰箱。每孔上样20 μg蛋白,使其在4%~20%的SDS-PAGE 中进行电泳,分离后的蛋白通过湿法电转法转移到聚偏氟乙烯(PVDF)膜上[14],用无蛋白快速封闭液封闭30 min 后,4 ℃温下下与一抗孵育过夜,包括μPAR(稀释浓度为1∶800),NF-κB p65和p-NF-κB p65(稀释浓度均为1∶1 000),内参蛋白β-actin(稀释浓度为1∶5 000)。孵育后PVDF 膜用含0.1%吐温20(Tween-20)的缓冲液洗涤3次,每次5 min,与二抗室温孵育1.5 h。使用增强型化学发光试剂盒,通过凝胶成像系统显影、拍照。采用Image J软件检测蛋白灰度值。
1.3 统计学处理
采用GraphPad Prism 9 软件对数据进行分析。计量资料以±s表示,采用Shapiro-Wilk 检验获取正常分布,组间分析采用单因素方差分析(ANOVA)和Dunnett多重比较检验。P<0.05为差异有统计学意义。
2 结果
2.1 对细胞存活率的影响
与A组比较,B组细胞存活率显著降低(P<0.001);与B 组比较,C1组、C2组、C3组细胞存活率显著升高(P<0.05),且呈剂量依赖关系。详见图1。
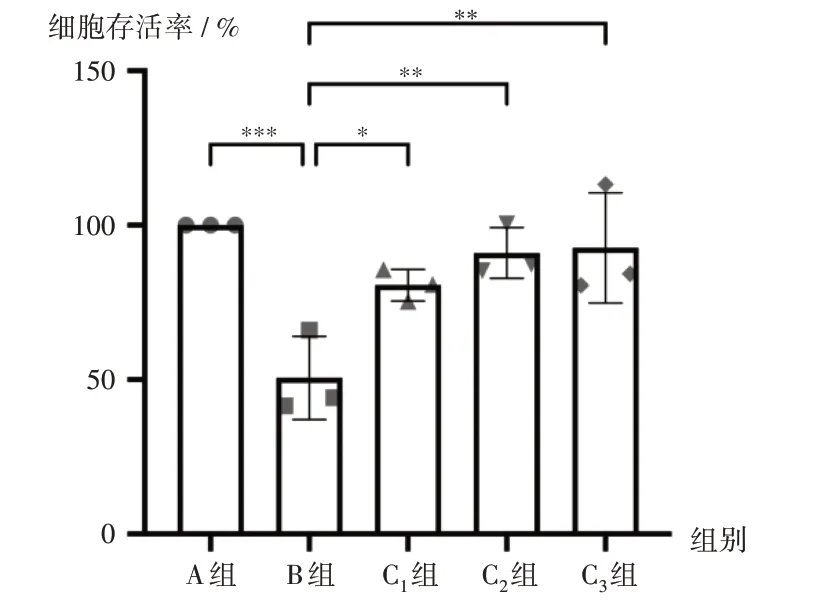
注:*P < 0.05,**P < 0.01,***P < 0.001,F = 9.484,P = 0.002 0。图3同。图1 RIV对Ox-LDL诱导的HUVEC细胞存活率的影响(n=3)Note:*P < 0.05,**P < 0.01,***P < 0.001,F = 9.484,P = 0.002 0(for Fig.1 and Fig.3).Fig.1 Effect of rivaroxaban on the survival rate of HUVEC cells induced by Ox - LDL(n = 3)
2.2 对细胞凋亡率的影响
与A组比较,B组细胞凋亡率显著升高(P<0.01);与B 组比较,C1组、C2组、C3组细胞凋亡率均显著降低(P<0.05)。详见表1和图2。
表1 RIV对Ox-LDL诱导的HUVEC细胞凋亡率的影响(±s,%,n=3)Tab.1 Effect of rivaroxaban on apoptosis rate of HUVEC cells induced by Ox - LDL(±s,%,n = 3)

表1 RIV对Ox-LDL诱导的HUVEC细胞凋亡率的影响(±s,%,n=3)Tab.1 Effect of rivaroxaban on apoptosis rate of HUVEC cells induced by Ox - LDL(±s,%,n = 3)
注:与A组比较,#P < 0.05,##P < 0.01;与B组比较,*P < 0.05,**P < 0.01。表2同。Note:Compared with those in group A,#P < 0.05,##P < 0.01;Compared with those in group B,*P < 0.05 and **P < 0.01 (for Tab.1 - 2).
组别A组B组C1组C2组凋亡率4.46±2.95 17.45±3.39##11.84±2.53*10.65±3.38*组别C3组F值P值凋亡率9.71±1.52*8.055 0.003 6

图2 RIV对Ox-LDL诱导的HUVEC细胞凋亡率的影响Fig.2 Effect of rivaroxaban on apoptosis rate of HUVEC cells induced by Ox - LDL
2.3 对细胞炎性反应的影响
与A组比较,B组细胞IL-1β,IL-6,TNF-α水平均显著升高(P<0.05);与B 组比较,C3组细胞IL-1β,IL-6,TNF-α水平均显著降低(P<0.05)。详见图3。

A.IL - 1β(F = 6.742,P = 0.006 7) B.IL - 6(F = 12.68,P = 0.007) C.TNF - α(F = 3.59,P = 0.045 7)图3 RIV对Ox-LDL诱导的HUVEC IL-1β,IL-6,TNF-α水平的影响A.IL - 1β(F = 6.742,P = 0.006 7) B.IL - 6(F = 12.68,P = 0.007) C.TNF - α(F = 3.59,P = 0.045 7)Fig.3 Effect of rivaroxaban on IL - 1β,IL - 6 and TNF - α levels of HUVEC cells induced by Ox - LDL
2.4 对细胞NF-κB p65 表达的影响
与A 组比较,B 组细胞p-NF-κB p65 表达显著升高(P< 0.05);与B 组比较,C3组p - NF - κB p65 表达显著降低(P<0.05)。详见表2和图4 A。
表2 RVI对Ox-LDL诱导的HUVEC NF-κB p65和uPAR蛋白表达水平比较(±s,n=3)Tab.2 Comparison of NF - κB p65 and uPAR protein expression levels in HUVEC cells induced by Ox - LDL(±s,n = 3)

表2 RVI对Ox-LDL诱导的HUVEC NF-κB p65和uPAR蛋白表达水平比较(±s,n=3)Tab.2 Comparison of NF - κB p65 and uPAR protein expression levels in HUVEC cells induced by Ox - LDL(±s,n = 3)
组别A组B组C1组C2组C3组F值P值p-NF-κB p65/ NF-κB p65 0.78±0.12 1.38±0.51#0.96± 0.15 0.82±0.09 0.59±0.07*4.172<0.05 uPAR/β-actin 0.75 ±0.05 0.98 ±0.02##0.74 ±0.15**0.84 ±0.07*0.43±0.07**49.03<0.001

A.NF - κB p65 B.uPAR图4 RIV对Ox-LDL诱导的HUVEC NF-κB p65通路和uPAR的免疫印迹电泳图A.NF - κB p65 B.uPARFig.4 Immunoblot electropherograms of NF - κB p65 pathway and uPAR of HUVEC cells induced by Ox - LDL
2.5 对细胞uPAR 表达的影响
与A组比较,B组细胞uPAR蛋白表达水平显著升高(P<0.001);与B组比较,C1组、C2组、C3组细胞μPAR蛋白表达水平均显著降低(P<0.05)。详见表2和图4 B。
3 讨论
RIV 是一种具有研究价值和临床应用前景的新型血管保护剂。COMPASS 研究[15]结果表明,RIV 2.5 mg每日2 次可降低慢性血管性疾病患者的心血管事件发生风险,且严重不良反应较少[16]。另一项随机试验研究结果表明,与单用阿司匹林相比,RIV 5 mg 每天2 次可增加缺血后前臂血流量,减少亚临床炎性表现,改善2型糖尿病患者的内皮功能退化[17]。
作为动脉粥样硬化的独立风险因素,Ox - LDL 能降低血管内皮活性,进而诱发凋亡和产生炎症,继而导致病变部位形成不稳定斑块,以及斑块破裂后引发急性冠状动脉综合征[18-19]。因此,Ox - LDL 作为建立细胞损伤模型的关键诱导因子在心血管药理研究中得到了广泛应用[20]。本研究中利用Ox-LDL 诱导内皮细胞产生细胞损伤,继而研究了RIV 在增加细胞活力、抑制凋亡和炎性因子分泌方面的表现。结果发现,RIV 可通过提高细胞存活率,减少细胞凋亡数目,减少HUVECs细胞中炎性因子IL-1β,IL-6,TNF-α 的分泌,调节HUVEC 细胞中p - NF - κB p65 和uPAR 的表达,从而发挥细胞内皮保护功能。
本研究中选择的浓度(125,250,500 ng/ mL)均在RIV 的治疗浓度范围内[11-12],均缓解了Ox-LDL 诱导的细胞活力下降,其中250 ng/ mL 和500 ng/ mL 减少了细胞凋亡,且500 ng/mL RIV还可进一步减少IL-1β,IL-6,TNF-α 的分泌,提示RIV 的内皮功能保护作用可能是剂量依赖性的。一项大鼠抑郁症模型实验中,RIV 既减少了炎性反应,又以剂量依赖的方式减少了氧化应激[21]。另一项小鼠体内实验结果表明,RIV 和阿司匹林可减少Ldlr 敲除小鼠病灶中的细胞凋亡[22]。研究表明,无论是100 ng/mL 或500 ng/mL RIV,还是25 -羟基胆固醇,对内皮细胞凋亡都未产生任何影响[23],这提示RIV 对凋亡的影响可能与诱发细胞损伤的因素有关。
NF - κB 途径的激活有助于促炎因子的分泌和细胞凋亡,从而进一步促进内皮细胞的损伤和动脉粥样硬化[24]。本研究中RIV明显抑制了Ox-LDL诱导的NF-κB p65磷酸化水平,这与使用LPS 和舒尼替尼的研究结果[25]一致。因此,提示RIV 可能通过抑制NF - κB p65 的激活以保护内皮功能。
μPAR 是一种多功能调节受体,通常存在于内皮细胞、成纤维细胞和多种肿瘤细胞表面[26],与细胞增殖、分化、迁移、炎性反应等密切相关[27-30]。已有研究表明,功能受损的内皮细胞中μPAR 的表达上调,同时缺血性脑卒中患者的血浆中也检测到可溶性μPAR 水平升高[31]。一些心血管药物如决奈达隆和依折麦布,可能通过减少内皮细胞上的μPAR 表达而表现出心血管保护作用[30-31]。本研究中发现,RIV 对HUVEC 细胞中的μPAR 显示出抑制作用,表明μPAR 可能是RIV 减轻内皮细胞损伤的另一个靶点。基于μPAR 的多重生理功能,推测下调μPAR 的RIV 可能具有抗凝外的其他药理功能,如抗肿瘤作用。最新研究发现,RIV 在口腔鳞状细胞癌(OSCC)细胞系(h357/H400)中均表现出抗肿瘤作用[32-33]。尽管还需研究,但RIV 甚至其他NOACs 的抗凝药理作用无疑是一个极具研究潜力和价值的领域。
综上所述,RIV 可减轻Ox-LDL 诱导的HUVEC 细胞存活率下降、凋亡增加、炎性因子分泌等损伤,且这种作用可能依赖于NF-κB 和μPAR 的调节。尽管需要进一步研究如在动物模型上证实等,进而深入阐明保护作用和机制,但本研究仍为探索RIV或其他NOAC在Ox-LDL 诱导的内皮细胞功能减退中的作用及其他额外临床获益提供了启示。

