混菌发酵对菠萝苹果复合果酒品质改善的研究
胡陆军, 陈晓蝶, 林曼,林锐, 徐腾, 赵志峰,3
1. 四川轻化工大学 生物工程学院,四川 宜宾 644005;2. 四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 宜宾 644005;3. 四川大学 轻工科学与工程学院,成都 610065
苹果(MaluspumilaMill.)因口感丰富且含有大量多酚物质、维生素和微量元素而深受人们喜爱, 同时它还具有抗肿瘤、预防心脑血管疾病等作用[1].菠萝〔Ananascomosus(Linn.) Merr.〕除了含有大量生物活性物质、膳食纤维、矿物质等, 还具有抗炎、改善神经系统等功能[2].果酒是增加苹果、菠萝等水果附加值的重要加工方式, 但目前用于果酒酿造的原料多是单一水果, 且发酵菌种较为单一, 导致果香味不足, 典型性不明显.复合果酒是目前提升果酒品质的常用方法之一, 菠萝苹果复合果酒可以综合利用两种水果在果香、营养价值等方面的特点, 进而酿造出色泽风味俱佳的复合果酒.然而, 目前还未见多菌种混合发酵菠萝苹果复合果酒的报道.
影响果酒品质的因素有很多, 如工艺参数(pH、糖度、发酵温度等)和风味物质等, 其中风味物质是影响发酵果酒品质的关键因素之一.发酵菌种是影响果酒风味物质产生的关键因素.Escribano等[3]研究发现非酿酒酵母在发酵过程中可以分泌果胶酶、β-葡萄糖苷酶等多种胞外酶, 有助于增加香气化合物的质量浓度, 进而改善果酒品质, 是酿酒酵母(Saccharomycescerevisiae)发酵的重要补充.常见的非酵母属有毕赤酵母属(Pichia)、克鲁维酵母属(Kluyveromyces)、圆孢菌属(Torulaspora)等[4-5].何松等[6]采用从水蜜桃自然发酵液筛选出来的菌株P.cephalocereanahsmt-1和菌株M.sinensishsmt-6发酵水蜜桃, 结果发现这两株菌株混合发酵能增加水蜜桃果酒的香气成分, 有效改善水蜜桃果酒的品质.
植物乳植杆菌(Lactiplantibacillusplantarum)是一种常见的益生菌, 在果酒发酵方面有巨大的应用潜力, 它能通过发酵赋予果酒更高的营养保健价值.越来越多的研究人员开始关注植物乳植杆菌对水果中植物化学物质的生物转化, 以改善果酒的品质[7].植物乳植杆菌在果酒发酵中可以进行苹果酸-乳酸发酵(malolactic fermentation, MLF), 能将口味尖酸的苹果酸降解为更为柔和的乳酸, 使果酒的口感更加圆润饱满[8].植物乳植杆菌所产生的有机酸还能提高果酒发酵环境中微生物的稳定性, 其分泌的糖苷酶、酯酶、酚酸脱羧酶等酶类还有助于微生物与果汁相互作用产生更多风味物质[9], 改善果酒的感官价值.陈晓蝶等[10]采用酿酒酵母、毛榛毕赤酵母(Pichiamanshurica)和植物乳植杆菌混菌发酵沃柑果酒, 发现混菌发酵增加了酯类和高级醇的种类和质量浓度, 增加了沃柑果酒的香气复杂性, 同时改善了沃柑果酒的口感.目前还未见利用酿酒酵母、非酿酒酵母和乳酸菌组合发酵菠萝苹果复合果酒的研究.
本研究以富士苹果、菠萝为原料, 利用酿酒酵母、库德里阿兹威毕赤酵母(Pichiakudriavzevii)和植物乳植杆菌混菌发酵菠萝苹果复合型果酒, 以期改善菠萝苹果复合果酒的品质, 提高其产品附加值, 促进复合果酒产业的发展.
1 材料与方法
1.1 材料、试剂与仪器
菠萝和富士苹果: 宜宾市; 商业果酒酿酒酵母: 安琪酵母股份有限公司; YPD(yeast extract-peptone-dextrose)和MRS(Man-Rogosa-Sharpe)培养基: 北京奥博星生物技术有限责任公司; 酿酒酵母SCFF227、库德里阿兹威毕赤酵母SCFF207和植物乳植杆菌SCFF19: 四川轻化工大学.
果胶酶(30 000 U/mL, 食品级)和无水柠檬酸: 日照金禾博源生化有限公司; 焦亚硫酸钾(食品级): 山东齐鲁生物科技有限公司; 酚酞(分析纯): 天津市致远化学试剂有限公司; 亚硝酸钠(分析纯): 天津市京东天正精细化学试剂厂; 柠檬酸三铵和磷酸氢二钾(分析纯): 国药集团化学试剂有限公司; DNS试剂(分析纯): 厦门海标科技有限公司; 芦丁(分析纯): 北京索莱宝科技有限公司.
MITR-80ATC酒精计和MITR-50ATC糖度计: 长沙米琪仪器设备有限公司; UV-1900I紫外可见分光光度计: 苏州乌津仪器有限公司; PhS-10酸度计: 成都世纪方舟科技有限公司; TSQ 8000气相色谱-质谱联用仪: 赛默飞世尔科技公司(Thermo Fisher Scientific); LC1100高效液相色谱仪: 安捷伦科技(Agilent Technologies)有限公司; WJE-F6榨汁机: 宁波沃玛电器有限公司; PTX-JA510分析天平: 华志(福建)电子科技有限公司.
1.2 实验方法
1.2.1 菠萝苹果复合型果酒制备工艺
菠萝苹果复合果酒发酵工艺流程如图1所示.挑选新鲜菠萝和苹果分别进行清洗、去皮并去核后榨汁.根据预实验结果, 将菠萝果浆和苹果果浆以3∶2的体积比混合, 同时糖度调节至20 °Brix, 并加入60 mg/L果胶酶, 80 mg/L纤维素, 40 ℃水浴酶解20 min, 再按果汁体积的0.02%加入焦亚硫酸钾, 果浆经纱布过滤后冷藏备用.预先将酵母菌在YPD培养基上涂布培养24 h, 随后在恒温摇床(180 r/min)中利用液体培养基培养24 h, 经2次活化后制成酵母种子液, 冷藏备用.同时, 按相同方法将植物乳植杆菌接种于MRS培养基活化2次制成种子液备用.将活化后的菌种接种于混合果浆中, 并在20 ℃下进行发酵, 发酵期间每隔48 h取样检测菠萝苹果复合果酒的总酸、还原糖等理化指标.以还原糖和酒精度为主要指标, 当二者连续测定3次没有明显变化时视为发酵结束.发酵结束后将果酒过滤至经巴氏消毒的发酵罐中, 于4 ℃条件下避光陈酿3个月.

图1 菠萝苹果复合果酒发酵工艺流程
1.2.2 实验设计
酿酒酵母与植物乳植杆菌的接种比例通过多次预实验调整为2∶1, 酿酒酵母与非酿酒酵母接种比例为1∶1, 活化后的菌种按复合果汁体积的6%接入1 L复合果汁中, 使菌种浓度为107CFU/mL.AQ组采用安琪酿酒酵母单菌发酵; SC组采用酿酒酵母SCFF227单菌发酵; KB组采用库德里阿兹威毕赤酵母SCFF207单菌发酵; SK组采用酿酒酵母SCFF227和库德里阿兹威毕赤酵母SCFF207组合发酵; SKP组采用酿酒酵母SCFF227、库德里阿兹威毕赤酵母SCFF207和植物乳植杆菌SCFF19组合发酵.
1.3 菠萝苹果复合型果酒理化指标的测定
1.3.1 常规理化指标测定
参照《葡萄酒、果酒通用分析方法》(GB/T 15038—2006)进行果酒糖度、酒精度、总酸、还原糖的测定, pH值采用pH计测定, 每项指标重复测定3次.
1.3.2 总酚质量浓度测定
参照Mohd等[11]的方法对样品中的总酚质量浓度进行测定, 分别吸取0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8 mL质量浓度为0.1 mg/mL的没食子酸标准溶液, 加入2.0 mL福林酚试剂, 随后加入8.0 mL浓度为60 g/L碳酸钠溶液, 混匀, 定容至25 mL, 25 ℃水浴1.5 h, 在760 nm处测定其吸光值.以没食子酸质量浓度为横坐标, 吸光度为纵坐标, 绘制标准曲线, 求出回归方程及其相关系数[y=12.699x+0.082(R2=0.999 2)].计算总酚质量浓度.
1.4 菠萝苹果复合型果酒抗氧化性能测定
1.4.1 羟自由基清除率
采用生工生物工程(上海)股份有限公司的羟自由基检测试剂盒(比色法)进行测定.按照说明书处理菠萝苹果复合果酒样品, 以H2O为对照, 取各样品上清液在536 nm处测定吸光度值.羟自由基清除率计算公式为:
(1)
式中:D表示羟自由基清除率(%);A2代表测定管吸光度;A1表示对照管吸光度;A0代表空白管吸光度.
1.4.2 超氧阴离子自由基清除率
采用生工生物工程(上海)股份有限公司的超氧阴离子浓度检测试剂盒(比色法)进行测定.在530 nm下测得不同浓度标准品的吸光度值, 以标准溶液浓度为横坐标, 以标准溶液的吸光度值为纵坐标, 绘制标准曲线方程为:
Y=6.2615X-0.0101R2=0.999 7
按照比色法处理菠萝苹果复合果酒样品, 在波长530 nm处测定吸光度值为A样品.以标准溶液替代样品作为标准管, 测得吸光度值为A标准管; 以提取样替代样品为空白管, 测得吸光度值为A空白管.将ΔA样本带入标准方程得到X, 超氧阴离子浓度的计算公式为:
超氧阴离子浓度(μmol/mL)=2X
(2)
1.5 菠萝苹果复合型果酒风味物质测定
1.5.1 有机酸测定
有机酸参考Ye等[12]的高效液相色谱法(High Performance Liquid Chromatography, HPLC)进行测定.吸取1 mL菠萝苹果复合果酒样品, 经0.22 μm有机滤膜过滤后备用.HPLC条件: Agilent ZORBAX SB-Aq(4.6 mm×250 mm, 5 μm)色谱柱, VWD检测器, 检测波长: 210 nm, 流动相A: 磷酸二氢钾(pH=2.4)95%, 流动相B: 甲醇5%, 进样量: 15 μL, 流速: 0.4 mL/min, 柱温: 25 ℃.
1.5.2 挥发性风味物质测定
8902(0x550F):这个 TAC对应的是只连接了 SGSN3的enodeb(也就是SGSN1和SGSN2没有该enodeb的S1连接)
挥发性风味物质参考程宏桢等[13]的气相色谱-质谱联用法(Gas Chromatography-Mass Spectrometer, GC-MS)进行测定.GC条件: 采用DB-5MS毛细管色谱柱(30 m×0.25 mm, 0.25 μm), 采用不分流模式, 进样口温度250 ℃, 载气为氦气, 载气流速1.5 mL/min, 升温程序初始温度35 ℃, 保持时间5 min后, 以4 ℃/min的速率升至最终温度250 ℃.MS条件: 采用全扫描模式, 电离模式EI, 发射电流: 10 μA, 电子能: 70 eV, 接口温度: 280 ℃, 离子源温度: 200 ℃, 四级杆温度: 150 ℃, 质量扫描范围: 40~600 amu.
1.6 感官评价
参考金海炎等[14]的方法设计感官评价表, 挑选10名食品专业的同学并进行相关培训后进行菠萝苹果复合果酒感官品评.
1.7 数据分析
数据分析采用IBM SPSS Statistics 26.0软件, 进行了单因素方差分析和Duncan多重比较差异分析.当p<0.05时, 差异有统计学意义.采用OriginPro 2021绘图.
2 结果与分析
2.2 菠萝苹果复合果酒基本理化指标
2.2.1 pH值和总酸
pH值和总酸不仅是果酒的口感特征指标, 而且对发酵过程中的微生物的代谢程度也有一定的指示作用[15].5个发酵组总酸和pH值的变化如图2所示, 在前2 d, 各发酵组的pH值呈下降趋势, 总酸呈显著上升趋势, 该变化不仅与果浆中的酸性成分有关, 还可能与高糖环境激发细胞代谢产酸的应激效应有关[16].发酵3 d后, 各组pH值明显升高, 且后期各发酵组pH值在一定范围内波动, 可能是某些有机酸之间发生了合成与分解, 例如酒石酸等[17].发酵第6 d, 各发酵组的总酸质量浓度都有一定程度的增加, 可能与酵母等细胞生长代谢某些有机酸或自身代谢产酸有关[18].发酵结束时, AQ组总酸质量浓度最高,为9.32±0.28 g/L.与其他发酵组相比, SKP组总酸质量浓度最低, 为6.79±0.20 g/L; pH最高, 为4.04±0.02, 这可能是植物乳植杆菌在果酒发酵过程中参与了部分有机酸的代谢, 例如苹果酸、柠檬酸代谢等, 从而使果酒的酸度降低[19].

图2 发酵过程中pH值和总酸的变化
2.2.2 糖度、还原糖和酒精度
糖的利用率是衡量酵母菌发酵性能的重要指标之一, 酵母菌通过代谢果酒中的糖类物质, 生成乙醇及其他次级代谢产物[20].由图3可知, 不同菌种在单独发酵和混合发酵过程中, 前期糖度和还原糖质量浓度由于微生物的利用呈快速下降趋势, 后期因菌种参与的代谢途径有差异, 导致糖的利用程度有显著差异.在发酵中后期, 相比其他发酵组, KB组对糖的利用效率最低, 可能是库德里阿兹威毕赤酵母在发酵过程中对糖的利用能力低于酿酒酵母, 酒精发酵效率较低, 这与其他非酿酒酵母结果相似[21], 导致该组发酵末期的还原糖质量浓度最高, 为49.13±0.21 g/L.而相比于其他发酵组, 三菌混合发酵SKP组糖度值和还原糖质量浓度最低, 质量浓度为5.26±0.26 g/L, 表明SKP组有较高的糖利用率和发酵效率.

图3 发酵过程中糖度和还原糖的变化
由图3和图4对比可知, 糖的消耗程度与酒精度的高低成正比.如图4所示, 混菌发酵SKP组对糖的利用率最高, 其酒精度最高, 为12.40%±0.49%; KB组在发酵过程中对糖的利用率相对较低, 无法完成糖的充分利用, 因此产酒精能力也相对较弱, 其酒精度最低, 为6.90%±0.28%.这与在香梨百香果复合果酒中的研究结果类似[22].这说明混菌发酵SK组和SKP组利用糖的能力比单菌发酵AQ组、SC组和KB组高, 发酵能力更强.
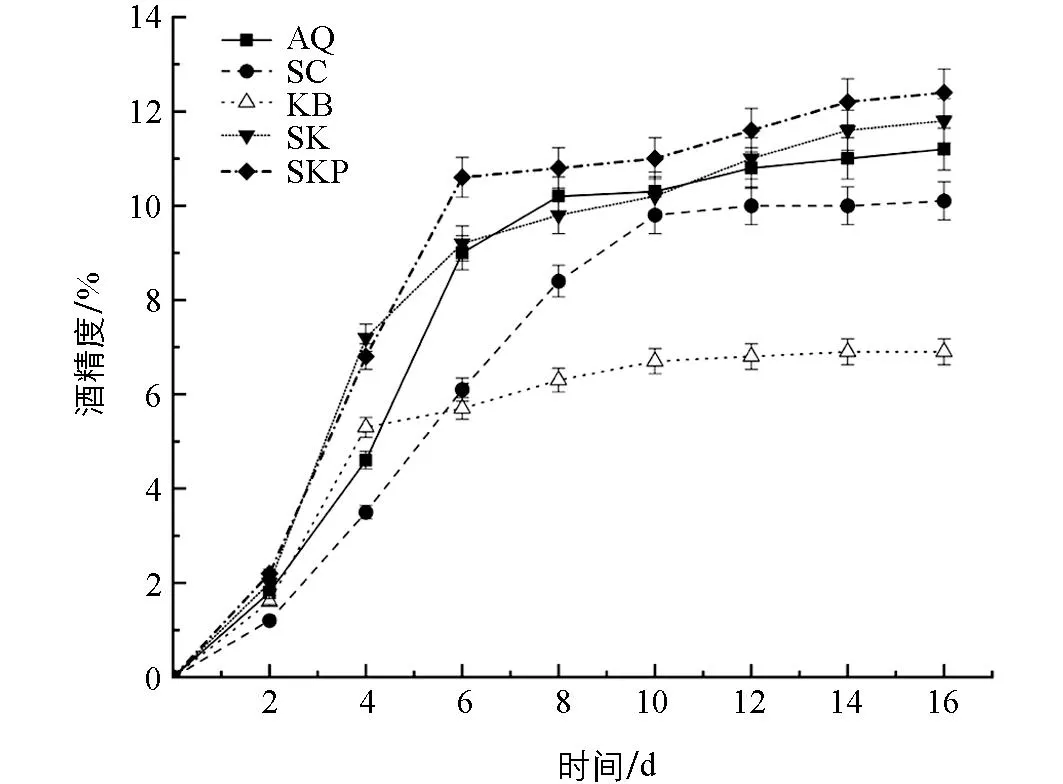
图4 发酵过程中酒精度的变化
2.3 菠萝苹果复合果酒抗氧化性分析

不同小写字母表示同一指标不同发酵组之间差异有统计学意义(p<0.05), 下同.
2.4 菠萝苹果复合果酒不同发酵组风味物质分析
2.4.1 有机酸比较
有机酸能影响果酒的酸度、颜色、化学稳定性和储存质量等, 所以, 有机酸与果酒的感官品质有直接的相关性.不同菌种参与的有机酸代谢途径不同, 风味物质也会产生明显的变化, 如某些酯类(乳酸乙酯、醋酸酯等), 挥发性脂肪酸, 醇类和萜类物质等.由图6可知, 乳酸和乙酸是菠萝苹果复合果酒发酵产生的主要有机酸.酒石酸在所有发酵组中相对质量浓度较小, 可能是生成了酒石酸氢钾沉淀, 这也可能会导致果酒pH值发生变化[25].
柠檬酸被认为是三羧酸循环(Tricarboxylic Acid Cycle)中重要的中间体, 柠檬酸相对质量浓度的变化可能是由于微生物在发酵过程中通过柠檬酸代谢生成了乙酸、乳酸等物质[26].SKP组的柠檬酸质量浓度最高, 为1.06±0.03 mg/mL, KB组质量浓度最低, 为0.43±0.01 mg/mL.研究表明, 乙酸可以通过酵母菌的磷酸葡萄糖酸途径生成, 除此之外, 也可由乳酸菌分解柠檬酸产生[27].由图6可知, SK组和SKP组的乙酸相对质量浓度较高分别为1.29±0.04 mg/mL和1.62±0.05 mg/mL, 且加入库德里阿兹威毕赤酵母的发酵组乙酸质量浓度显著增加, 这与Wei等[28]报道的结果相似, 但非酿酒酵母产乙酸的机制还有待深入研究.

图6 不同发酵组有机酸质量浓度对比
在发酵过程中, 乳酸是糖酵解的最终产物, 口感上比苹果酸更加柔和.由图6可知, 除KB组和AQ组, 其余发酵组乳酸的相对质量浓度都比较高.而SKP组的乳酸质量浓度最高, 为1.57±0.05 mg/mL, 说明在相同条件下, 在菠萝苹果复合果酒中加入植物乳植杆菌, 发生了苹果酸—乳酸发酵, 使菠萝苹果复合果酒整体的酸度降低, 口感更加柔和, 这与前文总酸质量浓度分析结果一致.
综上, 乳酸和乙酸是菠萝苹果复合果酒发酵产生的主要有机酸, 且加入植物乳植杆菌后有利于降低菠萝苹果复合果酒的酸度, 能有效提升菠萝苹果复合果酒的口感.
2.4.2 挥发性风味物质比较
发酵菌种是影响果酒挥发性风味物质形成和感官特征的重要因素之一.五组发酵体系中共检测出30种挥发性成分, 其中醇类12种、酯类6种、醛酮类6种、其他化合物(萜烯类和脂肪酸类)6种.SC组挥发物种类最多为24种, SK组和SKP组次之, 均为23种.其中SKP组挥发物质量浓度最高, 为80.35±1.23 mg/mL.
醇类是果酒香气的重要组成之一, 如表2所示, 乙醇、苯乙醇、丙三醇和丁二醇等是菠萝苹果复合果酒的主要醇类.其中SKP组的乙醇和苯乙醇质量浓度较高, 这些物质赋予菠萝苹果复合果酒良好的玫瑰花香和酒香, 对果酒香气复杂性有一定贡献[29].此外, 丙三醇在各组的质量浓度都较高, 一般认为其对果酒的口感具有积极贡献, 对香气没有显著影响[29].在KB组中发现异戊醇质量浓度较高, 异戊醇被认为具有令人愉悦的玫瑰和蜂蜜香气, 通过苯丙氨酸的脱羧和还原脱氨基作用形成, 其生成主要受酵母菌株的影响[31].其余醇类如丁二醇, 它的质量浓度在菠萝苹果复合果酒中相对较低, 但也可能会对复合果酒的感官产生积极影响.
酯类是果酒的主要呈香物质, 主要在发酵和陈酿期间通过醇类与脂肪酸的酯化作用形成[32].如表2所示, 乙酸乙酯、正乙酸己酯和丁酸乙酯是菠萝苹果复合果酒的主要酯类, 酯类能够赋予菠萝苹果复合果酒愉悦的花香和果香.乙酸乙酯和丁酸乙酯在混菌发酵SK组和SKP组中质量浓度较高, 因而能使菠萝苹果复合果酒具有浓郁的甜香和果香.
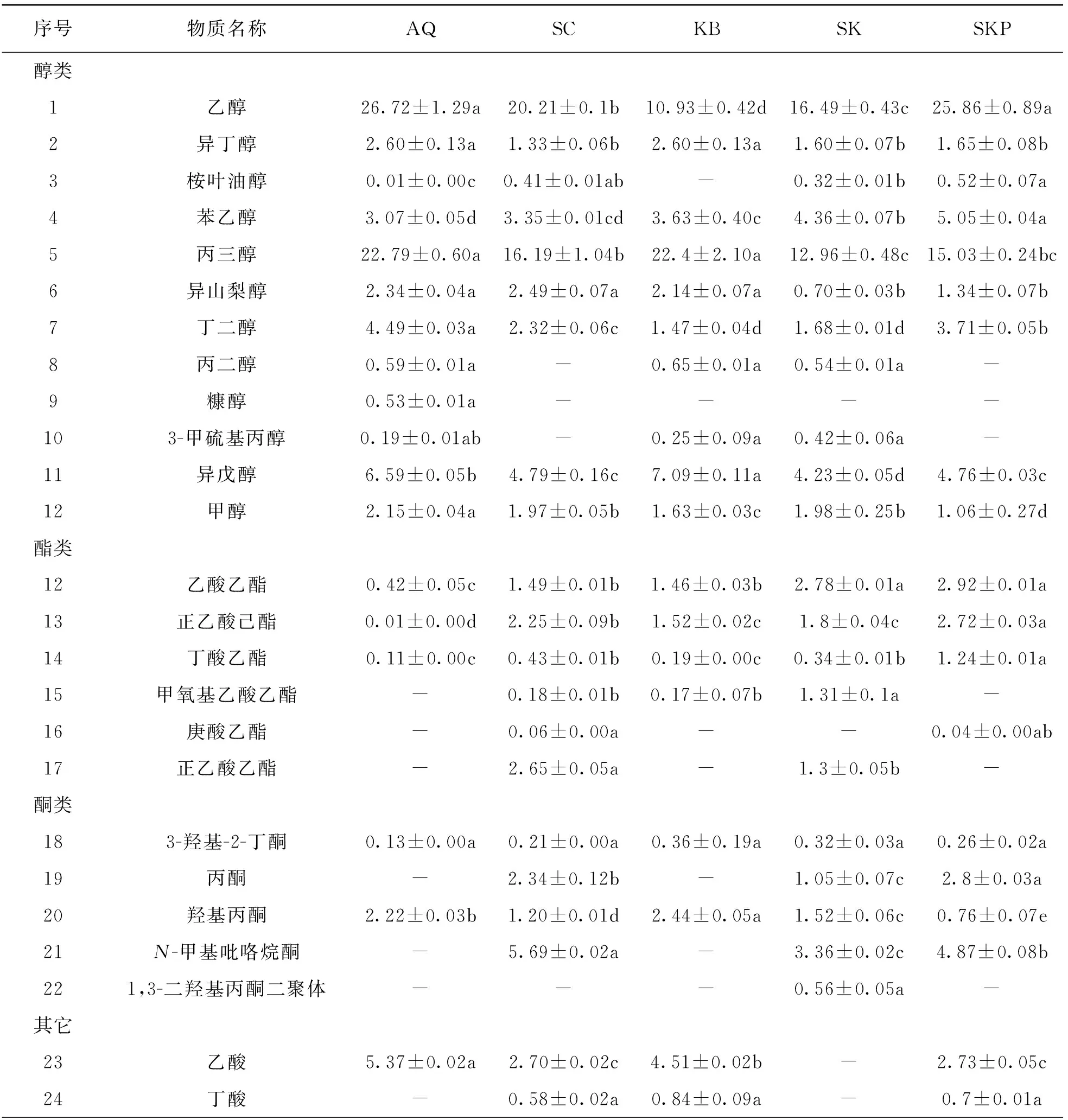
表2 不同发酵组主要挥发性物质相对质量浓度 /(mg·mL-1)
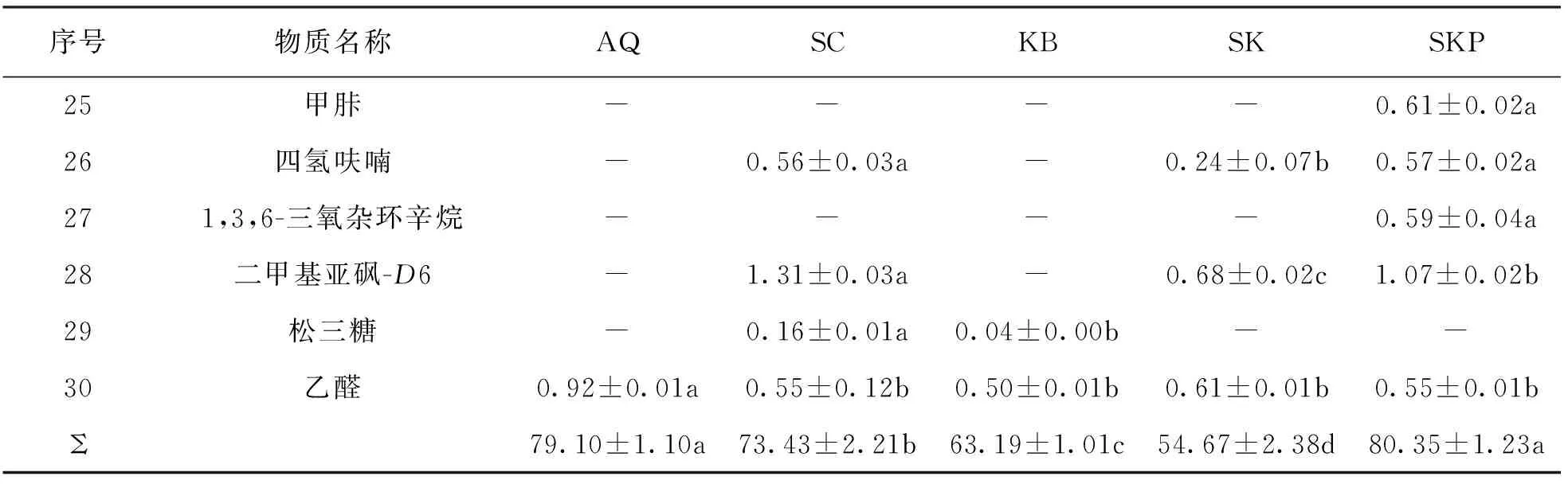
续表2
此外, 菠萝苹果复合果酒发酵过程中还产生了众多微量但对香气有贡献的化合物, 如3-羟基-2-丁酮、丙酮、羟基丙酮、乙醛和乙酸等, 而且, 发酵菌株不同, 风味物质的质量浓度也有显著差异.综上, 发酵菌种和多种风味物质在菠萝苹果复合果酒体系中相互作用, 相辅相成, 构成了风味独特的菠萝苹果复合果酒.
2.5 菠萝苹果复合果酒不同发酵组感官评价
菠萝苹果复合果酒的品质与其色泽、香气、口感等感官指标有关.感官评价发现, 混菌发酵SKP组的果酒色泽、香气、口感持久性和整体可接受性都较好(表3).SK组和SKP组菠萝苹果复合果酒的色泽和香气得分较高, 可能是由于不同菌种的互补作用, 减少了某些营养物质的损失, 进而提高了菠萝苹果复合果酒的色泽, 并增加了某些酯类、高级醇的积累.SKP组被认为酸度最低, 酒香、花香和奶油味较浓, 与前文总酸、有机酸分析结果一致, 而酒香、花香和奶油味较浓可能是与某些醇类、酯类物质及3-羟基-2-丁酮有关.KB组在色泽、口感和典型性方面得分较低, 总分为75.43±2.89分, 可能是因为库德里阿兹威毕赤酵母单发酵能力较弱, 导致发酵进程缓慢, 营养物质损失较多.综合来看, 酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌混菌发酵的菠萝苹果复合果酒颜色鲜艳, 香气丰满, 口感独特, 更受欢迎.

表3 不同发酵组感官评价得分
3 结论
本研究首次利用酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌发酵菠萝苹果复合果酒, 对比了不同菌种组合发酵组的理化特性、抗氧化性与风味物质的差异.相比于单菌发酵, 酿酒酵母、库德里阿兹威毕赤酵母与植物乳植杆菌混合发酵的SKP组改善了复合果酒的理化特性和抗氧化特性.研究还发现, 乙酸和乳酸是菠萝苹果复合果酒发酵产生的主要有机酸, 且乙酸乙酯、正乙酸己酯和丁酸乙酯等酯类物质丰富, 这有助于提升菠萝苹果复合果酒的香气复杂性.此外, 研究发现SKP组还含有丰富的苯乙醇、异丁醇和异戊醇等高级醇, 它们能赋予菠萝苹果复合果酒以花香、酒香和果香等积极特征.感官评价显示SKP组的果酒颜色清透、香气浓郁、口感酸甜适中.因此, 混菌发酵有助于改善菠萝苹果复合果酒品质.后续还可以针对菠萝苹果复合果酒的发酵工艺进行优化, 进一步探讨不同菌种接种量及接种顺序等因素对菠萝苹果复合果酒品质的影响.

