甘蓝型油菜IQM基因家族成员全基因组鉴定和分析
李桐舟, 章然风, 詹兰兰, 夏吉春, 张凯,王倩倩, 王文宁, 唐康, 徐新福
西部(重庆)科学城种质创制大科学中心/西南大学 农学与生物科技学院, 重庆 400715
甘蓝型油菜(BrassicanapusL.)是世界上最重要的油料作物之一, 对我国的油料供应至关重要, 其产量受到各种生物和非生物胁迫的影响[1].Ca2+作为高等植物细胞中最重要的第二信使之一, 在细胞生长、光合作用、气孔运动以及生物和非生物胁迫等一系列的生理生化活动中发挥着关键的作用[2-3].在高等植物细胞中存在着一系列的钙离子传感器, 外界环境的变化会改变细胞内钙离子的浓度, 而不同种类的钙离子传感器通过感知钙离子浓度的变化从而引发细胞内一系列的生理生化反应, 这就是存在于高等植物细胞中的钙信号通路[4].研究钙信号通路及其传感器蛋白基因对培育抗逆型甘蓝型油菜品种、提升油菜产量至关重要.
目前高等植物细胞中已经报道的钙离子传感器主要有4类: 钙依赖蛋白激酶(CDPK), 钙调磷酸酶-互作蛋白激酶(CBL-CIPK), 钙调素(CAM)和钙调素类似蛋白(CML)[5].CAM蛋白是一种螺旋蛋白, 包括两个配对的钙离子结合手型基序(Ca2+-binding EF-handmotifs).每个基序均含有保守的螺旋-环-螺旋(HLH)结构, CAM在与Ca2+结合后构象发生改变, 通过与下游钙调素结合蛋白(calmodulin-binding protein, CaMBP)相互作用, 激活广泛的靶蛋白, 参与不同的细胞过程, 从而调节植物的生理生化反应[6-7].
CaMBP依赖特定的基序与钙调素相互识别, 目前已经报道的3类保守识别基序(1-8-14基序, 1-5-10基序和IQ基序), 其中1-8-14基序, 1-5-10基序为Ca2+依赖型基序, 而IQ基序为Ca2+不依赖型基序.目前具有IQ基序的蛋白家族主要分为5类: 肌球蛋白家族、钙调素结合转录激活蛋白家族(CaMTA)、包含IQ67结构域的IQD家族、环核苷酸门控通道家族(CNGC)和IQ基序蛋白家族(IQM)[8].IQM家族最早由Zhou等[9]在拟南芥中鉴定出来, 家族不同于之前在植物中报道的其他含IQ基序的蛋白家族, 而是在具有IQ基序的同时, 还存在豌豆重金属诱导蛋白6基序(HMIP6)和天花粉蛋白同源结构域, 这是其家族成员的共有特征.拟南芥家族成员有不同的功能, 可能参与了高等植物中一系列的调控过程.据报道,ATIQM1和ATIQM4参与了ABA信号调控的气孔运动,ATIQM3,ATIQM5,ATIQM6参与了拟南芥花周期的成花调控[10-12].
综上,IQM基因家族在拟南芥的生理功能及其作用机制中得到了一定的揭示, 但在其他物种中该基因家族的研究较少.我们以芸薹属的甘蓝型油菜(B.napusL.)为主要研究对象, 对其进行全基因组分析, 在6种芸薹属作物中共鉴定了26个基因, 其中甘蓝型油菜中鉴定了7个基因.
1 材料与方法
1.1 基因的鉴定
拟南芥IQM蛋白序列基于Zhou等[9]鉴定的6个基因, 并从TAIR10[13]数据库(ftp.Arabidopsis.org)中下载其蛋白序列, 5种芸薹属植物全基因组数据和全蛋白序列下载自BRAD[14]数据库(http: //brassicadb.cn), 埃塞俄比亚芥(Brassicacarinata)全基因组数据和全蛋白数据来自2021年发布的埃塞俄比亚芥全基因组数据[15-16](https: //www.ncbi.nlm.nih.gov/).通过HMMER 3.0 程序[17], 基于拟南芥基因全蛋白序列多序列比对结果, 构建了基因特异性的隐马尔克夫模型(The Hidden Markov Model, HMM)[18]; 使用该模型在HMMER 3.0 程序中搜索6种芸薹属植物中可能为IQM家族的成员, 筛选E值小于0.001的成员, 随后在SMART(http: //smart.embl-heidelberg.de/)和PFAM(http: //www.pfam.org/)[19-20]数据库中进一步鉴定候选家族成员, 最终确定各物种的家族成员.
1.2 进化树分析
本研究基于6个芸薹属植物和拟南芥的基因家族成员全蛋白序列进行多序列比对和进化树分析, 使用的软件为MEGA11(Department of Biological Sciences, Tokyo Metropolitan University, Tokyo, Japan)[21], 并采用邻位相连法, 构建7个物种的无根系统发育树, Bootstrap初始值为1 000次.进化树的绘制使用Evolview软件2.0版本(https: //evolgenius.info//evolview-v2)[22].
1.3 基因与蛋白质结构分析
从BRAD数据库[14]下载甘蓝型油菜全基因组的GFF注释文件, 使用GSDS v2.0(http: //gsds.cbi.pku.edu.cn/)软件[23]进行基因结构分析, 通过MEME程序(Motif Educitation Multiple Expectation Maximization)[24]分析甘蓝型油菜IQM蛋白的保守基序, motif的最大数量定义为10, 宽度设置为6~200个残基.
1.4 染色体定位和共线性分析
基于甘蓝型油菜基因组注释文件中的信息, 将所有基因定位到对应染色体上; 采用MCScanX算法[25]进行共线性分析, 鉴定BnIQM基因间存在的串联重复和大片段复制; 使用TBtools工具[26]进行可视化并计算同义替换率(Ks)、非同义替换率(Ka)和分歧时间(t).
1.5 顺势作用元件分析和亚细胞定位
根据甘蓝型油菜注释文件提供的基因位置信息, 提取了甘蓝型油菜IQM家族2 000 bp的promoter序列, 提交到Plant CARE服务器[27], 分析promoter序列上具备的顺式作用元件并用TBtools工具[26]可视化; 使用wolf(https: //www.genscript.com/wolf-psort.html)[28]软件进行甘蓝型油菜基因的亚细胞定位预测.
1.6 蛋白互作网络分析
提取甘蓝型油菜基因全蛋白序列在STRING数据库(https: //string-db.org/)[29]中搜索与基因存在互作关系的甘蓝型油菜基因, 最低交互得分设定为0.400; 在芸薹属作物基因表达数据库BrassicaEDB(https: //brassica.biodb.org/)[30]中查询互作基因的功能注释, 根据搜索结果使用Cytoscape[31]软件绘制蛋白互作网络关系图.
1.7 组织表达分析
从BrassicaEDB数据库中查询甘蓝型油菜IQM基因家族成员在甘蓝型油菜ZS11生长周期各组织中和在胁迫下的表达量数据, 使用TBtools工具[26]将数据可视化.
2 结果与分析
2.1 IQM基因的鉴定和进化关系分析
使用6个拟南芥基因全长蛋白序列[9]作为模板, 搜索了6个芸薹属栽培种中存在的基因家族成员, 涵盖了3个二倍体种白菜(B.rapa)、甘蓝(B.oleracea)和黑芥(B.nigra)以及3个四倍体种甘蓝型油菜(B.napus)、芥菜型油菜(B.juncea)和埃塞俄比亚芥(B.carinata), 分别鉴定到了白菜5个、甘蓝4个、黑芥1个、甘蓝型油菜7个、芥菜型油菜5个、埃塞俄比亚芥4个, 共26个IQM基因家族成员(表1).
为了更好地研究IQM家族成员在拟南芥和芸薹属作物中的分子进化及系统发育关系, 建立了IQM家族成员的系统发育树(图1).根据系统发育树的结果,IQM家族可分为4个亚家族, 分别是IQM1,IQM2,IQM3和IQM4, 其中IQM2是拥有最多成员的亚家族, 共有17个成员, 占总成员的53.1%;IQM3和IQM4分别拥有5个和9个成员, 占15.6%和28.1%;IQM1仅有1个成员(AT3G52870), 占3.2%(表1).
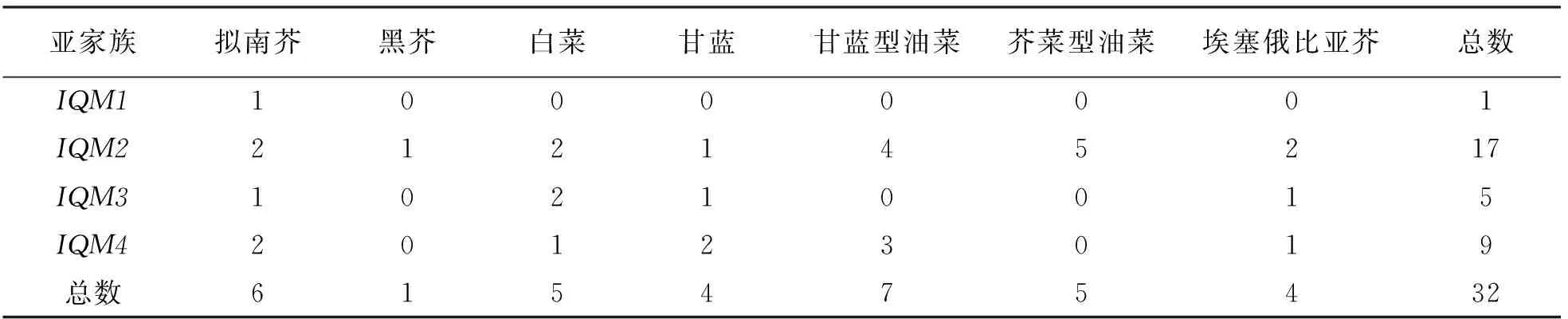
表1 拟南芥和6个芸薹属作物中IQM基因数量统计
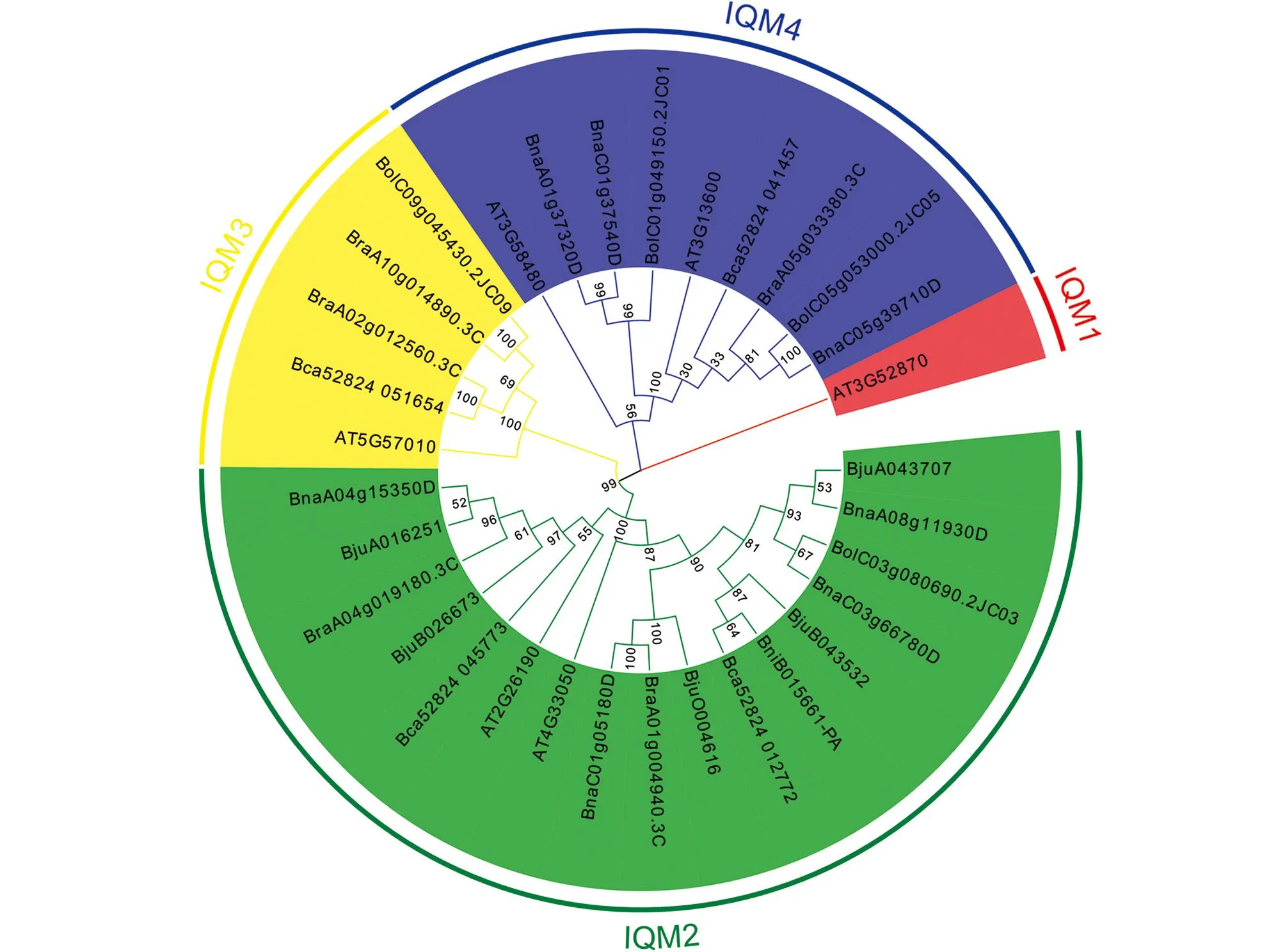
图1 拟南芥和6种芸薹属植物的IQM蛋白系统发育树
在系统发育树中, 我们发现甘蓝型油菜基因与白菜、芥菜型油菜和甘蓝存在直系同源(Orthologs)关系, 并发现了5对直系同源基因对(BnaA08g11930D/BjuA043707,BnaC03g66780D/BolC03g080690.2J,BnaC01g05180D/BraA01g004940.3C,BnaA04g15350D/BjuA016251,BnaC05g39710D/BolC05g053000.2J), 同时还发现BnaC01g37540D/BnaA01g37320D存在旁系同源关系.
研究甘蓝型油菜IQM基因家族成员的基本特征, 包括氨基酸数、等电点、蛋白分子量、编码序列长度和wolf亚细胞定位预测[28], 结果显示, 所鉴定的家族成员预测蛋白分子量范围为53 037.7~65 584.5 Da, 氨基酸数范围为463~575, 预测的等电点范围为6.02~9.01(表2).根据wolf数据库[28]亚细胞定位的预测结果,BnaA08g11930D定位在叶绿体, 其余6个成员均定位于细胞核.

表2 BnIQM蛋白理化特性
2.2 染色体定位和共线性分析
根据从BRAD[14]上得到的基因注释文件, 构建了甘蓝型油菜基因的染色体分布图(图2).结果显示,IQM基因家族分布在C01, C03, C05, A01_random, A04和A08染色体上, 其中C01分布了2个基因(BnaC01g37540D,BnaC01g05180D), 其余染色体上均分布1个基因.
为了理清甘蓝型油菜IQM家族的进化关系, 用 MCScanX软件[25]鉴定基因间的串联重复和大片段复制关系.共有4对基因存在大片段复制关系(BnaC01g37540D/BnaC05g39710D,BnaC01g05180D/BnaC03g66780D,BnaA08g11930D/BnaC03g66780D,BnaA08g11930D/BnaC01g05180D), 没有发现存在串联重复的基因对(图2), 这些结果表明基因在甘蓝型油菜中的扩张可能主要是由片段重复事件所导致.
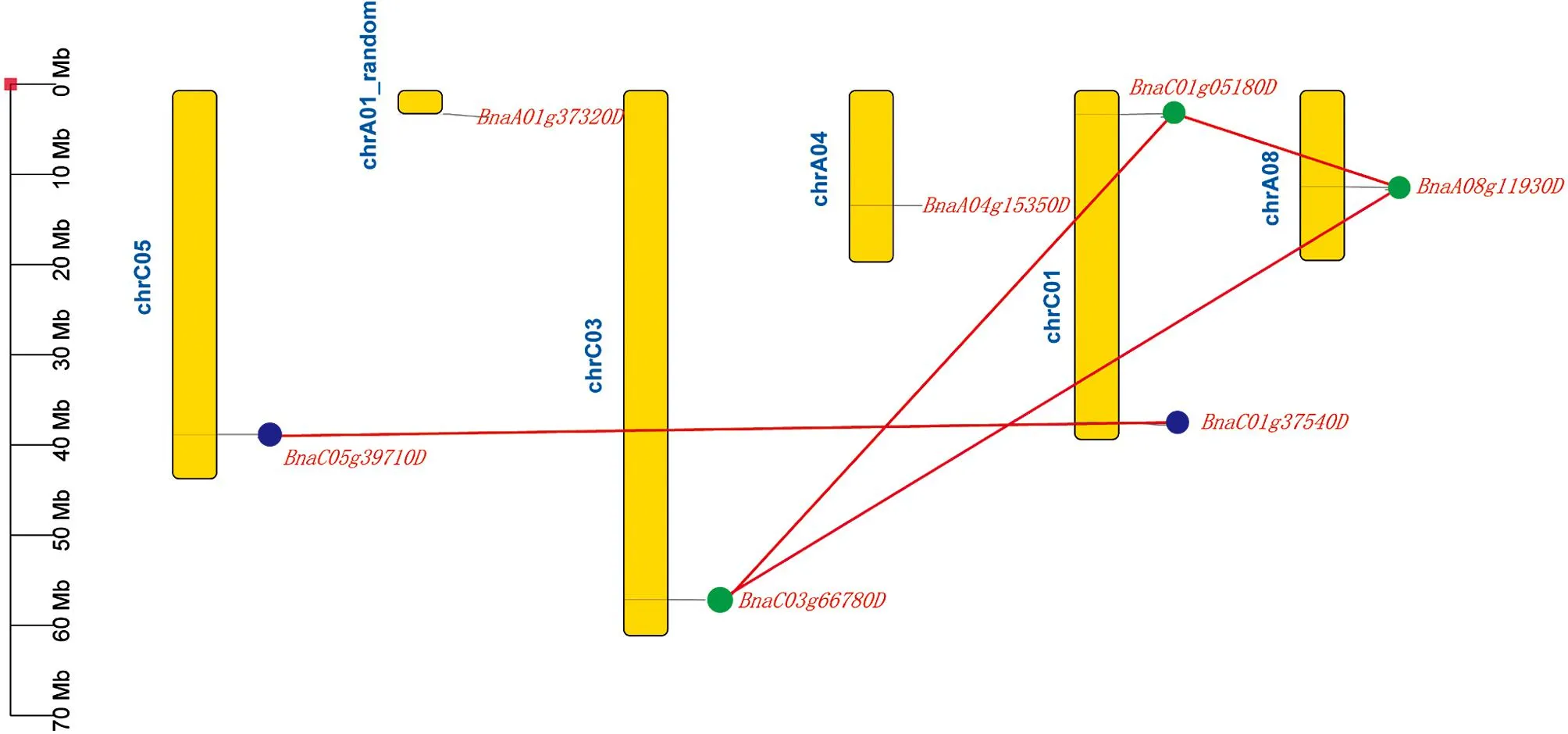
图2 BnIQM基因在甘蓝型油菜染色体上的分布和组内共线性分析
基于4对存在大片段复制的基因对, 计算了这4对基因的非同义替换率(Ka)、同义替换率(Ks)和Ka/Ks值(表3), 进一步研究了这些基因对所受到的进化选择情况.结果显示, 4对基因对的Ka/Ks均小于1, 表明这些基因受到的是自然选择.通过Ks值计算了这4对基因发生大片段复制的时间, 发现BnaC01g37540D/BnaC05g39710D是最早发生片段复制事件的基因对, 发生在距今1 310万年前, 而BnaA08g11930D/BnaC03g66780D的大片段复制事件发生在距今289万年前, 是距今最近发生的大片段复制事件.
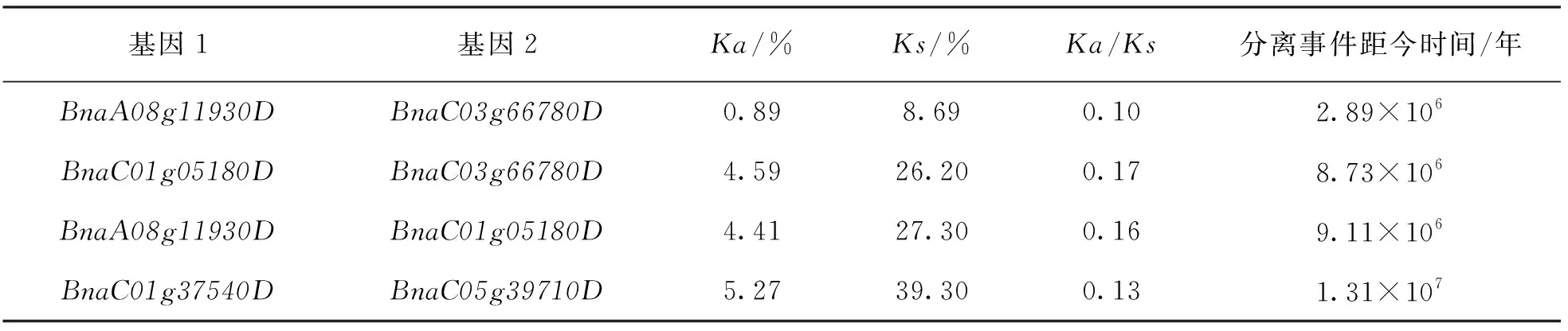
表3 基因间的进化选择事件
2.3 基因结构和保守基序分析
基因结构可以反映IQM基因的进化情况, 根据BRAD[14]提供的甘蓝型油菜注释信息构建7个甘蓝型油菜IQM基因结构图(图3), 并根据IQM基因的无根进化树进行排列.无根进化树显示甘蓝型油菜IQM基因可分为3个亚家族, 这3个亚家族分别包含3, 1, 3个成员.不同亚家族的外显子数量不同, 有6~10个不等, 其中属于亚家族Ⅰ的BnaC03g66780D和BnaA08g11930D的外显子最多, 拥有10个外显子, 同一亚家族之间外显子结构相似.使用PFAM和SMART数据库[19-20]对家族成员进行分析, 发现所有甘蓝型油菜IQM基因只含有IQ结构域, 且同一亚家族内IQ结构域的相对位置相似.

图3 BnIQM基因蛋白基序和保守结构域分析
采用MEME[24]程序鉴定IQM家族成员的保守Motif, 共鉴定了10个Motif, 我们将这些Motif命名为Motif 1~10(图3), Motif 7和Motif 8为亚家族Ⅰ和亚家族Ⅱ特有, 亚家族Ⅲ不具备这些Motifs.
2.4 顺势作用元件分析
为了研究甘蓝型油菜IQM基因在植物体内表达的调控机制和应激反应, 我们鉴定了甘蓝型油菜IQM家族2 000 bp的promoter序列上所具备的顺势作用元件(图4).检测到很多参与光响应的顺势作用元件, 如G-box, GA-motif, ATCT-motif, GATA-motif, I-box, TCT-motif和GT1-motif.这些promoter序列上还具备一些逆境响应元素, 主要有参与低温反应的顺式作用元件LTR、厌氧诱导所必需的顺式作用的调节元件ARE、干旱诱导MYB的结合位点MBS.

图4 甘蓝型油菜启动子中的顺势作用元件分析热图
2.5 蛋白互作网络分析
绘制BnIQM基因的蛋白互作网络关系图(图5), 研究IQM基因在甘蓝型油菜中参与的一系列生物过程.
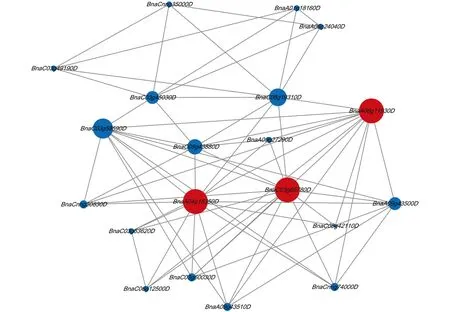
红色圆圈为甘蓝型油菜IQM基因, 蓝色圆圈为与BnIQM基因存在互作的甘蓝型油菜基因.
甘蓝型油菜中3个IQM基因(BnaA04g15350D,BnaC03g66780D,BnaA08g11930D)参与膜攻击复合体和穿孔素(MACPF)蛋白在植物体中的生理作用.据报道该蛋白在植物体抗生物和非生物胁迫过程中发挥了显著作用[32].BnaA04g15350D,BnaC03g66780D,BnaA08g11930D与4-香豆酸-辅酶a连接酶(4-Coumarate-CoA ligase, 4CL)合成基因存在互作, 该酶是苯丙烷途径的一个重要分支, 在植物抗旱和渗透胁迫中有重要作用[33].BnaA04g15350D,BnaC03g66780D,BnaA08g11930D与脂多糖诱导的肿瘤坏死因子-α(LITAF)蛋白存在互作, LITAF蛋白在植物的生物/非生物胁迫响应信号中发挥作用[34].BnaC05g39710D,BnaC01g37540D,BnaA01g37320D,BnaC01g05180D未发现互作映射.
2.6 BnIQM基因表达分析
绘制甘蓝型油菜IQM基因各生长期表达模式热图(图6), 研究IQM基因在整个甘蓝型油菜生活史中的表达情况.BnaC03g66780D,BnaA08g11930D在整个生长发育过程中的叶片均有较高的表达量;BnaC01g05180D在油菜盛花期的老叶, 以及成熟期的角果中有较高的表达;BnaA04g15350D在苗期的真叶, 以及成熟期的老叶中均有较高的表达;BnaC05g39710D,BnaA01g37320D和BnaC01g37540D的表达情况比较相似, 相对于其他成员在大部分受试器官和组织中表达水平相对较低, 但是在发芽期的幼根中表达量相对于其他器官和组织高.BnaA01g37320D和BnaC01g37540D在盛花期花序顶端的表达量相对其他器官和组织高.这些结果表明在甘蓝型油菜中不同亚家族的IQM基因表达模式存在差异, 且同一亚家族内表达模式相似.

图6 甘蓝型油菜IQM基因ZS11品种的RNA-seq表达谱分析
蛋白质互作网络分析的结果显示, 油菜IQM基因可能参与了植物体内多种抗逆境生理生化反应过程.我们在BrassicaEDB[30]中查询了甘蓝型油菜IQM基因在各种胁迫条件下的表达水平, 绘制BnIQM基因家族成员在ZS11的苗期叶片中干旱、高温以及低温胁迫下的表达谱热图(图7).
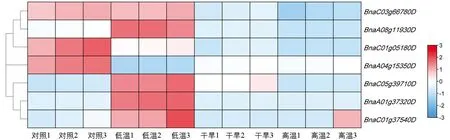
图7 BnIQM基因在不同胁迫处理下的表达量热图
发现所有甘蓝型油菜IQM基因在这些非生物胁迫下表达谱均发生了变化, 其中BnaC03g66780D在干旱条件以及热应激时表达量下调, 对冷应激不敏感.与之相反,BnaA08g11930D在冷应激条件下表达量上调, 对干旱胁迫以及热应激不敏感.BnaC01g05180D和BnaA04g15350D在3种处理下表达量均下调, 但是BnaC01g05180D在冷应激时下调量相对较少,BnaA04g15350D在冷应激时下调量相对较多;BnaC01g05180D在干旱和高温环境下表达量下调较大,BnaA04g15350D表达量下调相对较少.BnaC05g39710D,BnaA01g37320D和BnaC01g37540D在非生物胁迫下的表达模式相似, 除了BnaC05g39710D在干旱胁迫下表达量上调外, 均表现为冷应激下表达量上调, 在干旱和热应激下表达量大多下调.
3 讨论与结论
甘蓝型油菜作为世界上最重要的油料作物之一, 同时也是世界上第二大经济作物, 是由白菜(B.rapa)和甘蓝(B.oleracea)自然杂交形成的异源多倍体[35-37].甘蓝型油菜基因组的获得[14]为系统分析甘蓝型油菜基因家族铺平了道路, 因而很多家族得到了研究[38-41].IQM家族作为植物特异的基因家族广泛存在于许多植物中, 该家族自2010年在拟南芥中被鉴定[9]以来, 已经有研究报道了其参与植物中许多重要的生物学过程[10-12, 42-43], 但该家族在拟南芥以外物种中的研究, 除了水稻(OryzasativaL.)外还鲜有报道[44], 人们对于IQM家族的了解还不够全面.
对BnIQM进化分析结果表明, 芸薹属中基因数量少于预期[45-46], 拟南芥基因在进化过程中发生了丢失事件.在组内共线性分析中, 我们发现片段复制是BnIQM基因扩张的主要方式, 在组内进化过程中受到自然选择.
根据BnIQM的基因结构和蛋白保守基序结构, 可以将BnIQM分为3个亚家族, 同一亚家族之内结构相似度较高, 亚家族之间有一定的差异.所有的IQM家族成员在编码IQ结构域的Motif 3上高度保守, 该基序与豌豆重金属诱导蛋白6(HMIP6)[9]相关, 存在Motif 7和Motif 8这种亚家族Ⅰ和亚家族Ⅱ特有的基序, 这在一定程度上反映了BnIQM基因间的进化关系.
据报道, 基因在拟南芥中参与了植物体的气孔运动和成花调控等生理活动[10-12].在本研究中,BnIQM基因2 000 bp的promoter序列上具备多种光响应元件、非生物胁迫的响应元件, 同时蛋白互作关系显示部分BnIQM基因参与了多个响应生物与非生物胁迫过程.在表达分析中, 发现不同的甘蓝型油菜基因在甘蓝型油菜生活史中的表达模式存在一定差异, 具有明显的组织特异性, 并且亚家族内基因表达模式相似,BnaA01g37320D和BnaC01g37540D在盛花期花序顶端的表达量相对其他成员明显较高, 这表明它们可能参与了甘蓝型油菜的成花调控; 同时BnIQM基因普遍对非生物胁迫存在响应.结合以上结果, 我们认为甘蓝型油菜基因可能通过与拟南芥中相似的途径参与了甘蓝型油菜抗非生物胁迫的响应过程, 各基因在进化的过程中功能发生了一定的分化.
本研究系统研究了芸薹属(Brassica)植物中的IQM基因家族, 揭示了芸薹属中基因的进化情况, 初步研究了甘蓝型油菜基因的特性, 为后续进一步研究这些基因的功能提供了参考, 有利于人们利用这些基因的特性, 提升甘蓝型油菜的抗逆性和产量.

