基于风险的医疗器械临床试验实施的规范化管理
刘红艳,董黎娜
解放军第九六○医院 (山东济南 250031)
医疗器械临床试验是以探索拟申请注册医疗器械的疗效和安全性为目的而进行的系统性研究[1-2]。2018 年我国开始实行“医疗器械临床试验机构备案制”,但在实施医疗器械临床试验中常出现经验不足、风险意识缺乏。对试验方案的依从性不佳等问题,使医疗器械注册受阻等[3-5]。因此,正确评估医疗器械临床试验为目前行业研究的重点。
风险管理是将项目风险降低至最低的管理过程,包括对风险的识别、评估和应变策略等[6-7]。风险管理策略目前已广泛应用于医学领域,但专业科室对医疗器械临床试验的风险评估甚少。我科从2010 年开始承接医疗器械临床试验工作,并于2018 年8 月成功备案为医疗器械临床试验专业科室,并积极引入风险管理理念,对医疗器械临床试验进行风险规划、识别、分析及处理。本研究从专业科室的角度,分析医疗器械临床试验实施中各要素的风险点,以降低风险事件发生率或影响,加强专业科室项目实施的高质量、规范化管理。
1 资料与方法
1.1 成立临床试验风险管理小组
成立临床试验风险管理小组,由科主任担任组长,3 名临床医师和2 名机构质控员作为骨干,负责临床试验的日常管理工作,制定风险管理策略。
1.2 风险评估
根据临床试验的相关法规、机构和专业制度文件、临床试验实施流程等,收集和识别风险要素,对其进行风险评估,确定风险等级,制定并落实风险防范策略。
1.3 风险识别
基于医疗器械临床试验实施流程及关键要素,应用情景分析法和检查表法,参照《医疗器械临床试验质量管理规范》[8]、《医疗器械临床试验现场检查要点及判定原则》[9],结合国家及各省药监局现场检查问题通告[3,10-16]、机构质控发现问题等,由风险管理小组成员系统梳理临床试验流程中的风险事件,进行风险识别。
1.4 风险事件影响程度和可能性评估标准
采用定性分析方法,对风险事件影响程度和发生可能性进行评估[6]。风险影响等级根据风险对试验质量和受试者权益造成的影响程度,设定5 级,评估标准见表1。风险发生可能性设定5 级,赋值标准见表1。

表1 风险事件影响程度和可能性评估标准
1.5 风险等级评价标准
利用风险评估矩阵表对风险的影响程度和发生可能性进行二维计算[6],确定其风险等级,对应各类风险因素的优先管理顺序和策略。低风险(分值<5 分)属于可承担风险,无需增加额外控制措施;中低风险(5 分≤分值<10 分),对潜在风险予以关注,必要时定期监测;中风险(10 分≤分值<15 分),对潜在风险予以关注及定期监测,必要时追加风险措施;中高风险(15 分≤分值<20 分),制定规避或转移的风险措施,且优先实施;高风险(分值>20 分),立即制定针对性风险措施,并准备风险发生应急预案。
2 成效
2.1 风险要素
风险管理小组成员应用情景分析法和检查表法,梳理风险因素及可能发生的风险事件,涉及7 个核心环节共34 项风险要素:包括知情同意(7 项)、项目实施(5 项)、器械管理(6 项)、不良事件(4 项)、试验数据(4 项)、试验资料管理(3 项)、质量控制(5 项),见表2。
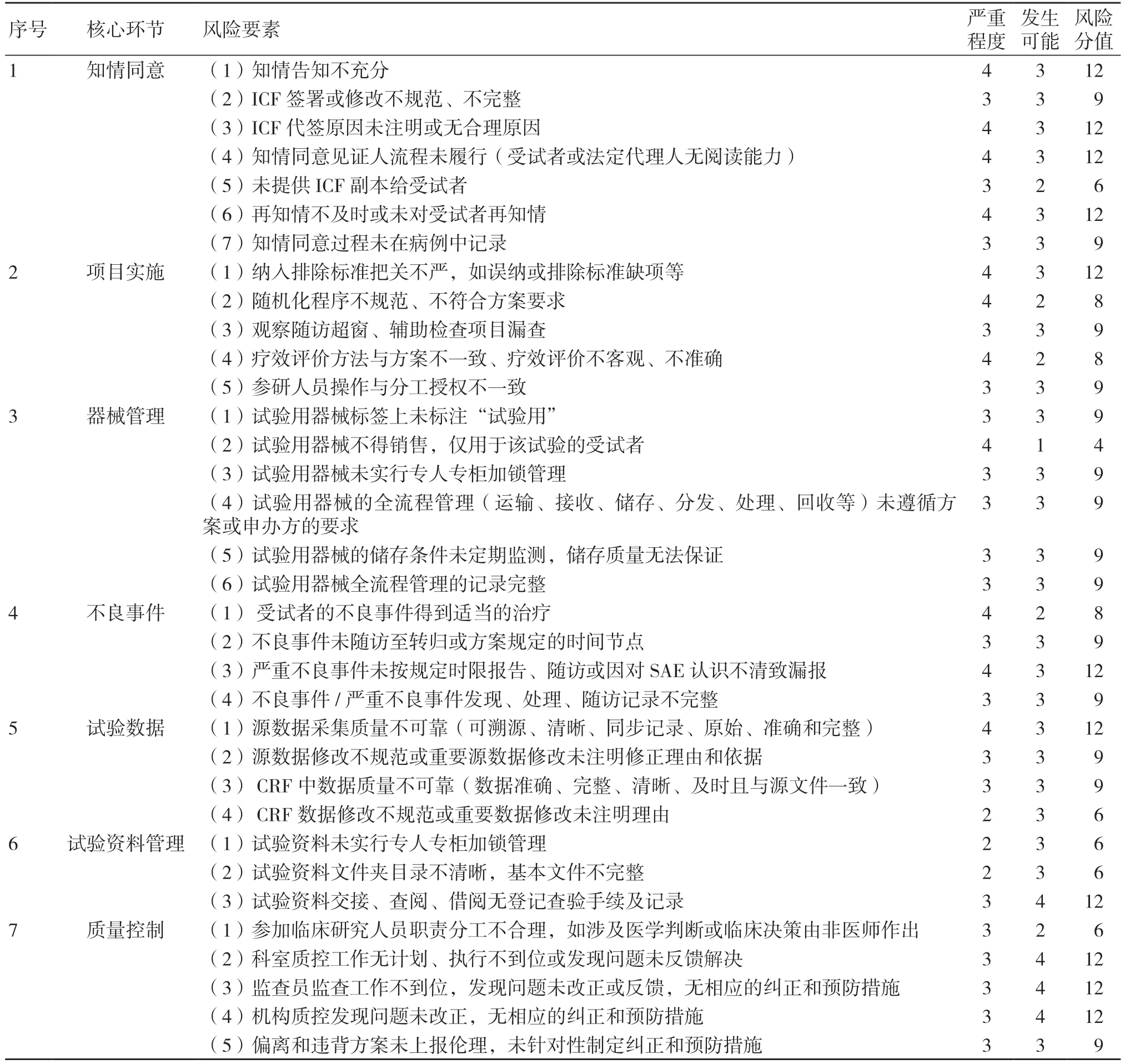
表2 专业科室试验实施风险管理要素评估表
2.2 风险因素的影响程度及发生可能性
风险管理小组定性确定风险因素的影响程度及发生可能性。34 项风险要素中,影响程度确认低、中、重要、严重、灾难5 级风险因素依次为0 项、3 项、20 项、11 项、0 项;发生可能性确认“几乎不可能”1 项,“不可能”5 项,“有可能”24 项,“很可能”4 项,“一定”0 项,见表2。
2.3 风险等级评价及分析
34 项风险要素中,分为高风险0 项、中高风险0 项、中风险11 项(其中知情同意环节4 项、项目实施环节1 项、不良事件1 项、试验数据1 项、试验资料管理1 项、质量控制3 项);中低风险22 项(其中知情同意3 项、项目实施4 项、器械管理5 项、不良事件3 项、试验数据3 项、试验资料2 项、质量控制2 项);低风险1 项,见表2。
2.3.1 知情同意
7 项要素中4 项中风险,3 项中低风险。知情同意涉及受试者权益,因此风险事件严重程度均为“严重”或“重要”。该部分是外科研究者易忽视的环节,如手术当天签署知情同意书、无充分理由家属代签、再知情不及时等不规范行为时有发生,因此风险可能性为“有可能”。知情同意书作为法律文书提供副本给受试者,该项触及法律底线,发生“不可能”。
2.3.2 项目实施
5 项要素中1 项中风险,4 项中低风险。项目实施的关键环节,如纳入排除、筛查、随机、随访、疗效评价等,风险严重程度评价为“严重”或“重要”。研究者将试验纳入排除、随访等同“临床常规”执行,导致误纳、超访视窗、检查漏项等问题出现,如纳入受试者年龄超入组标准上限年龄0.5 岁,或排除标准某项检查缺项即入组等,发生可能性评估为“有可能”。对于随机化、疗效评价等类同于科研行为,发生风险为“不可能”。
2.3.3 器械管理
6 项要素中5 项中低风险,1 项低风险。试验器械作为临床试验的核心,其风险的影响程度均为“严重”或“重要”,也是器械核查通告中常见问题。试验用器械标签上标注“试验用”,但基于申办方良莠不齐,其风险发生为“有可能”;试验器械不得销售,仅用于受试者,发生为“几乎不可能”;试验器械实行专人专柜管理,但受限于客观设备及人员条件,发生为“有可能”;试验器械应实行全流程闭环管理,从运输、接收、储存、维保、分发、处理、回收等应遵循方案,但方案中常对器械管理要点模糊不清,未详尽阐述,导致研究者实际操作缺少规程可依,因此器械管理及记录的风险发生为“有可能”;试验用器械的储存条件监测,研究者和申办者易忽视,导致非规定条件下产品质量无法保证,风险发生为“有可能”。
2.3.4 不良事件
4 项要素中1 项中风险,3 项中低风险。 根据《医疗器械临床试验现场检查要点及判定原则》[9],瞒报与临床试验用医疗器械相关的严重不良事件和可能导致严重不良事件的医疗器械缺陷,判定为存在真实性问题。因此,该部分风险的影响程度均为“严重”或“重要”。不良事件治疗作为医疗常规,风险发生为“不可能”。但不良事件的随访、严重不良事件(serious adverse event,SAE)报告以及记录等,研究者可能由于认识不足发生偏离违背方案情况,如不良事件未随访至方案要求的节点,SAE 由于个人理解导致漏报或晚报等,风险发生“有可能”。
2.3.5 试验数据
4 项要素中1 项中风险,3 项中低风险。试验数据是评价试验结果的重要依据,如临床试验数据(纳入排除标准、主要疗效指标、重要的安全性指标等)不能溯源,被认为存在真实性问题。试验数据分为源数据和病例报告表(case report form,CRF)转抄数据。源数据应可溯源、清晰、同步记录、原始、准确和完整,是原始数据的基本特征。源数据的载体是原始文件,原始文件的记录要求高于临床常规,所以出现研究者漏记、漏报、漏签字现象,因此原始数据风险的严重程度评价为“严重”或“重要”,可能性为“有可能”。CRF 数据作为二次数据,应准确、完整、清晰、及时,且与源文件一致。
2.3.6 试验资料管理
3 项要素中1 项中风险,2 项中低风险。试验资料作为临床试验事实的最终载体,可完整再现临床试验过程,应对其进行专人专柜及资料流通的闭环管理,如资料交接、查阅、借阅等执行登记核对手续,该部分风险的严重程度评价为“重要”或“中”,目前科室资料管理制度文件尚不完善,发生为“有可能”或“很有可能”。
2.3.7 质量管理
5 项要素中3 项中风险,2 项中低风险。质量管理是临床试验风险管控的重要环节,包括专业及机构的质量控制等。应建立覆盖试验全流程的标准操作规程,使各步骤操作均有据可依,是保证质量管理的重要前提。
3 讨论
梳理并归类专业科室医疗器械临床试验实施的风险要素,进行风险规划与识别,是风险管理的关键环节。项目实施阶段风险等级评估划分综合考虑对试验质量、受试者权益、法规及制度文件的依从性,通过梳理各流程中风险事件的影响严重程度和风险因素的发生概率,认为项目实施管理中的风险产生于可预见的领域,属于管理工作中的系统风险,对专业内承接的每个项目产生系统性影响。
3.1 临床试验实施阶段的风险处理措施
专业科室基于项目试验实施的关键环节,遴选34 项风险因素,对可能出现的潜在风险事件进行定性分析,并确定风险等级。根据风险等级不同,制定分级控制或预防措施,以便及时抓住风险处理的最佳时机,做到早预防、早控制,降低风险的发生率或减弱风险的影响。
3.1.1 中风险事件
对潜在风险予以关注及定期监测,必要时追加风险措施。针对性修订专业科室标准操作规程(standard operating procedure,SOP)文件,弥补管理漏洞,降低风险发生率。(1)知情同意:讨论修订SOP 文件中知情同意时间(至少术前1 d)要求、法定代理人代签适用条件、见证人制度适用条件、再知情时间、知情过程病例记录要求,并对研究者进行充分培训及考核;(2) 纳入排除标准:根据试验风险必要时建立“纳入排除标准复核制度”,指定专人进行,保证纳入排除准确;(3)严重不良事件(serious adverse event,SAE):强化SAE 定义、报告、原始记录、随访、总结及SAE漏报的法律后果等,列举典型案例分析,以提高对SAE 的敏感度、认知能力和法规意识;(4)资料管理:建立覆盖资料流通全过程的闭环管理制度,强化研究者对资料的风险管控;(5)质量管理:试验前利用项目协调会,研究者、机构质控人员等共同讨论完善项目实施各步骤的标准操作规程。
3.1.2 中低风险事件
对潜在风险予以关注,必要时定期监测。(1)针对风险主题制订相应措施,构建启动会从筹备到组织实施评价的全流程管理,包括启动会前准备,多样化的启动培训模式,实现启动会培训效果最大化。(2)建立覆盖试验用器械管理与使用全周期的SOP 文件。针对各项目试验用器械的流通环节,建立从接收、存储、发放、使用、回收、维修校验等全流程管理的标准操作规程,保证试验用器械的质量并仅用于受试者;建立试验用器械的培训体系,必要时利用学习曲线,保证器械的规范操作,最大程度降低试验操作风险;建立试验用器械的质量控制、不良事件监控及应急预案,保证器械使用的安全有效。(3)强化专业科室的培训及建设。强化研究团队成员对风险的预估、评价与管控意识,将风险管理融入临床试验专业建设理念中。(4)评估项目风险发生率:将34 项风险要素列入项目结束质控标中,评价风险管控效果以及优化风险管控措施。
3.1.3 低风险事件
属于可承担风险,无需增加额外控制措施。必要时强化相关的管理制度和 SOP 的熟悉度和依从性。
3.2 系统层面的风险管理措施
(1)完善体系建设,明确执行标准。规范、完善的制度文件体系是风险规避的重要措施。制定具有可行性的标准操作规程,确保试验各流程均有标准可参照执行。(2)多举措提高研究者的依从性。针对关键薄弱环节,设置监督复核制度,提高研究者的被动依从性,降低风险发生率,如纳入排除标准专人复核等;明确方案偏离/违背的处置措施。(3)加强申办者的临床试验能力考察。主要是风险转移措施,将申办方研发团队能力列入项目遴选考量重点;将第三方稽查作为高风险器械项目重要的质量保证手段列入合同。(4)重视受试者权益的保护。试验前研究者应熟悉试验用医疗器械的原理、适用范围、产品性能及操作方法,掌握临床试验可能产生风险的防范及紧急处理方法,演练相关应急预案的处理流程,加强应对紧急事件的能力;试验实施中对受试者充分知情告知,保障其知情权、隐私权等;试验过程中严密监控安全事件,及时发现各种可疑点和安全隐患,力求使受试者最大程度受益和尽可能避免伤害,见表3。

表3 专业科室系统层面的风险管控措施
4 结论
临床试验是一项政策性、法规性极强的工作,医疗器械临床试验风险是客观存在的,因此要求工作人员熟悉临床试验相关法规,严格执行试验方案。风险管理的关键是预先梳理并归类风险要素,筛选高风险实施环节,有效进行风险规划与识别,整体提高专业体系建设的风险管理水平。本研究通过分析医疗器械试验实施阶段中研究者所面临的各类风险,并对如何管控和最小化风险提出建议,以期强化风险预估、评价与管控意识,并采用分级管控策略最大程度地优化试验各方资源,以提高试验水准,达到保护受试者安全和提升试验质量的目的,同时为专业科室临床试验实施规范化管理提供借鉴。

