基于RBL-2H3细胞脱颗粒抑制作用的体外抗过敏活性益生菌的筛选及鉴定
马 丁,秦双霞,郝慧超,邓放明,2,*,赵玲艳,2,*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南农业大学长沙现代食品创新研究院,湖南 长沙 410128)
过敏是由免疫系统紊乱和超敏反应引起的炎症性疾病[1]。根据世界卫生组织的统计,过敏的发病率呈逐年上升的趋势,成为全球健康领域面临的重要挑战之一[2]。目前,过敏尚无有效的治疗方法,患者只能依靠药物缓解过敏性疾病,或避免接触环境和食物中的过敏原。由于药物存在一定的副作用,同时致使过敏反应的过敏原难以确定,导致过敏症难以治疗[3]。过敏反应根据其机理可分为I、II、III、IV型,绝大部分过敏疾病与I型过敏反应相关[4]。I型过敏反应又称即时性过敏反应,症状在接触过敏原后几小时内出现[5]。随着过敏反应的发生体内会产生免疫球蛋白E(immunoglobulin E,IgE)以消除过敏原。IgE与肥大细胞表面的高亲和力IgE受体(highaffinity IgE receptor,FcεRI)结合,并导致大量的化学介质(如组胺(histamine,HIS)和白三烯)释放到细胞外,这一过程称为“脱颗粒”[6-7]。所释放的化学介质导致组织产生过敏的症状。因此,抑制IgE介导的肥大细胞脱颗粒能有效的预防和治疗过敏性疾病。
益生菌被定义为对宿主提供健康益处的活的微生物。近年来,益生菌已被报道具有各种生理作用,对各种疾病如胃肠道疾病、代谢紊乱、血清胆固醇升高、肿瘤和过敏等具有有益作用。Wu等[8]研究了鼠李糖乳杆菌GG(Lactobacillus rhamnosusGG,LGG)对卵白蛋白(ovalbumin,OVA)致敏的哮喘小鼠的影响。研究结果表明,LGG可以降低过敏小鼠的辅助T细胞2(T helper 2,Th2)的反应,改善受损的肠上皮屏障功能。Song等[9]证实了植物乳杆菌L67能够抑制暴露于双酚A的RBL-2H3细胞中炎症因子的表达,以及镉处理后的RAW 264.7细胞中炎症因子的表达。此外,研究发现,益生菌产生有益作用的成分主要来自其细胞内源物质和细胞代谢成分,如脂磷壁酸、短链脂肪酸、胞外多醣、遗传物质、多肽、有机酸等物质[10-12]。这些研究表明,益生菌是一种预防和治疗过敏的新方法。因此,本研究通过体外抗逆性、黏附性、抑菌性、体外安全性4 个指标对菌株益生特性进行评价,然后通过RBL-2H3细胞脱颗粒实验筛选具有抗过敏活性的益生菌,并进行鉴定,旨在为菌种资源的综合利用和益生菌抗过敏活性的研究提供依据。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(ATCC 6538)、铜绿假单胞菌(ATCC 27853)、单核细胞增生李斯特菌(ATCC 19115)、鼠伤寒沙门氏菌(ATCC 14028)、鼠李糖乳杆菌(ATCC 53103)、Caco-2细胞(ATCC HTB-37)美国典型培养物保藏中心;大肠杆菌(CGMCC 9181)中国普通微生物菌种保藏管理中心。
血平板、生物胺试剂盒、MRS肉汤、明胶培养基、琼脂、革兰氏染色试剂盒、牛胆盐等 广东环凯微生物科技有限公司;胃蛋白酶(3 000~3 500 U/g)、牛磺胆盐北京索莱宝科技有限公司;胰蛋白酶(≥50 000 U/g)国药集团化学试剂有限公司;碱性磷酸酶(alkaline phosphatase,ALP)试剂盒 上海碧云天生物技术有限公司;抗生素试剂盒 杭州微生物试剂有限公司;24、96 孔板 无锡耐思生命科技股份有限公司;抗-二硝基苯酚(anti-dinitrophenol,anti-DNP)IgE、二硝基苯基化人血清白蛋白(dinitrophenylated human serum albumin,DNP-HSA)西格玛奥德里奇(上海)贸易有限公司;HIS、白介素-4(interleukin 4,IL-4)、肿瘤坏死因子-α(tumour necrosis factor α,TNF-α)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(96 T)上海泛柯实业有限公司;细菌基因组DNA快速抽提试剂盒、针式滤菌器 默克投资(中国)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物 上海派森诺生物科技股份有限公司;D4030A dNTP、DRR20AM TaKaRa LATaqTM聚合酶 宝日医生物技术(北京)有限公司。
1.2 仪器与设备
PHS-2F pH计 上海仪电科学仪器有限公司;全套精密移液枪 艾本德(上海)国际贸易有限公司;SQ810C自动高压蒸汽灭菌器 重庆雅玛拓科技有限公司;YP-B10002电子天平 上海光正医疗仪器有限公司;HCB-1300V洁净工作台 青岛海尔生物医疗股份有限公司;CX31光学显微镜 奥林巴斯(中国)有限公司;ULTS1368超低温冰箱、Heraeus MultifugeX1R高速冷冻离心机、涡旋振荡仪 赛默飞世尔科技(中国)有限公司;SPL250生化培养箱 天津市莱玻特瑞仪器设备有限公司;Spark多功能酶标仪 瑞士Tecan公司;MNT-150游标卡尺 上海美耐特实业有限公司;UV-1801分光光度计 北京北分瑞利分析仪器(集团)有限公司。
1.3 方法
1.3.1 乳酸菌的分离、菌悬液和发酵上清液的制备
乳酸菌的分离:发酵蔬菜样本以10 倍梯度稀释,涂布于含0.5 g/100 mL CaCO3的MRS固体平板上,并在37 ℃生化培养箱内恒温培养48 h。培养结束后,选取具乳酸菌特征、溶钙圈及革兰氏染色阳性菌落进行纯化处理。纯化菌株需编号并于4 ℃冰箱中保存以备后续使用。
菌悬液的制备:选取菌株以1%的接种量接种于MRS培养基,37 ℃培养24 h并进行2 代培养。取出菌液在4 ℃、9 800×g条件下离心3 min,弃上清液保留菌体。用10 mL生理盐水清洗菌体两次,重复离心并弃去上清液。用生理盐水悬浮菌体,检测OD600nm,若低于0.8则增加菌体,高于0.8则稀释,直至达0.8。最后,密封良好后于4 ℃冰箱贮存。
发酵上清液的制备:选取菌株以1%的接种量接种于MRS培养基,然后在37 ℃条件下培养24 h,进行两代培养以确保菌株充分生长。培养完毕后,将菌液在4 ℃、9 800×g离心3 min,小心倒出上清液转至新离心管。用滤菌器去除残菌,得清液。再用无菌NaOH溶液将上清液调至中性pH值,持续检测以确保范围。调整后,将上清液转移到标记的无菌试剂瓶中,并贮存于4 ℃冰箱备用。
1.3.2 耐酸和耐胆盐实验
在菌株经过两代活化后,选择最后一代培养12 h的菌株进行接种。对于每个待测菌株,分别以3%接种量接种到两种不同的MRS液体培养基中:一种为调整至pH 2的MRS液体培养基;另一种为含有3.0 g/L牛胆盐的MRS液体培养基。随后将接种好的培养基放入恒温培养箱,在37 ℃条件下培养12 h。将两种培养基中均呈浑浊状态的菌株选为耐酸和耐胆盐的候选菌株。记录呈浑浊状态的菌株编号。
1.3.3 模拟胃肠液实验
模拟胃液制备:通过在磷酸缓冲溶液(phosphate buffered solution,PBS)(pH 2.0)中混合胃蛋白酶(0.3 mg/mL),然后通过针式滤菌器过滤对PBS-胃蛋白酶混合物进行无菌处理制备。模拟肠液制备:在PBS(pH 6.8)中加入胰蛋白酶(0.1 mg/mL),然后通过针式滤菌器对PBS-胰蛋白酶混合物进行无菌处理。将菌悬液以1%接种量分别接种到模拟胃液或模拟肠液中,37 ℃培养3 h后,通过平板计数确定存活细胞的数量。菌株存活率计算如式(1)所示:
式中:A0为0 h活菌数量的对数值;A1为3 h活菌数量的对数值。
1.3.4 抗菌活性测定
抗菌活性采用牛津杯法进行测定,以金黄色葡萄球菌(ATCC 6538)、铜绿假单胞菌(ATCC 27853)、单核细胞增生李斯特菌(ATCC 19115)、鼠伤寒沙门氏菌(ATCC 14028)、大肠杆菌(CGMCC 9181)为指示菌株。
1.3.5 菌株表面特性测定
1.3.5.1 疏水性
通过测量微生物对乙酸乙酯和氯仿的亲和力评估。将1 mL乙酸乙酯和1 mL氯仿分别加入到3 mL菌悬液中,并用涡旋混合仪振荡混合。然后,水相和有机相在室温分离30 min。去除水相,并测定OD600nm,以LGG为对照菌株。其疏水性计算如式(2)所示:
式中:A0为初始菌悬液的OD600nm;A1为有机相的OD600nm。
1.3.5.2 自聚集能力
将菌悬液涡旋10 s,随后室温孵育5 h,并测定新的OD600nm,以LGG为对照菌株。其自聚集能力计算如式(3)所示:
式中:A0为初始菌悬液的OD600nm;A1为处理5 h的OD600nm。
1.3.5.2 共聚集能力
将等体积待测菌菌悬液和致病菌菌悬液的浓度均调整为1×108CFU/mL,同时制备同浓度LGG菌悬液作对照。将待测菌混合单核细胞增生李斯特菌与大肠杆菌,涡旋混合10 s,孵育5 h观察共聚集。结束后,轻取上层悬液放入无菌试管,避免扰动共聚集细胞。最后测定OD600nm。其共聚集能力计算如式(4)所示:
式中:A1为受试菌与致病菌菌悬液混合5 h后的OD600nm;A2和A3分别为受试菌与致病菌菌悬液单独处理5 h的OD600nm。
1.3.6 Caco-2细胞实验
1.3.6.1 Caco-2细胞培养
从液氮中解冻Caco-2细胞,转移到无菌培养瓶中,并加入含20%胎牛血清的DMEM培养基,置于5% CO2、37 ℃培养箱内。每2 d更换一次培养基,保持无菌操作。细胞融合度为80%~90%时,用PBS洗涤,0.25% 胰蛋白酶-EDTA消化脱落。停止消化后,转移到无菌离心管离心收集,弃上清液,用新DMEM重新悬浮细胞。适当比例分配到新培养瓶继续培养,3 次传代后进行实验。
1.3.6.2 Caco-2细胞黏附实验
在24 孔板中,将Caco-2细胞悬液(5×104个/mL)250 µL培养至单层,使用无菌PBS洗涤两次。将菌悬液添加并孵育2 h以实现相互作用。去除悬液,用无菌PBS液冲洗3 次,清除未附着菌体。然后以平板计数法测量细胞上的细菌数量,评估菌株黏附性。黏附率计算如式(5)所示:
1.3.6.3 对Caco-2细胞ALP活性的测定
参照Lv Jia等[13]的方法,将长至单层Caco-2细胞与3 个处理组(鼠伤寒沙门氏菌(S)、受试菌、受试菌+S)和1 个仅用完全培养基处理的对照组在5% CO2、37 ℃培养箱中孵育2 h。孵育后,在4 ℃条件下以1 500 ×g离心10 min后收集细胞培养物的上清液,使用ALP试剂盒测定收集的上清液中细胞外ALP的活性。
1.3.7 安全性评价
1.3.7.1 溶血性
参考文献[14]评估菌株的溶血性。将已经纯化的菌株涂抹在含有体积分数5%绵羊血的血琼脂平板上,每个菌株在单独的平板上进行涂抹。在涂抹过程中,确保菌株分散均匀且不重叠。完成涂抹后,将平板倒置放入37 ℃恒温培养箱,培养48 h,之后从培养箱中取出血琼脂平板,观察平板上菌落的溶血情况。
1.3.7.2 明胶酶活性
将活化好的受试菌用接种针穿刺接种到明胶培养基中,并在37 ℃培养24 h。然后将接种物于4 ℃放置30 min,待降温后取出观察,若处于溶解状态,则表示明胶液化实验为阳性;若呈凝固且不溶解,则结果为阴性。
1.3.7.3 抗生素敏感性
采用包含20 种抗生素的药敏试剂盒测定分离菌株对抗生素的敏感性。
1.3.8 RBL-2H3细胞实验
1.3.8.1 RBL-2H3细胞培养
从液氮中取出RBL-2H3细胞,37 ℃水浴解冻,避免振荡和光照。解冻后迅速转入细胞培养瓶,加入含20%胎牛血清的37 ℃ DMEM,浓度适中,在5% CO2、37 ℃条件下培养,每2 d更换培养基。融合度80%~90%时进行传代:无菌PBS冲洗,0.25% Trypsin-EDTA消化,加入含10%胎牛血清的DMEM中和。转至无菌离心管,1 000×g离心5 min,弃上清液,用新DMEM重悬浮细胞。细胞液分到新瓶,继续培养。进行3 次传代后开始实验。
1.3.8.2β-己糖胺酶(β-hexosaminidase,β-HEX)释放抑制率测定
参照Ding Yuanyuan等[15]的方法,将96 孔板中的RBL-2H3细胞(2×105个/mL)与200 μL 0.5 μg/mL Anti-DNPIgE培养过夜。弃去上清液,用PBS洗涤细胞3 次,用200 μL发酵上清液处理致敏的RBL-2H3细胞1 h。弃去上清液,用PBS洗涤细胞3 次,然后用100 mL 1 μg/mL DNP-HSA作为抗原刺激20 min。然后将30 μL上清液转移到96 孔板中,与70 mL 1.3 mg/mL 4-硝基苯基-N-乙酰-β-D-氨基葡萄糖,在pH 4.5、0.1 mol/L柠檬酸盐缓冲液中37 ℃孵育90 min。加入100 μL 0.4 mol/L甘氨酸-NaOH缓冲溶液停止反应。利用多功能酶标仪在405 nm波长处测定吸光度。对β-HEX释放的抑制率计算如式(6)所示:
式中:C为对照组吸光度;T为实验组吸光度;N为正常组吸光度;对照组(C)为Anti-DNP-IgE(+)、DNP-HSA(+)、测试样品(-);实验组(T)为Anti-DNP-IgE(+)、DNP-HSA(+)、测试样品(+);正常组(N)为Anti-DNP-IgE(-)、DNPHSA(-)、测试样品(-)。其中,“+”“-”分别表示添加和不添加该物质。
1.3.8.3 细胞因子HIS、IL-4和TNF-α的测定
用3 个处理组分别处理致敏的RBL-2H3细胞1 h。弃去上清液,用PBS洗涤细胞3 次,然后用100 mL 1 μg/mL DNP-HSA作为抗原刺激20 min。在DNP-HSA刺激细胞1 h后,分别使用酶联免疫吸附测定试剂盒测定HIS、IL-4和TNF-α,分析RBL-2H3细胞培养基中HIS、IL-4和TNF-α的释放情况。根据实验要求3 个处理组分组如下:模型组(N)为Anti-DNP-IgE(+)、DNP-HSA(+)、测试样品(-);实验组(T)为Anti-DNP-IgE(+)、DNP-HSA(+)、测试样品(+);空白组(C)为Anti-DNP-IgE(-)、DNP-HSA(-)、测试样品(-)。
1.3.9 16S rDNA菌株鉴定
参照Cui Yalei等[16]的方法,使用细菌DNA提取试剂盒提取菌株DNA,并检测纯度、浓度以确保PCR需求。PCR混合液由Taq缓冲液、Taq酶、上下引物、样品DNA、dNTPs和双蒸馏水按比例配制。在PCR仪中进行扩增,95 ℃预变性5 min;95 ℃变性30 s、58 ℃退火30 s、75 ℃延伸1.5 min,30 个循环,最后进行最终延伸。然后使用琼脂糖凝胶电泳检测PCR产物,送至上海派森诺生物科技有限公司测序。接收测序结果后,使用Chromas软件分析基因序列,去除引物序列。最后,利用BLAST算法在NCBI数据库比对16S rDNA序列,并绘制系统发育树。
1.4 数据统计
使用Excel 2023软件整理实验数据并计算统计参数。将数据导入SPSS Statistics 26软件进行方差分析(ANOVA),如有显著差异(P<0.05),进行最小显著差异多重比较。实验结果以表示。利用Origin 2022软件绘制图表。
2 结果与分析
2.1 菌株分离及耐酸和耐胆盐实验结果
通过MRS培养基分离和革兰氏染色,从不同地区采集的发酵蔬菜中分离出50 株革兰氏阳性菌株,其中菌株662、722、928和929在pH 2和含3.0 g/L牛胆盐的MRS液体培养基的环境中均表现出良好耐受性,对这4 株菌进行下一步研究。
2.2 菌株对模拟胃肠液的耐受性
益生菌在胃肠液中存活,并能够以足够的数量到达肠道,才能对宿主产生健康益处[17]。因此,通过体外模拟胃肠道环境筛选高存活率的益生菌具有重要意义。由图1可知,所有菌株在模拟胃肠液中表现出较高存活率,均大于60%,其中菌株929在模拟胃液和肠液中的存活率分别为(84.47±1.27)%和(81.01±1.46)%,总体显著高于其他菌株(P<0.05)。与对照菌株LGG相比,菌株928也具有较好耐受性,与Xu Yihan等[18]从发酵食品和Reuben等[19]从乳制品中分离出的乳酸菌的实验结果一致。这表明所选的菌株具有顺利进入人肠道的潜力,可以作为益生菌的候选菌株。
2.3 菌株抗菌活性
潜在的益生菌应表现出抗菌活性,并通过抑制病原菌的生长和繁殖促进胃肠道的健康[20-21]。如表1所示,所选菌株对5 株致病菌均有抑制作用,与对照菌株LGG相比,受试菌588、658和928对5 株致病菌的抑菌圈直径均无显著差异(P>0.05)。据报道,益生菌通过竞争性抑制和细胞外抑菌产物,包括有机酸、细菌素和过氧化氢等物质,从而抑制致病菌的生长。然而,抗菌活性取决于物种和菌株,不同的物种和不同的菌株表现出不同的抗菌活性[22-23]。
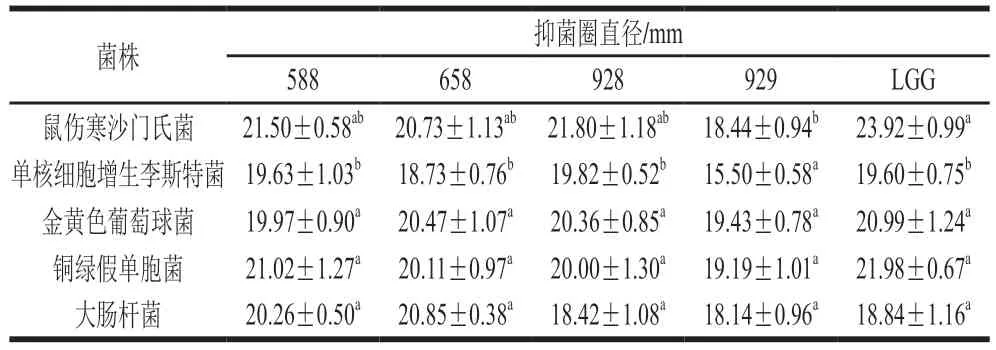
表1 分离菌株抗菌活性Table 1 Antibacterial activities of isolated strains
2.4 菌株表面特性
自聚集与菌株在胃肠道中的附着和定植能力有关。从图2 可以看出,由于菌株表面特异性,不同菌株间的自聚集能力差异显著(P<0.05),其值在(13.71±0.36)%~(46.11±1.55)%之间,表明这些菌株在人肠道中具有潜在的黏附和定植能力。这一结果与Akman[24]和Mohammed[25]等的结果相似。此外,益生菌株与病原体的共同聚集促进了对致病菌的黏附和清除[26]。与对照菌株LGG相比,菌株588和928对大肠杆菌和单核细胞增生李斯特菌均表现出接近或更高的共聚集能力,表明菌株对不同致病菌具有较强的共聚集能力。因此,所选的菌株可能是减少致病菌定植并预防感染的候选菌。
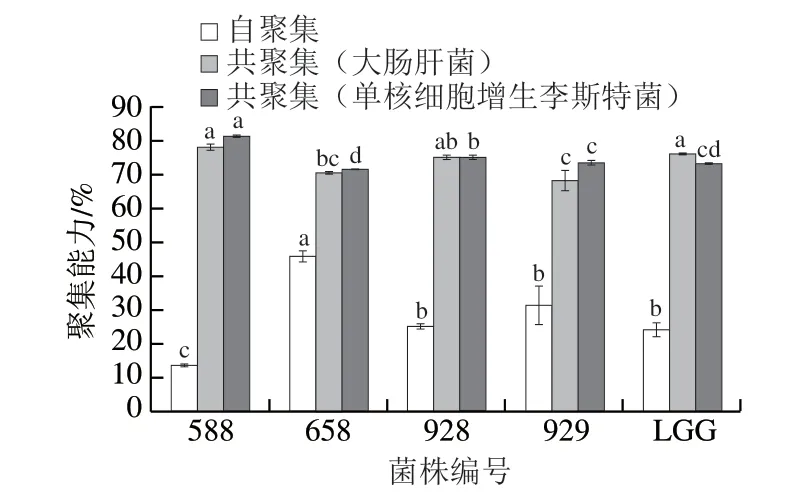
图2 分离菌株的聚集能力Fig.2 Aggregation capacity of isolated strains
疏水性被认为是反映益生菌对上皮细胞黏附能力的重要参考指标,具有高疏水性的益生菌具有更好的结合上皮细胞的能力[27]。由图3可知,通过氯仿和乙酸乙酯两种有机试剂处理,不同菌株间的疏水性差异显著(P<0.05),但所有菌株在氯仿中的疏水性均高于65%,而受试菌对乙酸乙酯的疏水性在(24.63±1.55)%~(28.66±1.42)%之间,表明受试菌在氯仿中的疏水性较高。此外,与对照菌株LGG相比,受试菌在氯仿和乙酸乙酯中表现出相当甚至更高的疏水性。据报道,亲水和疏水的特性是由细菌表面的多糖和蛋白质造成的[28]。所选菌株对碱性溶液(乙酸乙酯)表现出较弱的黏附性,这表明所选菌株表面可能呈现非Lewis酸性和较差的电子受体特性,而对酸性溶液(氯仿)的亲和力较强表明所选菌株表面可能呈现Lewis酸性和较强的电子供体的特性[29]。

图3 分离菌株的疏水性Fig.3 Hydrophobicity of isolated strains
综上所述,所选菌株在自聚集、共聚集和疏水性方面的表现说明其具有黏附和定植能力,在抵御致病菌攻击以及适应不同化学环境方面有潜在优势。这些特性可能使其成为减少致病菌定植并预防感染的有效候选菌株,为未来益生菌产品的开发提供了有力支持。
2.5 菌株对Caco-2细胞的黏附结果
益生菌对上皮细胞的黏附是在肠道定植的重要特性,它使益生菌菌株能够在肠道中有效地增殖和竞争。此外,益生菌具有较高的黏附能力,可能会延长益生菌在胃肠道中的停留时间,从而增强其对宿主发挥积极益生作用的效果。Caco-2细胞是来自于人类肠道黏膜的结肠癌细胞,其细胞模型常被用于确定益生菌的竞争性抑制、迁移、黏附能力[30]。由图4可知,菌株588、928和929表现出良好的黏附能力,均与对照组益生菌LGG无显著性差异(P>0.05),而菌株658表现出较低黏附能力,仅为(43.33±7.20)%。研究表明,益生菌的黏附是菌株的表面成分与肠道细胞表面之间的相互作用,黏附能力与各种不同的表面成分有关,包括脂磷壁酸、多糖和蛋白质[31-32]。

图4 分离菌株对Caco-2细胞的黏附能力Fig.4 Adhesion capacity of isolated stains to Caco-2 cells
2.6 菌株对Caco-2细胞膜完整性的保护作用
ALP是一种存在于Caco-2细胞内的酶类,当Caco-2细胞膜受到损伤或缺乏完整性时,胞内的ALP会被释放到培养基中,导致培养基中的ALP含量升高。因此,通过检测培养基中ALP含量的变化,可以间接地反映Caco-2细胞的完整性[33]。由图5可知,受试菌588、658、928和929细胞培养上清液中ALP活性均低于对照组,且与对照菌LGG细胞培养上清液中ALP活性无显著差异(P>0.05),表明所选受试菌与LGG均对Caco-2细胞膜完整性有保护作用。而与鼠伤寒沙门氏菌相比,受试菌588、658、928和929均显著降低了Caco-2细胞培养上清液中的ALP活性,表明受试菌抑制了鼠伤寒沙门氏菌引起的Caco-2细胞膜损伤,对Caco-2细胞具有一定的保护作用。

图5 分离菌株对Caco-2细胞膜的保护作用Fig.5 Protective effect of isolated strains on Caco-2 cell membrane
2.7 菌株安全性评价
益生菌对于某些人群(例如免疫系统受损的人,孕妇和儿童等)或者某些情况(例如过敏反应或药物相互作用)可能存在潜在的风险,因此在益生菌被推广和使用之前,需要进行溶血性、明胶酶活性和药敏性等安全性评价。由表2可知,受试菌并未表现出α和β溶血作用和明胶酶活性,而金黄色葡萄球菌表现β溶血作用和明胶酶活性,这一结果先前的研究结果[34]一致。如果菌株具有溶血性,它们可能会破坏人体内的红细胞,导致溶血性贫血等问题,而产生明胶酶的菌株可能通过水解结缔组织的结构成分使致病菌侵入宿主肠道黏膜[35]。由表3可知,受试菌对20 种常见抗生素的敏感性存在差异,所有菌株对丁胺卡那、庆大霉素、卡那霉素和新霉素均不敏感,且对青霉素、羧苄西林、哌拉西林和头孢唑啉表现出中等敏感性,这与LGG相比表现出一致的敏感性。此外,菌株588、658、928和929对大多数常用的抗生素敏感,这表明它们具有成为益生菌的潜力。

表2 菌株溶血性测试结果Table 2 Hemolytic activity and gelatinase activity of isolated strains
2.8 菌株对RBL-2H3细胞中β-HEX释放的抑制作用
β-HEX是一种在肥大细胞中预先合成的化合物,在正常状态下体液中检测不到。只有身体处于过敏状态时肥大细胞才能脱颗粒,并随后释放β-HEX。研究表明,肥大细胞脱颗粒时释放的β-HEX与过敏相关活性物质的释放呈正相关,包括IL-4、TNF-α和HIS等[36]。因此,通过测定β-HEX的释放率,并将其作为肥大细胞脱颗粒的一个衡量标准,以确定所选菌株是否影响anti-DNPIgE/DNP-HSA刺激RBL-2H3细胞的脱颗粒程度。由图6可知,所有受试菌均对β-HEX的释放有一定抑制作用((18.81±1.86)%~(47.30±0.91)%),其中受试菌588对β-HEX释放的抑制率最大,为(47.30±0.91)%。这种抑制作用表明菌株代谢产物可能具有抗过敏特异性。为了评估这一结果的可靠性,选择这4 株受试菌进行可靠性验证。

图6 分离菌株对RBL-2H3细胞释放β-HEX的抑制作用Fig.6 Inhibitory effect of isolated strains on β-HEX release from RBL-2H3 cells
2.9 菌株对RBL-2H3细胞中HIS、IL-4和TNF-α释放抑制作用
HIS是人体处于过敏状态时肥大细胞释放的最主要的的化学介质之一,是引起组织水肿、瘙痒、呼吸困难,甚至引起过敏性休克的主要原因[37]。因此,通过分析菌株对RBL-2H3细胞HIS释放的影响可以评估菌株的抗过敏活性。如图7所示,与N组相比,所有的受试菌均显著降低了HIS释放水平(P<0.05),其中菌株929降低的HIS释放水平最显著,降低至5.65 ng/mL,表明受试菌具有缓解过敏反应的潜力。

图7 分离菌株对RBL-2H3细胞释放HIS的影响Fig.7 Effects of isolated strains on the release of HIS from RBL-2H3 cells
在I型过敏反应中,肥大细胞产生的IL-4具有关键作用,它是一种重要的细胞因子,主要促进Th2细胞的分化与激活,有助于其产生特异性IgE抗体,从而增强对抗原的敏感性[38]。此外,IL-4还能促进肥大细胞和嗜酸性粒细胞的生长与活化,进一步加剧过敏反应中的炎症和免疫应答。如图8所示,C组和N组之间IL-4的分泌水平有显著差异(P<0.05),且N组的分泌水平高于C组,表明造模成功。与N组(83.06 pg/mL)相比,所选菌株均显著降低了RBL-2H3细胞的IL-4的释放水平。其中,菌株929的IL-4释放水平下降最为显著,降低至33.45 pg/mL。
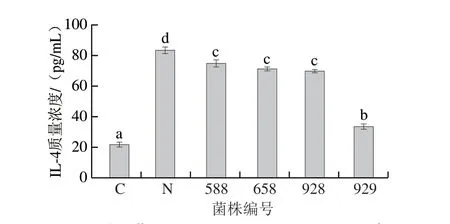
图8 分离菌株对RBL-2H3细胞释放IL-4的影响Fig.8 Effects of isolated strains on the release of IL-4 from RBL-2H3 cells
TNF-α是一种多功能炎性细胞因子,对炎症反应具有重要作用。TNF-α可以促进炎症细胞的迁移与活化,增加血管通透性,加剧组织水肿,并通过调节其他细胞因子和趋化因子的产生,进一步放大并维持超敏反应中的炎症和免疫反应,导致过敏症状的发生和持续[39]。由图9可知,N组TNF-α释放量显著高于C组,表明模型建立成功。与N组相比,所选受试菌均降低了RBL-2H3细胞释放TNF-α的水平,尤其是菌株929处理的RBL-2H3细胞,其TNF-α释放量降低至221.48 pg/mL。菌株658和928对RBL-2H3的TNF-α释放抑制无显著差异,TNF-α释放量分别为336.30 pg/mL和339.56 pg/mL。这些结果表明4 株受试菌可能通过抑制RBL-2H3细胞中HIS和炎症因子的释放从而起到缓解过敏症状的作用。

图9 分离菌株对RBL-2H3细胞释放TNF-α的影响Fig.9 Effects of isolated strains on the release of TNF-α from RBL-2H3 cells
2.10 菌株16S rDNA鉴定结果
将所筛选的菌株进行16S rDNA测序。测序结果在NCBI数据库中进行BLAST比对,鉴定结果如图10所示,可以看出该4 株菌分别属于植物乳杆菌(929、928)、发酵乳杆菌(658)和副干酪乳杆菌(588)。

图10 菌株系统发育树Fig.10 Phylogenetic tree of isolated strains
3 结论
本研究通过益生菌特性体外评价和RBL-2H3细胞脱颗粒抑制实验,从发酵蔬菜中筛选出具有抗过敏潜活性的益生菌。结果表明,分离出的50 株菌中4 株表现出耐酸和耐胆盐的能力。与菌株LGG相比,这4 株菌株均具备良好的抗逆性、抗菌性、表面特性和对Caco-2细胞的黏附性。大量研究证明LGG具有广泛的益生功能,特别是在调节免疫系统、增强黏膜屏障功能以及与病原体竞争等方面表现出明显的益生效应[40-41],已实现商业化应用。本实验以LGG为对照菌株,有助于更准确地判断筛选菌株的潜在益生功能及其机理。4 株新筛选菌株通过安全性评价和16S rDNA鉴定初步判定为安全的菌株。同时,这4 株菌株均对RBL-2H3细胞β-HEX、HIS、IL-4和TNF-α等炎症因子的释放具有明显抑制作用,其中菌株929最为突出。这一结果不仅突显了所选益生菌在调节IgE介导的肥大细胞过敏反应中的潜在功效,还通过与LGG对比,增强了新菌株作为潜在益生菌源的合理性和可信度。

