Pentacam TNP在角膜屈光手术后人工晶状体度数计算中的应用研究
臧馨怡,毛世兰,谢 晋,刘晓敏,李德卫, 元 静,代云海
0引言
20世纪90年代开始LASIK、PRK作为治疗近视的手术方法迅速在全球流行,且需求日益增加。这部分患者在行近视屈光手术若干年后出现晶状体混浊,需要行IOL植入手术,该类患者使用常规方法计算的IOL度数准确性比未行屈光手术的患者降低。常规的角膜屈光度测量方法(手动、自动或Placido环形地形图)测得的角膜曲率(K)值是基于假设角膜前表面与后表面之间的曲率比例是恒定的情况下得到的[1],但在LASIK或PRK等屈光手术后,角膜前表面中央变平,曲率发生改变,而角膜后表面曲率不变,因此角膜前表面、后表面之间的曲率比例发生改变,角膜曲率计算不再准确[2-3]。
如果患者的术前病史信息可用,使用临床病史法(clinical history method,CHM)仍是计算近视屈光术后角膜K值的金标准方法之一[4-5]。2003年,Aramberri提出的Double-K法根据患者屈光术前病史资料,可以代入不同的修正公式,如SRK/T,Hoffer Q和Holladay Ⅱ等[6-8],其中代入修正后SRK/T公式计算出的IOL度数相对准确,结果普遍被临床医师认可[9-10]。然而,许多屈光手术患者行白内障手术时缺失屈光术前数据,不能通过临床病史法计算IOL度数。随着测量设备和IOL计算公式的不断进步,近10 a出现了多种不需要依靠病史资料而计算角膜屈光术后IOL度数的方法,如Olsen、Barrett True-K、Haigis-L、Shammas、Potvin-Hill等[8,11],这些方法将角膜屈光术后IOL度数的计算准确性大大提高。同时也有部分亚洲的学者将Pentacam系统角膜净屈光力(true net power,TNP)应用到该类患者的IOL度数计算,在亚洲人中取得了较好结果,但并未被广泛认可[11-12]。我们研究组通过多年临床总结和文献分析,对这一方法进行调整并与其他方法进行对比研究,重新评估TNP的角膜曲率值联合SRK/T公式在计算屈光术后IOL度数方面的准确性,以期望得到一种更加简便、准确并适合亚洲人的IOL度数计算方法。
1对象和方法
1.1对象回顾性研究。收集2019-07/2021-12 LASIK或PRK术后行白内障手术患者35例50眼。纳入标准:(1)既往有LASIK或PRK手术史,且屈光手术的病史信息尚无法获得;(2)符合白内障超声乳化联合IOL植入手术指征;(3)Emery法核硬度分级[13]为Ⅲ或Ⅳ级;(4)无重大脏器病变或恶性肿瘤。排除标准:(1)可能影响术后屈光的眼部疾病,如圆锥角膜、青光眼、葡萄膜炎和严重视网膜病变等。(2)既往除屈光手术以外的外伤或眼科手术史。本研究遵循《赫尔辛基宣言》,经山东第一医科大学附属青岛眼科医院医学伦理委员会批准[No.青眼伦审(快)(2023)02号],所有患者均签署手术和临床数据使用知情同意书。
1.2方法所有患者术前接受裂隙灯检查晶状体情况,综合验光仪检查视力及屈光度,术前使用以下3种方法计算IOL度数:(1)TNP 3 mm (SRK/T)法:Pentacam系统TNP模式3 mm环上K1、K2及眼轴(axial length,AL)代入SRK/T公式直接计算人工晶状体度数;(2)Barrett True-K公式:使用IOL Master 700中的Barrett True-K公式计算IOL度数;(3)Olsen 2公式:将Pentacam测量的角膜前表面曲率半径、AL、Lenstar测量的晶状体厚度(lens thickness,LT)一起代入Pentacam仪器中的phacooptics软件计算IOL度数。每例患者术前至少使用2种公式计算IOL度数,结合术前IOL测算结果,根据患者年龄、工作及生活需求选择适当的IOL类型,无需优化IOL常数,按照预期在0-2.00 D之间确定选择的IOL度数。所有患者均采用2.5 mm透明角膜切口,由同一名医师进行手术,手术过程顺利,IOL均顺利植入囊袋中。记录术后3 mo的实际屈光度与术前的预测屈光度差值,得到IOL度数的预测误差(prediction error,PE)。
统计学分析:使用SPSS25.0统计软件进行统计学分析。符合正态分布的计量资料使用均数±标准差描述,两种仪器角膜曲率测量结果比较采用配对样本t检验,三种IOL度数计算方法的PE比较采用单因素方差分析,事后检验进行两两比较采用雪费法(Scheffe’s)。计数资料使用眼(%)描述,采用χ2检验。以P<0.05为差异存在统计学意义。
2结果
2.1纳入患者基本资料本研究共纳入患者35例50眼,其中男15例,女20例;年龄26-73(平均46.60±9.30)岁,AL 22.21-33.22(平均28.3±2.25)mm。行LASIK手术19例27眼,PRK术16例23眼。术前晶状体核硬度分级,其中Ⅲ级18例28眼、Ⅳ级17例22眼。术前使用TNP 3 mm (SRK/T)计算IOL度数50眼,使用Barrett True-K公式计算IOL度数34眼,使用Olsen 2公式计算IOL度数41眼。其中1例26岁年轻患者行屈光手术后,发生视网膜脱离,视网膜脱离术后发生并发性白内障,白内障术前这例患者视网膜已复位,且眼底情况稳定。
2.2两种仪器测量角膜曲率比较IOL Master 700与Pentacam-TNP测量K1分别是:30.79-45.61(平均37.16±3.17)、27.2-44.35(平均34.93±3.29)D,差异有统计学意义(t=21.83,P<0.001);K2分别是:31.9-48.35(平均38.41±3.45)、29.4-45.55(平均36.69±3.46)D,差异有统计学意义(t=17.86,P<0.001)。
2.3三种IOL度数计算方法的PE比较TNP 3 mm (SRK/T)、Barrett True-K、Olsen 2法PE分别为-1.69-1.75(平均-0.02±0.63)、-2.1-0.82(平均-0.54±0.80)、-1.50-1.91(平均0.25±0.80)D,差异有统计学意义(F=11.23,P<0.001),两两比较提示TNP 3 mm (SRK/T)与Olsen 2法差异无统计学意义(P>0.05);Barrett True-K与TNP 3 mm (SRK/T)、Olsen 2差异均有统计学意义(P<0.05)。TNP 3mm (SRK/T)、Barrett True-K、Olsen 2法预测植入IOL后PE在±0.5 D分别为66%(33/50)、44%(15/34)、37%(15/41),差异均有统计学意义(χ2=8.53,P<0.05);PE在±1.0 D分别为88%(44/50)、71%(24/34)、80%(33/41),差异无统计学意义(χ2=3.96,P>0.05)。
3讨论
角膜屈光术后计算IOL度数存在一定的挑战性,使用常规计算方法往往会导致IOL度数误差较大,出现远视漂移[1,14-15]。产生误差的原因主要是角膜屈光术后K值测量的不准确性和有效晶状体位置(effective lens position,ELP)的预测偏差[1,16]。角膜前后表面的曲率比例发生改变,使常规方法测量的K值通常高于实际K值[17],而且第三代IOL计算公式会低估屈光术后的ELP,使IOL度数计算偏低,导致术后远视漂移[15]。为了提高角膜屈光术后IOL度数计算的准确性,自20世纪70年代以来,眼科学者们坚持不懈的寻找和总结更准确的计算方法,多种屈光术后IOL度数的计算公式不断涌现,如:SRK/T、Hoffer Q、Barrett Universal Ⅱ、Olsen等[18],这些方法的不断研发与改良使得角膜屈光术后IOL度数的计算变得日趋简单,但不同方法计算的准确性在国人群中仍参差不齐,尚缺少一种对所有患者放之皆准的方法。
依靠病史资料(如CHM、Feiz-Mannis法、角膜旁路法等[19])计算屈光术后K值的方法正逐渐退出历史舞台,取而代之的是可直接测得相对真实K值的扫频设备,如IOL Master 700、Pentacam系统、AS-OCT(CASIA2)[20-22]等。IOL Master 700设备采用SS-OCT原理,在19个参考点上进行K测量,可以评估角膜的前后表面屈光度[23]。Pentacam是一款通过Scheimpflug相机360°匀速旋转拍摄,实时采集患者的角膜形态图像的分析诊断系统,可以分析患者的总角膜曲率(total corneal refractive power,TCRP)、TNP和角膜厚度等[24]。对于正常角膜,常规测量法测得的K值显著高于KTNP和TCRP,Placido地形图仪的模拟角膜曲率值(Sim K)比KTNP高1.3 D,差异具有显著性[25-26],而前房深度(anterior chamber depth,ACD)无差异[27]。本研究中使用IOL Master 700测量的K1、K2均大于Pentacam系统,且差异均有统计学意义,提示两种仪器在测量角膜屈光术后K值时各有特点,不可替代使用。
近年来,有多个亚欧国家使用不同版本Pentacam的TNP模式中K值来计算屈光术后IOL的度数各有差异。2009年,韩国Kim等[28]将屈光术后TNP模式中央点K值的3次平均值作KTNP,2014年,中国、韩国及德国报导的KTNP是TNP中央3 mm区域6个K值和中央K值的平均值[3,22,29],2018年韩国Cho等[30]使用TNP 3 mm区域的K为KTNP,本研究中使用的是Pentacam系统TNP模式中央3 mm环上K1、K2的平均值作为KTNP(TNP模式中的3 mm环和3 mm区域K值是有差别的),见图1。
上述研究中在计算屈光术后IOL度数时,最常用的是将KTNP值代入SRK/T公式,并得到了较满意的结果:中国Xu等[22]将KcTNP、KTNP及临床病史法计算的K值(KCHM)联合SRK/T、Holladay1、Hoffer Q公式计算屈光术后IOL度数,结果显示只有KTNP联合SRK/T公式计算的PE与0无显著差异,且KTNP代入SRK/T公式计算的±0.50 D和±1.00 D以内的屈光度数百分比分别为67.6%和86.5%;韩国Kim等[28]将KTNP代入SRK/T公式中计算的IOL度数误差在±0.5 D、±1.0 D以内的比例分别是70%、93%;德国Frings等[29]将其KTNP、KOrbscan、KCHM值分别代入SRK/T及Haigis公式中计算屈光术后IOL度数,结果表明KTNP代入SRK/T公式计算的IOL度数更接近KCHM计算的度数;韩国Cho等[30]采用20种方法计算56眼屈光术后的IOL度数,包括将Pentacam系统中3、4、5 mm区域上的KTNP、TCRP等代入SRK/T、Haigis等多种公式中,以上结果表明,KTNP值代入SRK/T公式中可以得到屈光术后较好的IOL度数。
临床上常用的无需病史资料、且相对准确的计算屈光术后IOL度数的公式有Barrett True-K公式和Olsen公式等[31]。Li等[7]对比7种屈光术后IOL计算方法表示:Barrett True-K在±0.5 D内的屈光度数预测的比例显著高于Shammas-PL、Wang-Koch-Maloney、Haigis-L、OCT公式等。本研究中的Barrett True-K公式的PE为-0.54±0.80(-2.1-0.82)D,PE在±0.5、±1.0 D的比例分别是44%、71%。该公式PE总体偏向负数,表示该公式预测的IOL度数在本研究中术后偏近视,其原因可能是近视屈光手术后角膜消融区域较大或者偏心[32](图1)。Olsen公式始于1987年,在基于光线追踪和C常数的原理上不断更新版本,并且根据术前测量的ACD和LT来估计ELP。2021年,法国Debellemanière等[33]回顾了4 242眼患者资料,经多种方法比较发现Olsen可能稍优于EVO2.0、RBF 3.0、BUII等公式。2000年日本Ishikawa等[34]使用Olsen和SRK-Ⅱ公式预测屈光术后32眼的IOL度数,结果表明Olsen公式预测的度数较SRK-Ⅱ公式准确。本研究中Olsen 2公式的PE为0.25±0.80(-1.50-1.91)D,PE在±0.5、±1.0 D的比例分别是37%、80%,PE偏一点远视。
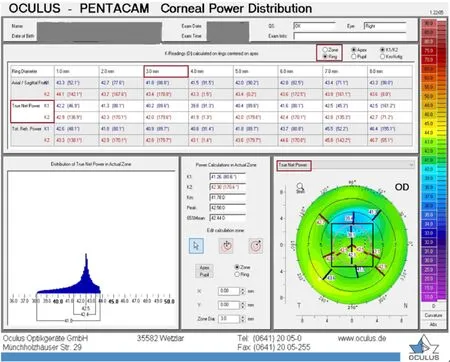
图1 Pentacam系统TNP模式下的截图 本研究以TNP中3.0 mm环(右下黑色矩形框区域)的4个K值的平均值作为KTNP。
本研究将Barrett True-K和Olsen 2公式作为TNP 3 mm (SRK/T)法的对照进行研究,结果显示TNP 3 mm (SRK/T)法的PE均值为-0.02±0.63(-1.69-1.75)D,与上述Barrett True-K公式的结果相比,差异有统计学意义(P<0.05);与Olsen 2公式之间无统计学差异(P>0.05),且TNP 3 mm (SRK/T)的PE更接近0,误差更小一些(图1),这与既往文献报道的结果相似[22]。虽然三种方法预测的PE在±1.0 D以内的患眼无统计学差异(P>0.05),但TNP 3 mm (SRK/T)法预测PE在±0.5 D以内患眼的比例最高,差异具有统计学意义(P<0.05)。目前,我们的研究仅是针对于中国人得到的结果,对于其它人种眼部解剖结构特点是否也有同样的表现还需要进一步研究。
综上,在LASIK或PRK屈光术后眼的IOL度数计算中,无病史信息的TNP 3 mm (SRK/T)法计算操作简便,且计算的结果较为准确。但本文存在一定的局限性,由于无法根据既往近视矫正的度数分组,所以无法进行分类研究,因此该结论还需大样本多中心的研究进一步证实。不同地域、种族间患者眼部解剖结构略有不同[35-36],近视程度、角膜切削的区域等也存在个体差异,尚没有一种对于所有屈光术后的IOL度数计算皆准确的方法[18]。因此,对于角膜屈光术后IOL度数计算尽量采用多种方法综合比较,以减少误差。

