角膜淋巴管新生在眼部疾病中的研究进展
李梦洁,朱玉莹,张建革
0引言
既往淋巴系统被认为仅仅是液体和免疫细胞被动运输的通道,在适应性免疫反应和胃肠道脂肪吸收方面起关键作用。淋巴系统的功能障碍是原发性和继发性淋巴水肿等疾病的诱因,同时,淋巴管也被认为是肿瘤转移的重要路径。然而,近年来,这一传统观点有所扩展,淋巴管的形态或功能缺陷已在越来越多的疾病中被发现。在过去的20 a,已有研究证实许多癌症与淋巴系统密切相关,如非小细胞肺癌[1]、卵巢癌[2]等。最新研究发现淋巴系统也调节或参与其他疾病,如心血管疾病(如冠状动脉粥样硬化[3]和心肌梗死[4])、神经系统疾病(如帕金森病[5]和脑部肿瘤[6])等。随着对淋巴系统认识的逐渐深入,人们发现在眼部疾病中淋巴管新生也起到重要作用。
角膜无血管无淋巴管状态对维持角膜透明度非常重要,是保证良好视力的基础。生理状态下,角膜淋巴管通过产生抗血管生成因子、抗淋巴管生成因子,进而抑制促血管生成因子、促淋巴管生成因子的生成[7-8],保持一个动态平衡的过程,从而保持角膜的清晰度。角膜的正常光学性能取决于角膜清晰度。角膜缘通常存在淋巴管,分布在角膜和巩膜过渡区,形成圆形网络,并不侵犯角膜组织[9]。角膜缘淋巴管一方面促进抗原提呈细胞从眼表面迁移到区域淋巴结,从而增强免疫反应[10-11],另一方面其也可能参与排出多余的组织液,从而有助于保持角膜的透明度和良好的视力[12]。然而,各种疾病和手术操作易造成病理性角膜淋巴管新生。迄今为止,超过25种针对多种不同信号通路的抗血管生成药物已获得美国食品和药物管理局批准[13]。虽然在临床前试验阶段,部分药物已经被证明会额外影响淋巴管生成,但在临床试验中,对淋巴管生成调节因子的重视却远远不够[14]。因此,对抗淋巴管生成治疗策略的研究仍有很大的空间。
1角膜淋巴管新生的相关因子
角膜淋巴管新生导致视力下降,并可能增加过度免疫反应的风险。多种因素可促进角膜中淋巴管的新生,其中最重要的是血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(VEGFRs)家族。其它促淋巴管生成因子还包括碱性成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)、血管生成素(angiopoietins,Ang)等。
1.1血管内皮生长因子VEGF是维持淋巴管内皮细胞(EC)发育所必需的细胞因子。VEGF与蛋白多糖[15]及共受体如神经黏连蛋白2(neuropilin-2,NRP-2)[16]相互作用,能够诱导内皮细胞激活,并促进成熟淋巴管的建立。VEGF及其受体构成一个极其复杂的系统,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D和胎盘生长因子(placental growth factor,PEG)[17]。促进淋巴管生成的主要生长因子是VEGF-C和VEGF-D[18]。血管内皮生长因子受体2(VEGFR-2)和血管内皮生长因子受体3 (VEGFR-3)是VEGF-C和VEGF-D的主要受体,刺激VEGFR-2和VEGFR-3可促进淋巴内皮细胞增殖、迁移和稳定[19]。VEGF-A是促进血管生成的主要生长因子,通过促进分泌VEGF-C和VEGF-D的VEGFR-1和CD11b+(cluster of differentiation 11b+)巨噬细胞的募集,间接参与淋巴管生成[20]。最近,Wang等[21]研究在斑马鱼模型中证实VEGF-C具有诱导淋巴管细胞定向迁移的能力,再次验证了VEGF-C/VEGFR-3信号在引导淋巴管生成中的重要作用。
1.2碱性成纤维细胞生长因子FGF-2主要通过增加VEGF-C和VEGF-D的表达间接影响淋巴管生成[22]。在存在VEGFR-3阻断抗体的情况下,FGF-2也能与淋巴上皮细胞结合,促进其增殖和迁移,表明FGF-2具有不依赖于VEGF-C/VEGFR-3的促进淋巴管生成的特性[23]。另有研究表明FGF-2通过与其受体FGFR-1结合直接作用促进淋巴管生成[24]。Hajrasouliha等[25]在角膜植入FGF-2诱导小鼠淋巴管新生模型,发现VEGF-A/VEGF-C在靠近诱导剂的血管生长区域表达增加最多,而VEGF-C/VEGF-D在诱导剂对面淋巴管生长的区域表达上调最多,提示局部淋巴管新生与角膜炎症的特定部位有关。
1.3血管生成素Ang包括Ang-1和Ang-2,能够与Tie-1和Tie-2受体结合,在淋巴管生成中均发挥重要作用。利用小鼠角膜微囊植入实验,Morisada等[26]研究发现,Ang-1能够促进淋巴管生成,并增加淋巴管内皮透明质酸受体1(lymphatic vessel endothelial hyaluronan receptor 1,LYVE-1)的表达。敲除Ang-2基因几乎能够完全抑制小鼠角膜中炎症性淋巴管的生成,表明Ang-2在角膜淋巴管的发育中起着重要作用[27]。Ang-2除了具有促淋巴管生成的特性,还可以在角膜损伤期间增加淋巴内皮细胞对炎症刺激的敏感性[28]。
1.4其他相关因子NRP-2在淋巴内皮细胞中高度表达,作为VEGFR-3的辅助受体,可促进淋巴内皮细胞的增殖和迁移[29-31]。VEGF-C/VEGF-D与NRP-2结合诱导与VEGFR-3形成复合物,进而激活并增强淋巴管生成[32]。趋化因子是周围淋巴结生成的关键因素,周围淋巴结是淋巴管的引流部位[33]。趋化因子受体及其配体在伤口愈合过程中发挥重要作用[34]。转化生长因子-β(transforming growth factor-β,TGF-β)能够诱导相关蛋白表达,从而增加VEGF-C的表达,并进一步促使VEGF-C诱导的淋巴管向外延伸[33]。
2与角膜淋巴管新生相关的眼部疾病
2.1与炎症相关的眼部疾病
2.1.1干眼干眼是由于眼表泪膜破裂和炎症引起的眼表疾病,表现为红肿、干燥、不适、光敏等[35]。其中由角膜上皮损伤引起的干眼中女性患者及青年人群占比最大[36]。近年来,能够促进免疫细胞增殖的角膜淋巴管新生被认为是干眼发病的关键因素[37]。干眼发生发展过程中角膜淋巴管的新生是单独进行的,而不伴随着血管生成,靶向淋巴管新生的治疗会是干眼治疗的新策略。干燥应激诱导的小鼠干眼模型中,早期VEGF-D/VEGFR-3水平便会上升,随后VEGF-C、VEGF-A和VEGFR-2水平升高,这种表达差异强调了VEGF-D在诱导淋巴管新生中的早期作用及其在疾病晚期调节VEGF-C介导的淋巴管内皮细胞迁移和出芽的作用[38]。
2.1.2过敏性角膜/结膜炎Lee等[39]研究已证实在过敏性角膜炎中存在淋巴管新生,通过抑制VEGF受体,可以减少辅助性T细胞反应和免疫球蛋白的生成从而预防角膜淋巴管的生成。与此同时,过敏性结膜炎发生发展过程中也被证实有角膜淋巴管新生的参与。在小鼠同种异体角膜移植手术时,若同时存在过敏性结膜炎,则组织的免疫反应会加剧。Flynn等[34]发现,在同种异体角膜移植实验开始第2 d,与非过敏性小鼠对比,过敏性小鼠角膜中的CD11b+细胞和LYVE-1+淋巴管数量显著增加。采用地塞米松治疗能够显著抑制LYVE-1表达,维持治疗1 wk,过敏性结膜炎受体的异体移植物存活率显著提高。
2.2角膜移植角膜相对于其他组织具有独特的免疫性质,包括较低的免疫应答和对免疫抑制分子的较高敏感性,因此角膜移植并不需要白细胞抗原匹配或使用高剂量免疫抑制剂,其是最普遍和最成功的眼科手术之一。但移植手术后的免疫排斥一直是临床上面临的难题,淋巴管新生预示着同种异体角膜移植预后不良[40]。Cho等[41]报道,在小鼠角膜移植模型中,使用类固醇与VEGF受体阻断剂(morpholino,MO)联合治疗可以减少淋巴管生成,并提高角膜移植物的存活率。同样在小鼠角膜移植模型中,使用VEGF内源受体Flt23K和糖皮质激素曲安奈德联合治疗能够显著减少淋巴管生成,提高移植物的存活率[42]。在小鼠角膜移植术后抑制VEGF-A也可以减少淋巴管生成,提高整体移植物存活率[43-44]。此外,靶向VEGFR-3也可以提高抗淋巴管生成的作用,提高角膜移植存活率[45]。王剑超等[46]发现贝伐单抗能够减少大鼠角膜缝线后早期新生血管及淋巴管形成,其抑制淋巴管形成的机制可能是阻断VEGF-C/VEGFR-3信号传导通路。
2.3眼部恶性肿瘤许多类型的肿瘤可以发生在眼部,肿瘤细胞的类型和位置也可能导致淋巴管新生。Heindl等[47]证明当结膜上皮内肿瘤转变为结膜浸润性鳞状细胞癌时,将会涉及结膜淋巴管的生成。此外,鳞状细胞癌复发的风险与淋巴管生成的数量有关。Heindl等[48]也发现眼内淋巴管生成会增加肿瘤的大小和转移,增加恶性黑色素瘤眼外扩展患者的死亡率。特异性抗淋巴管生成疗法可以治疗发生在眼外有扩张的葡萄膜黑色素瘤,以防止肿瘤经淋巴管扩散到局部淋巴结[49]。
2.4感染性角膜病
2.4.1疱疹性基质角膜炎感染性角膜炎是世界范围内感染性致盲的主要原因,最常见的是与1型单纯疱疹病毒有关,被称为疱疹性基质角膜炎[50]。据估计,全球约2/3的人口感染1型单纯疱疹病毒[51]。针对中国人群的流行病学调查研究结果显示,其发病率约为(65-110)人/10万人[52],其中多数表现为单眼感染,而约1.3%-12%的患者最终双眼受累[51]。与干眼类似,1型单纯疱疹病毒感染引起病理性角膜淋巴管生成并加重免疫[53]。在铜绿假单胞菌的小鼠细菌性角膜炎模型中发现,疾病晚期角膜淋巴管生成和VEGF-C/VEGFR-3水平升高,但并未发现角膜血管生成[54]。
2.4.2真菌性角膜溃疡当角膜的防御力减弱时,可能引发外源性或内源性致病菌感染,进而导致角膜组织感染,严重时可导致角膜溃疡,其中真菌性角膜溃疡是最常见的类型[55-56]。这种感染性角膜病由于缺乏特异性症状,各种抗真菌药物的疗效并不理想,病情往往会超出预期,甚至可能致盲[57]。发生真菌性角膜溃疡后,炎症打破了角膜自身稳态,导致角膜缘的淋巴管向角膜内部延伸,促使新生淋巴管在角膜上皮层和基质层形成[58]。研究表明,真菌性角膜溃疡引起的新生血管和淋巴管不仅参与角膜的炎症反应,还参与感染和炎症后的组织修复[59]。
3治疗策略
多种因子参与导致角膜淋巴管新生,进而引起多种疾病的发生(图1)。研究发现抑制淋巴管新生对角膜疾病的治疗具有相当可观的前景,针对抑制角膜淋巴管生成的具体治疗策略如下。
3.1VEGF抑制剂VEGF-C/VEGF-D被认为是淋巴管生成的主要细胞因子,与VEGFR-3具有高亲和力。尽管目前还没有被批准上市的VEGF-C/VEGF-D抑制剂,但已有药物进行了临床试验。VGX100是一种能够与VEGF-C特异性结合的药物,已在晚期实体瘤患者中进行了临床Ⅰ期试验[60]。研究表明,可以通过多种方法将VEGF-C靶向到特定的器官,如可以利用抗体偶联物[61-62]将VEGF-C有选择地传递到目标器官。此外,纤维蛋白与VEGF-C结合[63]也是一种可行的选择,通过这种方式可以实现对特定组织的定向作用。另有研究研发了VEGF-C蛋白或mRNA的纳米颗粒载体[64-65],这为在分子水平上实现精确的靶向提供了一种有效手段。
VEGF-A是血管生成的主要细胞因子,但也参与淋巴管生成。有研究指出,VEGF-A通过抑制免疫细胞的趋化,尤其是抑制单核细胞趋化,间接减少淋巴管生成[66]。贝伐单抗(Bevacizumab)是临床上广泛使用的VEGF-A抑制剂,用于抗血管生成的肿瘤治疗,该抗体能够结合并中和所有VEGF-A亚型。Bock等[20]在小鼠角膜缝合模型中发现,局部或全身应用贝伐单抗能够抑制炎症诱导的角膜血管生成和淋巴管生成。王进等[67]在小鼠碱烧伤模型中证明贝伐单抗可能通过抑制角膜组织内VEGF-C的表达从而抑制角膜淋巴管新生。
3.2VEGFR-3抑制剂在癌症治疗中,VEGF受体抑制剂呋喹替尼已在结直肠癌中获批上市[68]。一种名为IMC-3C5的特异性抗VEGFR-3单克隆抗体已经完成了在晚期和难治性实体瘤及晚期结直肠癌患者中的Ⅰ期临床试验[69]。内源可溶性VEGFR-3(sVEGFR-3)也存在于角膜上皮细胞中,被认为是抑制角膜淋巴管生成的一个重要因素[70]。Emani-Naeini等[70]研究表明,sVEGFR-3能够抑制淋巴管生成,减少IFN-γ+和CD4+T细胞在角膜移植物中的渗透,并提高存活率。
3.3VEGFR-1和VEGFR-2抑制剂VEGFR-1与VEGF-A的结合亲和力最高,在炎症条件下对单核/巨噬细胞显示出很强的趋化作用[71]。Hayashi等[72]研究发现,通过sVEGFR-1/Fc和sVEGFR-2/Fc嵌合体治疗,淋巴管显著减少;同时,sVEGFR-1/Fc阻碍伤口愈合并导致移植失败,而sVEGFR-2/Fc治疗则不会导致此情况。
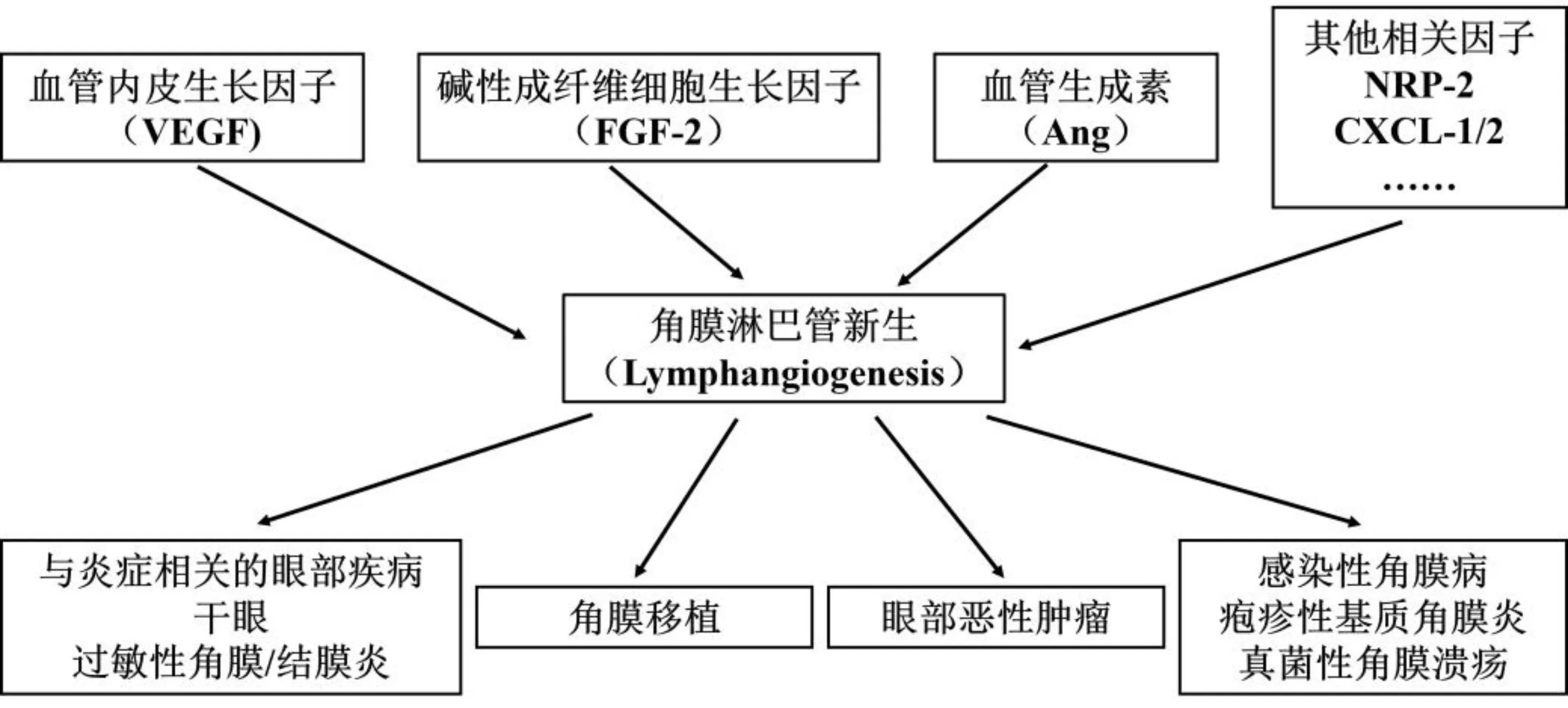
图1 角膜淋巴管新生相关因子及与之相关的眼部疾病 CXCL-1/2:趋化因子配体1/2(chemokinesr ligands-1/2)。
3.4其他角膜淋巴管生成抑制剂阻断SP(substance P)/NK1R(neurokinin-1 receptor)可能成为抑制角膜淋巴管生成的新靶点。在碱烧伤、缝合诱导和干眼动物模型中,使用淋巴管标记物对全角膜进行染色,证实抗NK1R和敲除前速激肽基因具有抗淋巴管生成的作用[73-76]。巨噬细胞极化后分泌VEGF-C/VEGF-D,进而促进角膜淋巴管新生。在角膜缝合线诱导大鼠角膜新生血管和淋巴管模型中,角膜胶原交联能增加角膜基质硬度,促进巨噬细胞向M1型极化,可能是抑制角膜新生血管和淋巴管的机制之一[77]。TNF-α抑制剂Infliximab可以结合TNF-α的单体形式和具有生物活性的三聚体形式,其被证明在小鼠角膜碱烧伤模型中立即局部应用Infliximab(10 mg/mL,每天6次),14 d后可以显著降低角膜新生血管和淋巴管再生[78]。
上述抑制剂的研究目前尚处于基础性研究阶段,仍有许多问题需要解决。如巨噬细胞极化在临床前研究中已经证明与淋巴管新生密切相关,即与眼部疾病息息相关,但对于巨噬细胞极化在临床上很难追踪;对于TNF-α抑制剂在临床研究中是否会具有确切作用仍有争议,这些都需要进一步的大量基础性实验数据支撑。
4小结与展望
对于角膜淋巴管新生相关的眼部疾病目前可用的治疗方法非常有限,未来的研究可以着重于针对角膜淋巴管新生开发新的治疗方法。基于对VEGF及其受体的研究可以进一步探索新的分子靶点,寻找更具选择性和高效性的药物。如可以考虑针对角膜淋巴管生成的特定调节因子进行干预,以实现更精准的治疗。为了更好地利用角膜淋巴管生成作为治疗靶点,未来的研究需要深入理解这一过程的分子机制,这可能涉及到更详细的信号通路研究、基因调控机制的阐明,以及淋巴管生成与眼部疾病之间复杂的相互作用。相关研究有助于揭示新的治疗策略,同时为精准医学提供更多支持。文中提到靶向角膜淋巴管生成作为治疗眼部疾病的新策略,需要更多的研究进一步评估其临床应用的潜力。未来的研究可以包括动物模型的进一步验证、体外实验的拓展,以及初步的临床试验,这将有助于确定潜在的药物靶标在人类眼部疾病治疗中的安全性和有效性。
总体而言,未来对角膜淋巴管生成的研究需要继续深入,结合先进的技术手段,以期发现新的治疗策略和药物,为眼部疾病的治疗提供更多的选择和可能性。

