microRNA在非渗出性年龄相关性黄斑变性氧化应激和脂质代谢中的作用
田 珍,张甜甜 ,李 静
0引言
年龄相关性黄斑变性(age-related macular degeneration,ARMD)是一种慢性退行性疾病,也是导致发达国家不可逆中心视力丧失的主要疾病之一,随着人口老龄化的发展,我国乃至全世界ARMD的患病率也呈现不断上升趋势,全世界约有170.2亿人患有ARMD,全球约4%的失明原因是由于ARMD引起[1-3]。临床上将ARMD主要分为两种类型,即干性ARMD和湿性ARMD,干性ARMD也称为非渗出性年龄相关性黄斑变性(nonexudative age-related macular degeneration,ARMD),干性ARMD患病人数占ARMD总人数的90%,其早期特征是视网膜色素上皮(retinal pigment epithelium,RPE)功能障碍以及玻璃膜疣(drusen)的形成,晚期发展为地图样萎缩(geographic atroph,GA)。缺氧及慢性炎症导致Bruch膜通透性受损,脉络膜毛细血管清除的物质积聚在RPE和Bruch膜之间形成玻璃膜疣,玻璃膜疣与局部Bruch膜胶原层增厚有关,而后者与脂质、蛋白质积累以及晚期糖基化终产物形成有关,晚期脂质糖基化终产物的沉积会破坏蛋白质稳定性并诱导光感受器和RPE细胞凋亡[4-5]。非渗出性ARMD的早期和中期阶段视力变化不显著,就诊率低,患者多在影响视力及生活时就诊,此时多数患者已发展到ARMD的晚期阶段——萎缩期和瘢痕期[6]。
微小核糖核酸(microribonucleic acid,miRNA)是一类由18-22个核苷酸组成的内源性短链非编码RNA,是基因表达的主要调节因子,通过碱基互补配对原则结合到靶信使RNA 3’非翻译区(3’-UTR),在转录后调控目的基因的表达[7-8]。既往研究发现,miRNA失调与角膜、视网膜的多种疾病相关,多种miRNA在视网膜稳态和光感受器发育中起核心作用[9-11]。ARMD的发病机制涉及氧化应激、脂质代谢、炎症、血管生成、细胞凋亡和吞噬等多方面的紊乱[12]。氧化应激是非渗出性ARMD的关键因素,RPE细胞受到不同程度的氧化损伤后细胞内miRNA表达量发生变化,且该变化与细胞损伤程度相关[13]。此外,在脂质代谢过程中,近期研究发现高浓度的高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)与非渗出性ARMD的风险增加有关,而高浓度总胆固醇和低密度脂蛋白(low-density lipoprotein,LDL)患者非渗出性ARMD的风险减少[14-16]。不同的miRNA可能通过不同的酶、蛋白通道或细胞在玻璃膜疣产生、脂质生成过程中发挥作用。虽然目前该领域的研究已取得了较大进展,但关于miRNA在非渗出性ARMD氧化应激、脂质代谢中的作用仍需进一步探索。本文对miRNA在非渗出性ARMD氧化应激、脂质代谢方面的作用机制进行综述。
1 miRNA在非渗出性ARMD氧化应激中的作用
氧化应激诱导的RPE损伤和功能障碍是引起ARMD的主要致病因素之一[17],RPE位于感光细胞和脉络膜毛细血管层之间,参与构成血-视网膜外屏障[18]。RPE对光感受器外节的吞噬、光感受器和脉络膜毛细血管之间营养物质的摄取和废物清除极其重要[19]。黄斑中心凹和RPE的血供主要来源于后方脉络膜毛细血管系统,黄斑处RPE作为视网膜耗氧量最高的组织之一,其长期受到各种内源性和外源性氧化刺激,产生活性氧(reactive oxygen species,ROS),如超氧化物(O2·-)、羟基自由基(·OH)、过氧化氢(hydrogenperoxide,H2O2),导致RPE结构和功能损伤[20-21]。几种常见的miRNA在非渗出性ARMD氧化应激中的作用见图1。
1.1miR-125b和miR-626通过靶向Nrf2/HIF-1α信号通路保护RPE细胞免受氧化应激的影响Liu等[22]在浓度为500 μmol/L H2O2诱导的人视网膜色素上皮细胞(ARPE-19细胞)氧化损伤模型中发现miR-125b是一种全新的靶向Kelch样ECH相关蛋白(Kelch-like ECH-related protein,Keap1)的miRNA,即Keap1是miR-125b的新靶点,过表达miR-125b可显著抑制RPE细胞Keap1 3’-UTR活性,降低Keap1蛋白表达,减少抗氧化基因核因子E2相关因子(nuclear factor erythrocyte 2 related factor 2,Nrf2)降解并增加Nrf2核转位,促进缺氧诱导因子1α(hypoxia-inducing factor-1α,HIF-1α)蛋白降解,从而激活Nrf2/HIF-1α信号通路,提高细胞增殖能力和超氧化物歧化酶(superoxide dismutase,SOD)水平,减少ROS的过度产生,保护RPE细胞免受氧化损伤的影响;此外,miR-125b可直接与HIF-1α内部核糖体进入位点(IREs)结合,抑制HIF-1α蛋白表达,从而逆转ROS诱导的HIF-1α表达增加,表明Nrf2和HIF-1α之间呈负相关,Nrf2是miR-125b的下游基因,miR-125b通过靶向Nrf2/HIF-1α信号通路保护RPE,减少其受到的氧化损伤,从而延缓非渗出性ARMD的发展。Yang等[23]研究表明,miR-125b模拟物可以直接促进Nrf2表达,也可以通过调节Keap1转录后提高Nrf2相应基因的表达,通过外源性补充miR-125b可以逆转碘酸钠(NaIO3)诱导的外层视网膜变薄,敲除Nrf2时,外层视网膜变厚的保护作用也随之消失。Nrf2是miR-125b的下游靶基因在Zhang等[24]研究中也得到证实,该研究通过染色质免疫沉淀分析的方法发现Nrf2结合miR-125b的5’非翻译区,Nrf2级联激活可以保护RPE细胞免受氧化应激的影响。此外,Xu等[25]研究证明miR-626也可以靶向Keap1,激活Nrf2级联反应,保护RPE细胞和其他细胞免受H2O2诱导的氧化损伤,相反,抑制miR-626可诱导Keap1上调和Nrf2级联抑制,加剧RPE细胞的氧化损伤,miR-626在Keap1基因敲除或Nrf2基因敲除的RPE细胞中无效。由此可知,Nrf2级联激活可减少RPE细胞氧化应激,miR-125b和miR-626通过靶向Keap1和Nrf2/HIF-1α信号通路调节Nrf2级联反应减轻RPE氧化损伤,从而延缓非渗出性ARMD的发展。
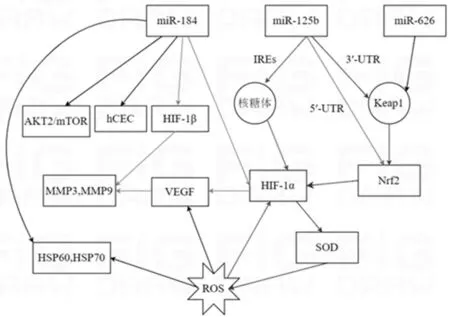
图1 miRNA在非渗出性ARMD氧化应激中的作用。
1.2miR-184通过HIF-1α/MMPs或AKT2/mTOR信号通路抑制缺氧减轻氧化应激Aykutlu等[26]通过使用甲磺酸甲氧胺盐(DFX)和H2O2两种缺氧和氧化应激诱导物建立体外ARMD模型发现miR-184可以通过抑制缺氧、血管生成和细胞凋亡减轻氧化应激和DNA损伤引起的非渗出性ARMD改变,转染miR-184后抗氧化和DNA修复基因减少;过表达miR-184,HIF-1α和HIF-1β基因表达显著降低,HIF轴下游的基质金属蛋白酶(MMP)3基因和MMP9基因表达也降低。氧化应激诱导ARPE-19细胞中血管内皮生长因子(VEGF)上调的同时,增加HIF-1α的表达[27]。Babapoor-Farrokhran等[28]发现RPE在氧化应激刺激下,HIF-1α表达增加会引起HIF-1α依赖性血管生成物质升高,促进脉络膜新生血管的发展,但光感受器中HIF-1α低表达也与非渗出性ARMD相关,表明HIF-1α在晚期非渗出性ARMD患者光感受器中发挥作用。Yang等[29]发现miR-184主要来源于RPE-脉络膜,而不是视网膜,过表达miR-184可以抑制人脉络膜内皮细胞(human choroidal endothelial cells,hCEC)的增殖和迁移,而miR-184抑制剂对迁移没有显著影响。miR-184在非渗出性ARMD患者的RPE中表达降低,β-丝氨酸/苏氨酸蛋白激酶(RAC-beta serine/threonine-protein kinase,AKT2)是miR-184的直接靶点,miR-184通过直接结合AKT2并抑制AKT2/哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)信号通路促进RPE分化,miR-184的表达不足促进非渗出性ARMD发展[30-31]。热休克蛋白(HSP60和HSP70)在氧化应激状态下快速表达,可修复未折叠或折叠错误的蛋白质,在非渗出性ARMD中发现氧化应激后HSP60和HSP70基因表达增加,进一步研究发现贝伐单抗和miR-184对HSP60基因表达的抑制作用相似,但在抑制HSP70表达方面,miR-184反而更有效[26,32]。由此可见,上调miR-184可通过HIF-1α/MMPs轴或AKT2/mTOR信号通路抑制与缺氧相关的血管生成信号,延缓非渗出性ARMD的发展。
2 miRNA在非渗出性ARMD脂质代谢中的作用
脂质代谢失调会引发RPE和Bruch膜内过量的脂质积累形成玻璃膜疣,促进非渗出性ARMD的发展[33]。视网膜的Bruch膜中富含脂质,尤其是磷脂和胆固醇,当胆固醇稳态出现失衡,脂质和脂蛋白出现氧化,则会直接损害细胞功能,诱发氧化应激[34-35]。载脂蛋白(apo)是调控脂质代谢和胆固醇代谢过程中重要的结构蛋白,apoB100是早期非渗出性ARMD的标志[36-37]。研究表明,Bruch膜中的脂蛋白与体循环的脂蛋白不同,其含有apoB100、apoE和apoA1,且富含酯化胆固醇,大小与极低密度脂蛋白(very-low-density lipoprotein,VLDL)相似[36-38]。RPE处理脂质的主要方式是通过光感受器外段的吞噬和降解,分泌含有apoB100的脂蛋白消除脂质,同时,RPE还具有主动的胆固醇逆向转运系统,多余的胆固醇通过ABC转运蛋白装载,最终被高密度脂蛋白(high-density lipoprotein,HDL)清除,未被清除的胆固醇重新返回肝脏。当衰老导致HDL和RPE细胞功能下降,未被降解的胆固醇则被RPE细胞以VLDL样脂蛋白的形式分泌到基底外侧,储存到Bruch膜中形成玻璃膜疣[38-40]。RPE细胞通过表达脂蛋白摄入、合成、分泌、胆固醇合成及反向胆固醇转运所必需的成分在维持视网膜胆固醇稳态中发挥关键作用。已发现有多种miRNA参与调节脂质代谢,某些成熟miRNA的缺失可能会影响脂质代谢,导致RPE细胞死亡,继而导致视觉功能丧失[41]。几种常见的miRNA在非渗出性ARMD脂质代谢中的作用见图2。
2.1miR-223和miR-34a及miR-122作用于脂蛋白调控脂质代谢涉及RPE功能障碍的脂质代谢失调是ARMD的发病基础,非渗出性ARMD的标志是黄斑区玻璃膜疣的沉积和地图样萎缩,过量的脂质和蛋白质积聚在Bruch膜中,可引起氧化应激和炎症[42]。HDL具有促进胆固醇排出、抗炎、抗氧化和抗糖尿病的特点,多数研究认为其在心血管疾病、阿尔茨海默症、糖尿病和败血症中发挥保护性作用,但近年部分学者认为较高的HDL与ARMD风险增加相关[14,43]。研究显示,HDL与ARMD的风险增加呈正相关,可能是食物和药物的影响,也可能与HDL亚型有关[15-16]。此外,也有学者发现人RPE细胞分泌的Bruch膜脂蛋白样高密度物质与从血浆中分离的HDL虽然密度和大小相似,但组成结构不同,而多数关于ARMD风险的研究依赖于血浆脂蛋白水平,但实际上眼局部合成和分泌的脂蛋白可能更重要,因此靶向HDL或Bruch膜脂蛋白样高密度物质或许可以延缓非渗出性ARMD的发展[44-45]。研究发现,在玻璃体内注射β淀粉样蛋白诱导发生RPE变性小鼠的RPE/脉络膜中miR-223表达增加,而miR-223可直接抑制高密度脂蛋白受体(HDL-R)的清道夫受体来调节HDL摄取,还可通过抑制羟甲基戊二酰辅酶A还原酶1(HMG-CoA合酶1)和甲基甾醇单加氧酶1抑制胆固醇的生物合成[46-47]。但Zhang等[48]发现apoB/非高密度脂蛋白胆固醇比值是湿性ARMD的独立危险因素。氧化应激引起的脂质过氧化是非渗出性ARMD的主要原因,氧化低密度脂蛋白(oxidized LDL,oxLDL)具有细胞毒性,是由LDL在促氧环境中通过修饰其脂质或蛋白质形成的,在玻璃膜疣中也发现oxLDL的存在,且在RPE下可见到oxLDL沉积[39]。LDL可以由VLDL转变而来,视网膜富含LDL,其可被RPE和Müller细胞中的LDL受体(LDL-R)吸收,LDL-R受损可导致脂质积累和视网膜功能受损,促进非渗出性ARMD的发展[49]。在整个视网膜和非渗出性ARMD患者的黄斑区miR-34a表达明显上调,随着小鼠RPE和视网膜的衰老,miR-34a表达也显著增加,RPE中的miR-34a过表达可能限制apoB100脂蛋白的分泌,导致RPE中脂质积累,诱导细胞功能障碍[50-51]。与miR-34a不同,miR-122是胆固醇和脂肪酸合成的关键调节因子,也是脂蛋白稳态的关键调节因子,miR-122缺乏会降低肝脏微量白蛋白表达,VLDL的产生和血浆脂质水平[52-53]。因此,靶向HDL可以延缓ARMD的发展,LDL-R受损可促进非渗出性ARMD的进展,miR-223可直接靶向HDL抑制胆固醇生成,延缓非渗出性ARMD的发展,而影响oxLDL的miRNA则促进非渗出性ARMD发展。
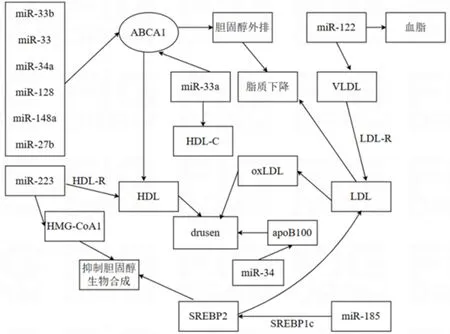
图2 miRNA在非渗出性ARMD脂质代谢中的作用。
2.2miR-33a/b靶向ABCA1调节胆固醇转运参与脂质代谢胆固醇是脂质中的一种,甾醇调节元件结合蛋白(SREBP)与多种miRNA协同促进脂质合成和摄取,miR-185被甾醇调节元件结合蛋白1c(SREBP1c)转录激活并负调节SREBP2表达,从而抑制胆固醇的生物合成和LDL的摄取,调节胆固醇稳态[54]。miR-33b位于17号染色体上SREBP1基因的内含子中,但miR-33b通过靶向ATP结合盒转运蛋白(ABCA1)促进细胞内胆固醇、脂肪酸和其他脂质升高,参与胆固醇的外排[55]。ABCA1是RPE中主要的胆固醇转运蛋白之一,也是一种与ARMD基因相关的胆固醇外排泵,ABCA1过表达可以增加胆固醇排出,减少脂质负荷,提高RPE存活率,从而降低非渗出性ARMD的发生风险[56-57]。RPE中ABCA1的表达随着年龄的增长而逐渐下降,缺乏ABCA1的小鼠会出现胆固醇沉积、RPE和光感受器的变性和炎症[58]。Storti等[58]在缺乏ABCA1的小鼠中也证实RPE中脂质蓄积、视网膜功能降低、视网膜炎症和光感受器变性,表明ABCA1功能降低对非渗出性ARMD的致病作用。抑制miR-33a/b导致ABCA1水平显著升高,抗miR-33a治疗也可显著增加血清总胆固醇中HDL-C的水平,抗miR-33a/b处理非人类灵长类动物的RPE/脉络膜,其游离胆固醇和胆固醇显著降低,胆固醇积累减少,RPE细胞中炎症浸润及RPE形态的病理改变均减少,靶向miR-33可能会减少胆固醇沉积并延缓非渗出性ARMD进展[59]。研究表明,RPE中ABCA1缺失会导致脂质积累和RPE萎缩,miR-33和miR-34a在衰老的RPE细胞中表达增加,通过拮抗ABCA1靶向的miR-33和miR-34a可减轻RPE或巨噬细胞引起的黄斑变性[51]。胆固醇和脂蛋白易沉积于RPE上形成玻璃膜疣;此外,RPE引起的炎症促进免疫细胞浸润,miR-33a/b的靶向治疗可以促进RPE细胞中胆固醇的清除,减少RPE介导的炎症反应,并减轻非渗出性ARMD的病理变化[38]。此外,miR-128和miR-148a可直接降低ABCA1表达,去除肝细胞、巨噬细胞和RPE细胞中多余的胆固醇[60]。总之,RPE中ABCA1的缺失会影响胆固醇排出,导致脂质积累和RPE萎缩,miR-33和miR-34a在衰老的RPE 细胞中表达增加,通过靶向miR-33和miR-34a上调ABCA1可促进RPE细胞中胆固醇的清除和炎症减少,减轻RPE引起的黄斑变性。
2.3几种miRNA通过调节巨噬细胞的胆固醇稳态参与脂质代谢巨噬细胞也参与非渗出性ARMD的发展,衰老巨噬细胞中相应的胆固醇排出能力降低与视网膜炎症水平升高和ABCA1表达下调有关[47]。apoA1可以激活卵磷脂-胆固醇酰基转移酶,将组织内多余的胆固醇转运至肝脏进行代谢,ABCA1可通过apoA1将巨噬细胞内的胆固醇转运至肝脏,并调节HDL的生成,从而控制胆固醇逆向转运[57,61]。Goedeke等[61]发现过表达miR-27b可明显降低ABCA1和线粒体甘油-3磷酸酰基转移酶(GPAM)重组蛋白水平,降低肝脏胆固醇排出和HDL的生成;相反,抑制内源性miR-27b显著增加细胞中ABCA1和GPAM重组蛋白的表达,胆固醇排出增加。因此,miR-27b能调节肝脏胆固醇排出和肝脏中HDL的生成。Nordestgaard等[14]发现ABCA1的遗传变异与高浓度HDL有关,高浓度HDL相关的ABCA1氨基酸改变会增加非渗出性ARMD的发生风险。Kim等[62]也发现ATP结合转运蛋白ABCA1和ABCG1在调节HDL的形成和巨噬细胞胆固醇排出中至关重要,5-氨基咪唑-4-甲酰胺核糖核苷酸(AICAR)可上调RPE中的ABCA1/ABCG1表达,减少apoE缺陷小鼠的Bruch膜脂质沉积。在巨噬细胞衰老过程中,miR-714上调胆固醇的生成,FDFT1作为衰老巨噬细胞和年轻巨噬细胞对胆固醇反应差异的关键miRNA,其通过提高胆固醇的表达诱导非渗出性ARMD的发生,miR-714-FDFT1通过调节衰老巨噬细胞的胆固醇稳态参与非渗出性ARMD形成[63]。总之,巨噬细胞中ABCA1的表达下降会影响胆固醇排出,引起脂质沉积,促进非渗出性ARMD发展。此外,高浓度HDL相关的ABCA1氨基酸改变也会增加非渗出性ARMD的发生风险。
3小结与展望
目前,关于非渗出性ARMD的发病机制研究众多,氧化应激是影响玻璃膜疣的关键因素,本文总结了miR-125b、miR-626和miR-184通过靶向Nrf2、HIF-1α抑制缺氧相关的血管生成信号或减轻RPE氧化损伤影响非渗出性ARMD的发展。此外,在脂质代谢过程中,miR-33a、miR-33b、miR-27b和miR-34a等通过影响脂蛋白的摄取或调节RPE和巨噬细胞中ABCA1的表达调节胆固醇的排出,从而影响非渗出性ARMD的进程。既往已有较多研究证明miRNA对于非渗出性ARMD的发病机制及早期诊断具有重要作用,了解miRNA在非渗出性ARMD中的作用机制将为ARMD提供更好的靶向治疗思路和预防方法。但非渗出性ARMD涉及的氧化应激和脂质代谢机制复杂,关于miRNA是否通过其他信号通路或靶点参与非渗出性ARMD的氧化应激过程和脂质代谢途径有待进一步探究。此外,关于miRNA在非渗出性ARMD自噬、慢性炎症、免疫等方面的研究仍需进一步探索。

