枸杞提取物中玉米黄质和叶黄素含量的高效液相测定方法
唐 瑗,康 瑶,於洪建,张东星
1.天津中医药大学 天津 301617;2.天津益倍生物科技集团有限公司 天津 300457
枸杞是一种传统的药食同源药材[1],尤其利于明目,俗称“明眼子”,其主要活性成分枸杞色素和枸杞多糖[2]具有多种功效,如免疫调节、抗炎、神经保护、护肝护眼、抗氧化[3-4]。枸杞色素主要由游离型类胡萝卜素、类胡萝卜素酯化衍生物和类胡萝卜素糖基化衍生物组成[5],游离类胡萝卜素含有叶黄素、新黄质、玉米黄质和隐黄质等[6]。由于枸杞富含类胡萝卜素,所以常被用于开发护眼健康食品,在年龄相关性眼病研究中,玉米黄质和叶黄素代替β-胡萝卜素成为明目的主要功效性成分[7]。因此,枸杞提取物中叶黄素和玉米黄质分离检测方法的开发,对于研发含有枸杞的明目健康食品具有重要意义。
叶黄素和玉米黄质具有相同的分子式,即C40H56O2,属于同分异构体。目前,高效液相色谱法是叶黄素和玉米黄质最常用的检测方法,用于两者分离的固定相也有多种选择,如硅胶、C18、C30 等。在相关文献中,有研究者运用正相硅胶色谱柱对叶黄素和玉米黄质进行了分离检测,二者都能够实现基线分离[8-9];还有研究者使用C30 色谱柱对叶黄素和玉米黄质进行了分离检测,二者皆可被鉴定[10-15];此外,还有研究者运用C18 色谱柱对叶黄素和玉米黄质进行了分离检测[16-19]。但对于枸杞中叶黄素和玉米黄质的分离检测,更多使用C30 色谱柱,流动相的选择也较为复杂,最常使用二氯甲烷和甲基叔丁基醚作为改性剂。虽然使用C30 色谱柱可以更好地分离叶黄素和玉米黄质,但由于C30 柱价格更高,流动相毒性较大,不利于常规的普及性检测。相比之下,C18 色谱柱是一种常用的固定相,使用C18 色谱柱来建立玉米黄质与叶黄素同时快速测定方法对于枸杞提取物质量控制具有重要意义。同时,该方法的建立有助于推广和普及对叶黄素和玉米黄质的快速测定技术,能够促进具有明目功效的枸杞产品的质量控制研究。
1 材料与方法
1.1 原料与试剂
枸杞提取物(批号:20221001、20221003、20221006、20220417),无锡市世纪生物有限公司;无水乙醇(分析纯),天津市康科德科技有限公司;甲醇、乙腈(色谱纯),天津市康科德科技有限公司;玉米黄质标准品(HPLC≥98%),北京倍特仁康生物医药科技有限公司;叶黄素标准品(HPLC ≥98%),北京倍特仁康生物医药科技有限公司。
1.2 仪器与设备
高效液相色谱仪E2695,沃特世有限公司;超声波清洗器(KQ-500V型),昆山市超声仪器有限公司;台式低速自动平衡离心机(TDZ4-WS),湖南湘仪实验室仪器开发有限公司;旋涡混合器(GL-88B),海门市其林贝尔仪器制造有限公司;电子天平(十万分之一),Mettler-Toledo MS105DU;色谱柱,Innoval ODS-2(4.6 mm×250 mm,5 µm)。
1.3 方法
1.3.1 标准品溶液的配制
精确称取玉米黄质和叶黄素标准品2 mg,分别置于100 mL的棕色容量瓶中,用无水乙醇定容,并作为母液,分别移取标准储备液0.1、0.2、0.5、1、2、5 mL置于10 mL的容量瓶中;用无水乙醇定容,分别得到不同浓度提取的玉米黄质标准品溶液和叶黄素标准品溶液。
1.3.2 供试品溶液的配制
精确称取样品125 mg,置于离心管中,加入无水乙醇适量,用旋涡混合器振荡,超声10 min,以4 000 r/min离心10 min;重复上述操作至无色,将上清液转移至25 mL棕色容量瓶中,用无水乙醇定容至刻度,用0.45 µm微孔滤膜过滤,将其作为供试品溶液。
1.3.3 色谱条件
经优化,确定最佳色谱条件为:色谱柱,Innoval ODS-2(4.6 mm×250 mm,5 µm);流动相0.05%三乙胺-乙腈;流速0.8 mL/min;检测波长450 nm;柱温28 ℃;进样量10 µL。
2 结果与讨论
2.1 提取溶剂的选择
玉米黄质和叶黄素均易溶于有机溶剂,如甲醇、乙腈、无水乙醇、丙酮、二氯甲烷等[20],故分别选用甲醇、乙腈、乙醇3种常用溶剂对叶黄素和玉米黄质标准品进行溶解。叶黄素与玉米黄质在甲醇或乙醇中的溶解度优于乙腈,鉴于甲醇的毒性比乙醇大,且价格高于乙醇,相比之下,选择毒性最小、价格低的乙醇作为提取溶剂。
2.2 流动相的选择
在查阅参考文献的基础上,比较乙腈-甲醇[21-22]、乙腈和乙腈-二氯甲烷[23]3种流动相体系。在乙腈-甲醇流动相中,随着乙腈比例的增加,出峰时间延长,叶黄素与玉米黄质逐渐分离,但未实现基线分离;在乙腈-二氯甲烷(9:1)流动相中,叶黄素与玉米黄质不能很好地分离;在乙腈流动相中,叶黄素和玉米黄质的分离度良好,但随着叶黄素和玉米黄质浓度的增加,存在拖尾现象。故选择纯乙腈作为流动相,为改善拖尾现象,加入0.05%三乙胺,从而获得良好的峰形与分离度。叶黄素、玉米黄质及其混合标准色谱图分别见图1~3,样品见图4。
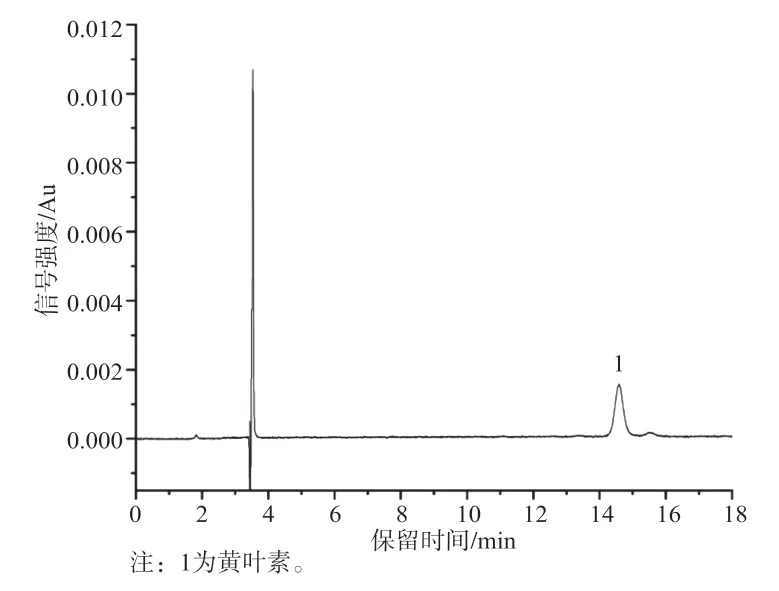
图1 叶黄素标准品色谱图Fig.1 Chromatogram of lutein standard

图2 玉米黄质标准品色谱图Fig.2 Chromatogram of zeaxanthin standard

图3 叶黄素和玉米黄质标准品色谱图(色谱柱Innoval ODS-2)Fig.3 Chromatogram of lutein and zeaxanthin standard

图4 样品色谱图(色谱柱Innoval ODS-2)Fig.4 Chromatogram of sample
2.3 检测波长的选择
取叶黄素和玉米黄质标准溶液分别于200~500 nm处进行波长扫描,结果见图5 ~ 6,叶黄素于447 nm处有最大吸收峰,玉米黄质于453 nm处有最大吸收峰,综合扫描结果,选择450 nm为高效液相色谱检测的测定波长。
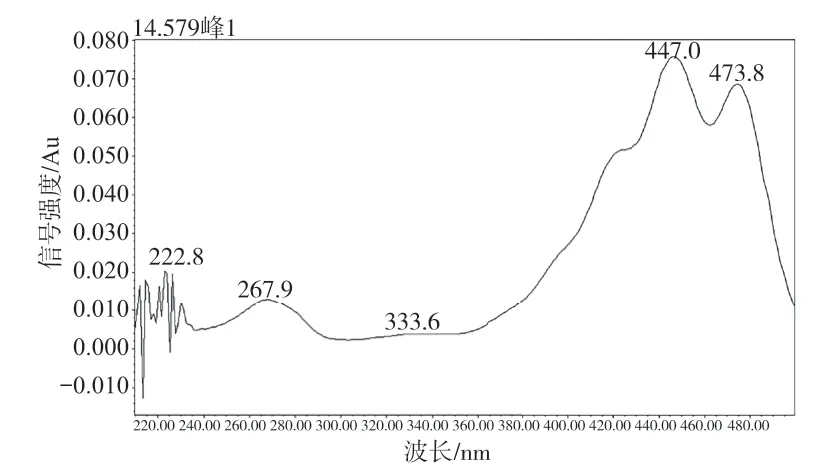
图5 叶黄素光谱图Fig.5 Spectrum of lutein

图6 玉米黄质光谱图Fig.6 Spectrum of zeaxanthin
2.4 检测方法验证实验
2.4.1 线性范围和检测限度
分别吸取1.3.1 中叶黄素和玉米黄质对照品溶液10 µL,记录峰面积,以浓度X为横坐标,以峰面积Y为纵坐标,绘制标准曲线,并进行回归计算,获得玉米黄质的线性回归方程:
叶黄素的线性回归方程
其中:Y为峰面积;X为玉米黄质/叶黄素质量浓度,µg/mL。
结果表明,玉米黄质和叶黄素分别在0.207~20.7 µg/mL和0.216~21.6 µg/mL范围内呈良好的线性关系。用无水乙醇将玉米黄质和叶黄素标准品溶液稀释至一定浓度,记录仪器信噪比(S/N)值,根据S/N≥3 时为仪器检出限,得出玉米黄质的检出限为0.027 µg/mL、叶黄素的检出限为0.056 µg/mL。
2.4.2 精密度试验
精确吸取2.07 µg/mL 玉米黄质对照品溶液、2.16 µg/mL叶黄素的对照品溶液各10 µL,按1.3.3 下色谱条件分别连续取样6 次,记录峰面积,得出玉米黄质的RSD值为0.47%、叶黄素的RSD为0.62%,表明仪器的精密度良好。
2.4.3 稳定性试验
精密吸取同一批供试品溶液,按1.3.3 下色谱条件,分别于0、2、4、6、12、24 h记录玉米黄质和叶黄素的峰面积,得出玉米黄质的RSD值为1.38%、叶黄素的RSD值为4.45%。结果表明,在室温条件下,玉米黄质和叶黄素放置24 h稳定性最好,但考虑到两者抗氧化性和在光照条件下不稳定等因素,所以两者应随测随配。
2.4.4 重复性试验
取批号为20221004 的枸杞提取物6 份,按照上述溶液配制方法制备供试品溶液,在1.3.3 下的色谱条件取样10 µL,记录峰面积,利用标准曲线,测定叶黄素和玉米黄质的含量,得出叶黄素、玉米黄质的RSD值分别为0.96%、0.73%,表明该方法重复性良好。
2.4.5 加样回收率试验
精确称取已知含量的枸杞提取物6 份,每份约26 mg,分别加入20.7 µg/mL的玉米黄质对照品溶液0.5 mL 和21.6 µg/mL 的叶黄素对照品溶液0.1 mL;按照上述溶液配制方法,制备供试品溶液,再按1.3.3下的色谱条件,计算回收率,得出玉米黄质平均回收率为113.72%、RSD值为1.50%、叶黄素平均回收率为105.96%、RSD 值为3.78%,结果见表1 ~ 2,加标回收率结果符合分析要求,试验结果准确可靠。

表1 玉米黄质加样回收率试验考察结果Tab.1 Results of zeaxanthin spiked recovery test
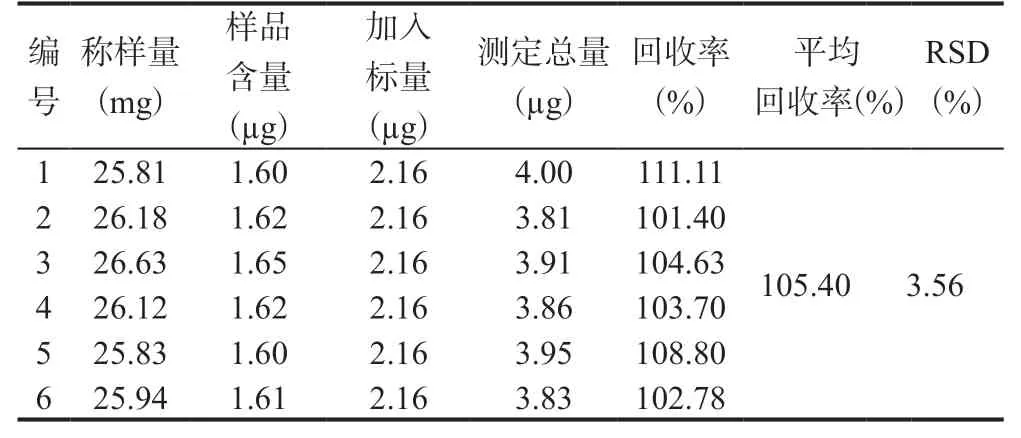
表2 叶黄素加样回收率试验考察结果Tab.2 Results of lutein spiked recovery test
2.5 不同色谱柱的考察
选择2 根载碳量不同的色谱柱,Innoval ODS-2(4.6 mm×250 mm,5 µm)与Durashell C18(L)(4.6 mm×250 mm,5 µm),载碳量分别为14%、17%,在相同的流动相0.05%三乙胺-乙腈、相同的检测条件下,得到结果见图3(色谱柱Innoval ODS-2)、图7(色谱柱Durashell C18(L)),均可实现基线分离。

图7 叶黄素和玉米黄质标准品色谱图[色谱柱Durashell C18(L)]Fig.7 Chromatogram of lutein and zeaxanthin standard
2.6 样品的含量测定
对4 批不同批号的枸杞提取物中玉米黄质和叶黄素进行含量测定,结果见表3。

表3 不同批次枸杞提取物中玉米黄质和叶黄素含量Tab.3 Contents of zeaxanthin and lutein in different batches of Lycium barbarum extract
3 结 语
本研究选用色谱柱Innoval ODS-2(4.6 mm×250 mm,5 µm),以0.05%三乙胺-乙腈为流动相,建立了用高效液相快速准确检测枸杞提取物中叶黄素和玉米黄质的方法。此方法所用流动相简单,叶黄素和玉米黄质能够实现基线分离,且峰形良好无明显拖尾。标准样品和待测样品的测定结果表明,在所取浓度范围内,叶黄素和玉米黄质均具有良好的线性关系,重复性、回收率等均满足分析要求。

