拮抗犬小孢子菌芽胞杆菌的筛选和鉴定
孙雪盼,赵婷婷,郑紫萱,徐子淇,李 静,马红霞,3,高云航,3,么乃全,3,徐凤宇,3,赵传芳
(1.吉林农业大学动物医学院,吉林 长春 130118 ; 2. 江丰(辽宁)生物科技有限公司,辽宁 铁岭 112600 ; 3.动物生产及产品质量安全教育部重点实验室,吉林 长春 130118 ; 4.中国农业科学院特产研究所,吉林 长春 130112)
犬小孢子菌(Microsporumcanis,M.canis)是一种嗜动物性丝状真菌,因导致宠物癣菌病而闻名,为世界范围的人兽共患真菌病病原,主要侵害角质化结构[1]。感染此菌的猫可表现脱毛、水泡、丘疹、结痂、鳞屑和硬皮、红斑、毛孔阻塞、色素沉着、指甲异常生长、瘙痒等症状[2];该菌在人类中主要危害儿童,成人感染该菌与免疫抑制等因素有关[3]。
临床上常用抗真菌药物治疗M.canis感染,但研究表明,犬小孢子菌对酮康唑、灰黄霉素、伊曲康唑和氟康唑等药物的敏感性略低[4];研究发现,该菌的外排机制参与了其对药物的抗性[5]。因此,在应用现有药物治疗该菌感染的同时,研发安全、无副作用的抗M.canis的新方法很有必要[6]。本试验以健康犬、猫和貉粪便为样品,筛选并鉴定了对M.canis有拮抗活性的贝莱斯芽胞杆菌(Bacillusvelezensis,B.velezensis),检测到该菌的发酵上清可损伤M.canis的细胞膜,为B.velezensis及其代谢产物在防控M.canis等真菌危害中的应用提供了参考。
1 材料与方法
1.1 主要试剂 RPMI-1640细胞培养液,购自广州展晨生物科技有限公司;皮肤癣菌测试培养基(Dermatophyte test medium,DTM)和马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基,均购自青岛高科技工业园海博生物技术有限公司;革兰染色液,购自北京欣华绿源科技有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、Gel Signal Red核酸染料、DL2 000 DNA Marker、2×TaqMaster Mix、琼脂糖和TAE缓冲液,均购自生工生物工程(上海)股份有限公司;碘化丙啶(Propidium iodide,PI),购自长春海灵科贸有限公司。
1.2 主要仪器 超净工作台(SJ-CJ-1FD),苏州苏洁净化设备有限公司产品;三温三控水浴锅(DK-8D),上海博讯实业有限公司医疗设备厂产品;倒置荧光显微镜(OLYMPUS IX71),日本奥林巴斯公司产品;Biometra GmbH PCR仪(Tone96G),德国耶拿公司生产;凝胶成像系统GenoSens-1880),上海勤翔科学仪器有限公司产品。
1.3 实验样品、菌种和动物 新鲜健康犬、猫粪便样品采自家庭饲养宠物;貉粪便样品采自吉林中特农业科技有限公司异兽路分公司;金黄色葡萄球菌LY YZ-1、沙门菌CVCC 3775、M.canisZ-3,均由本实验室分离、鉴定并保存;18~22 g昆明小鼠,4只,购自辽宁长生生物技术股份有限公司[生产许可证号:SCXK(辽)2020—0001],预饲7 d。
1.4 试验方法
1.4.1 芽胞杆菌的分离和纯化 无菌取新鲜动物粪便1 g置于试管中,加入无菌生理盐水9 mL,振荡混匀后85 ℃水浴15 min,4 ℃冰箱静置4 h,将上清适当稀释后取150 μL涂于LB固体培养基表面,37 ℃培养24 h;据菌落特征筛选不同芽胞杆菌,编号,纯化。
1.4.2 犬小孢子菌悬液制备 取M.canisZ-3接种于DTM培养基表面,置28 ℃温箱中培养7~10 d,加入RPMI-1640细胞培养液,将菌丝和孢子刮入RPMI-1640细胞培养液中,获得M.canis悬液,4 ℃冰箱保存。
1.4.3 抗犬小孢子菌芽胞杆菌的筛选 初筛:取1.4.2中M.canis悬液150 μL涂于PDA培养基表面,用接种环挑取1.4.1中纯化的芽胞杆菌,点种于M.canis之间,28 ℃培养5~7 d,观察并记录培养结果。
复筛:根据初筛结果选取拮抗作用良好的芽胞杆菌,用平板对峙法[7]验证其抑制M.canis、金黄色葡萄球菌和沙门菌的活性,并按照公式(1)计算其对M.canis的抑制率。处理组接种M.canis菌落(直径5 mm)于PDA固体培养基中心,距其3 cm处两边各点5 μL芽胞杆菌液(5×106CFU/mL),接种环均匀划线;对照组只接种M.canis。2个组均在28 ℃温箱中培养14 d,十字交叉法[7]测量M.canis的菌落直径,计算抑制率。
抑制率(%)=

(1)
1.4.4 动物安全性试验 取37 ℃培养24 h的芽胞杆菌于无菌生理盐水中,调整菌液浓度为1.5×1010CFU/mL,腹腔接种于2只试验组昆明小鼠,0.5 mL/只,对照组小鼠注射0.5 mL无菌生理盐水,相同条件下饲养10 d,每日观察并记录小鼠的生存情况。
1.4.5 芽胞杆菌的鉴定 采用培养特性观察、革兰和芽胞染色以及分子生物学方法对筛选菌株进行鉴定。
分子生物学鉴定方法:(1)按照Ezup柱式细菌基因组DNA抽提试剂盒说明书提取细菌基因组;(2)用16S rDNA通用引物(上游序列:5′-AGAGTTTGATCMTGGCTCAG-3′,下游序列:5′-GGTTACCTTGTTACGACTT-3′)扩增芽胞杆菌的16S rDNA。PCR反应体系(25 μL):模板DNA 1 μL,2×TaqMaster Mix 12.5 μL,上、下游引物各1 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。(3)PCR产物经1%琼脂糖凝胶电泳检测为阳性后,送样至Sangon Biotech生物公司测序。(4)测序结果经BLAST检索程序与GenBank中已有序列比对,用MEGA 6.0软件构建系统发育树。
1.4.6 菌株F-15对犬小孢子菌的抑菌机理初步分析 发酵液制备:接种F-15株至LB液体培养基,于37 ℃、130 r/min培养48 h,12 000 r/min离心30 min,上清液用细菌滤器过滤得发酵液。
取200 μLM.canis菌液(5×106CFU/mL)接种于4 mL RPMI-1640细胞培养液,28 ℃温箱培养48 h,处理组加入200 μL F-15株发酵液,对照组加入200 μL LB液体培养基,28 ℃温箱培养24 h,收集M.canis菌丝。
PI染色:用0.1 mol/L PBS缓冲液重悬M.canis,10 000 r/min离心5 min,弃上清,收集菌丝。加入0.1 mol/L PBS缓冲液和PI(100 μg/mL)各100 μL,室温避光染色30 min;用PBS洗涤,10 000 r/min离心5 min,弃上清,收集M.canis菌丝;加入200 μL PBS重悬菌丝,制备玻片。于490 nm激发光、520 nm发射光的荧光下观察染色结果。
2 结果
2.1 芽胞杆菌的分离和纯化 从新鲜动物粪便样品上清中共获得有不同特性的芽胞杆菌菌落30个。
2.2 抗犬小孢子菌芽胞杆菌菌株筛选 初筛到12株可抑制M.canis的芽胞杆菌(犬源、猫源和貉源分别为3、7和2株),结合抑菌带宽度和芽胞杆菌的抑菌谱,选取对M.canis、金黄色葡萄球菌和沙门菌均有抑制作用的F-15株用于后续试验。
复筛试验中,培养14 d后测量对照组和处理组M.canis菌落直径,结果显示,M.canis的生长可明显被F-15株抑制(图1)。经计算,F-15株对M.canisZ-3的抑制率为64.28%。
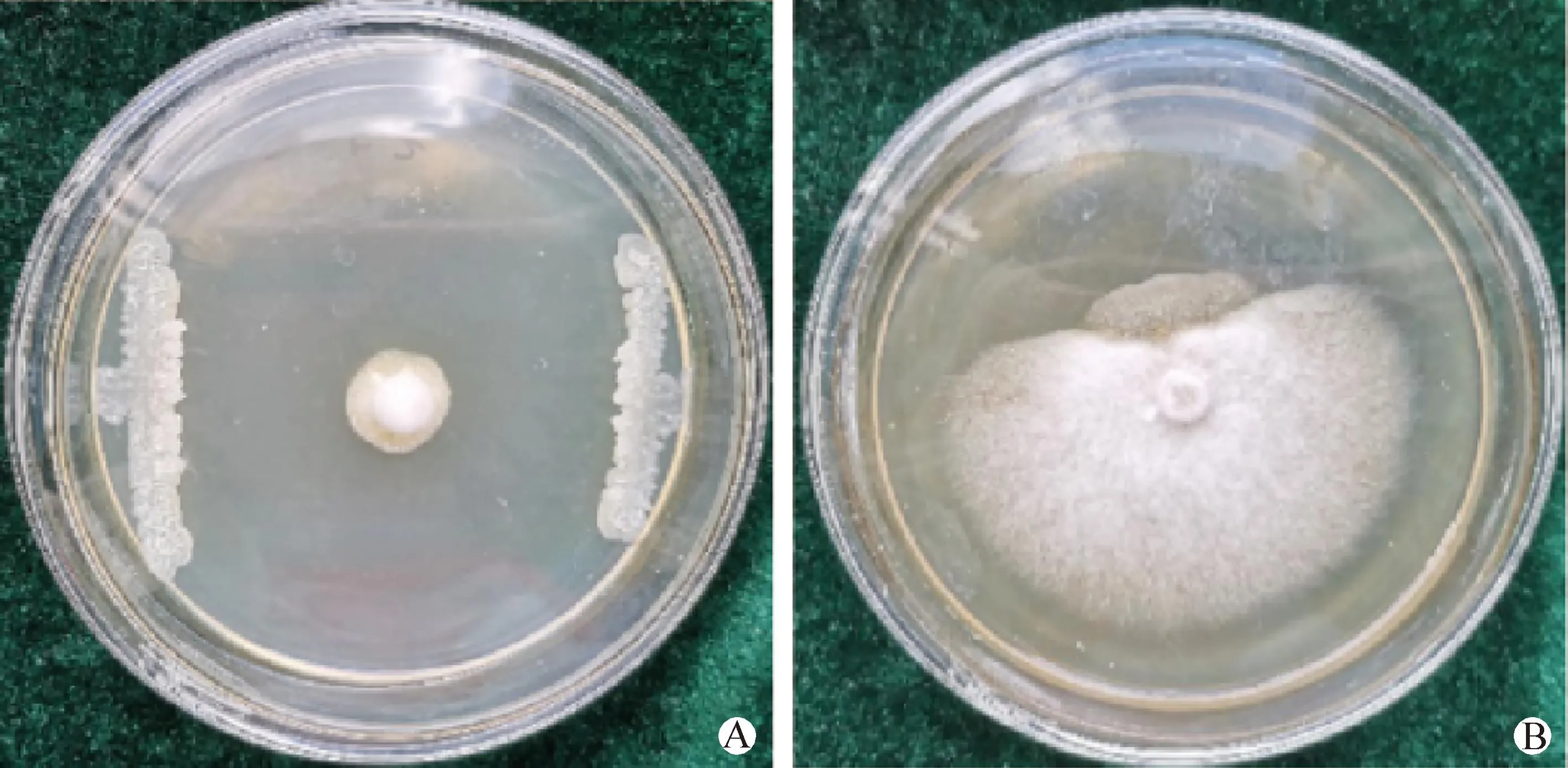
图1 F-15株对犬小孢子菌的抗菌活性
2.3 动物安全性试验 结果显示,在观察的10 d中,试验组和对照组小鼠精神食欲均正常,表明F-15株对实验小鼠安全。
2.4 F-15株的鉴定 在LB液体培养基中,37 ℃培养24 h,F-15株呈沉淀生长伴轻微浑浊;培养48 h,部分菌体沉于管底,表面形成菌膜;在LB固体培养基表面,37 ℃培养20 h,F-15株形成1~3 mm的圆形、白色、不透明菌落,其表面粗糙,边缘呈齿轮状,中心隆起且形成皱褶。
革兰染色后显微镜下观察可见,F-15株菌体呈蓝紫色杆状,游离芽胞不着色,呈椭圆形(图2A);芽胞染色后可见,F-15株菌体呈短链状排列或单在,菌体内芽胞呈绿色椭圆形,略偏于一端,略宽于菌体,表明F-15株为可产生芽胞的革兰阳性杆菌(图2B)。
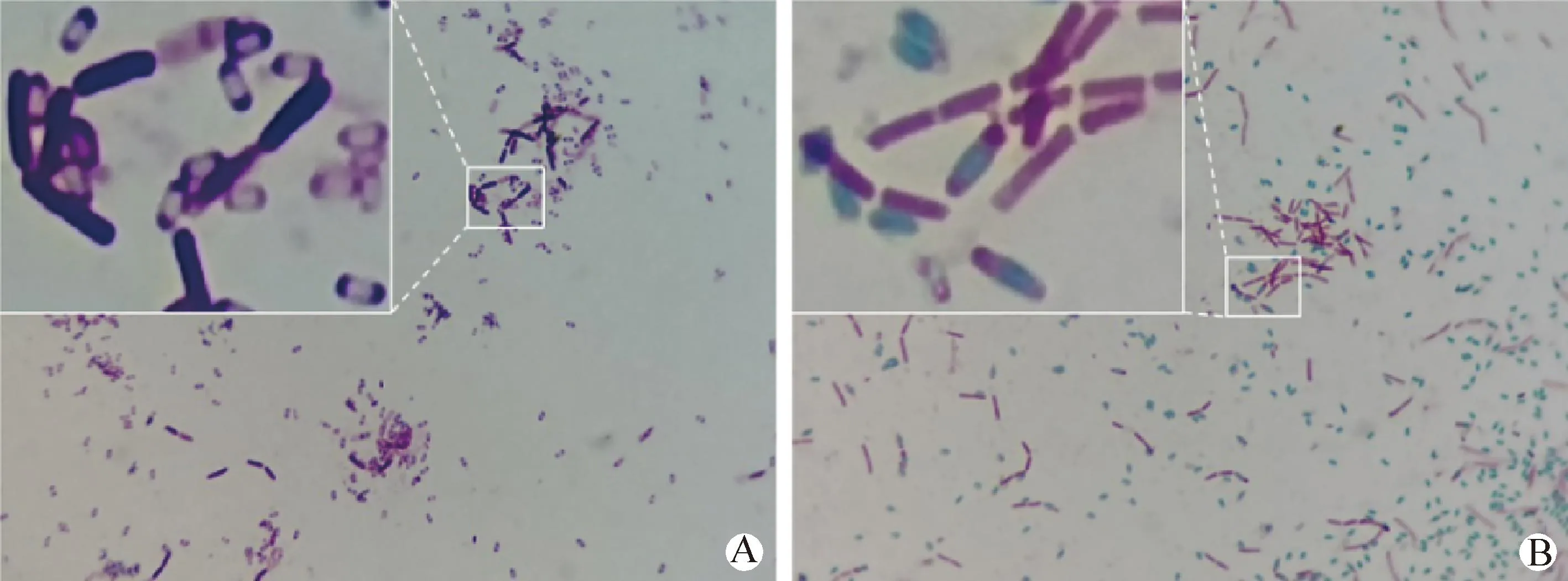
图2 F-15株染色观察 (1 000×)
用细菌通用引物,以提取的F-15株全基因组DNA为模板,进行16S rDNA基因的PCR扩增,结果显示,获得了约1 500 bp的目的条带,大小与预期片段相符(图3)。
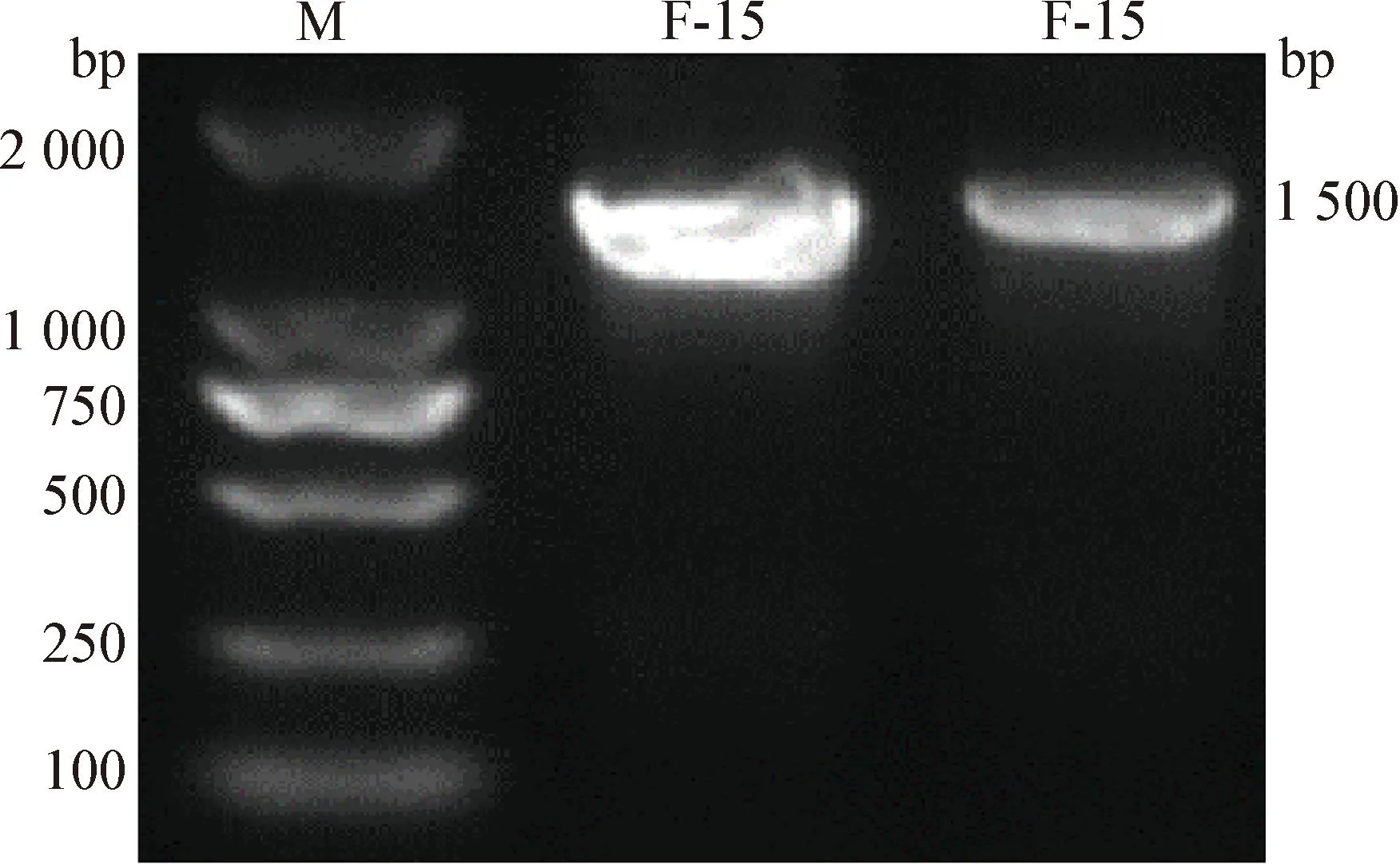
图3 F-15株16S rDNA基因的PCR扩增
经序列比对,F-15株的16S rDNA与HSB1(MT626060.1)株B.velezensis的相应基因相似度为100.00%;系统发育树结果显示,F-15株与B.velezensis位于同一分支(图4)。结合染色、形态学、培养特性和分子生物学鉴定结果,确定F-15株为贝莱斯芽胞杆菌。
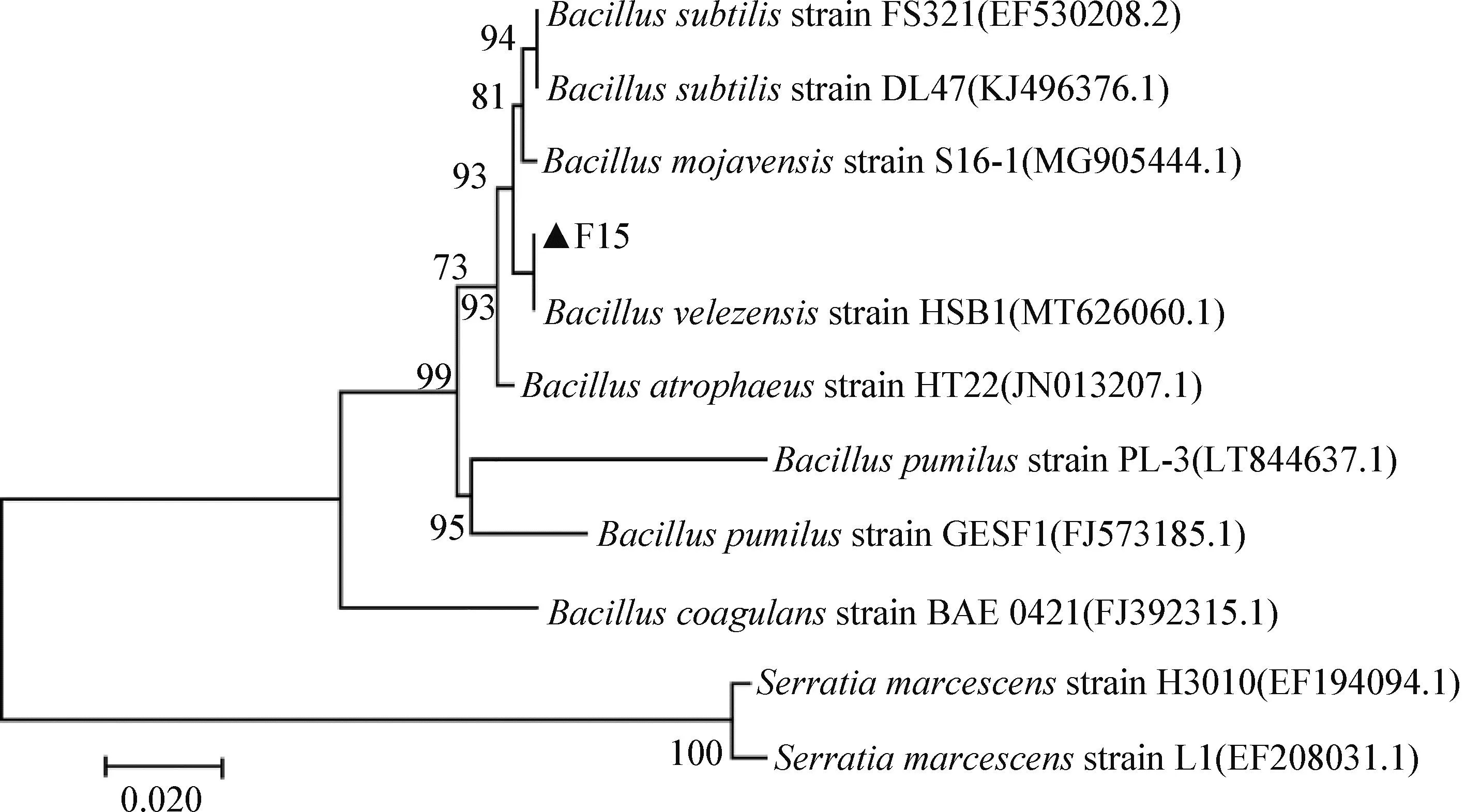
图4 F-15株16S rDNA基因的系统发育树
2.5 F-15株对犬小孢子菌的抑菌机理初步分析 PI染色后,于荧光显微镜下观察,发现处理组M.canis菌丝呈红色荧光,对照组M.canis菌丝未见红色荧光(图5)。表明对照组M.canis菌丝细胞膜完整,PI染料未进入细胞膜内;而处理组M.canis菌丝细胞膜通透性增加,PI进入细胞膜内,与细胞核染色质结合。说明F-15株B.velezensis发酵上清中含有可破坏M.canis菌丝细胞膜完整性的物质。

图5 荧光显微镜下观察犬小孢子菌菌丝
3 讨论
研究表明,M.canis可占伴侣猫、犬皮肤癣菌分离菌株的78.5%[8],也可占人头癣病例分离菌株的87%[9]。因此防治M.canis感染不仅可降低宠物皮肤癣菌病的负担,也可减少其对公共健康的危害。
在探索益生菌对动物病原真菌的拮抗作用过程中,Tunsagool等[10]发现,猫源枯草芽胞杆菌可拮抗M.canis,DY3108株B.velezensis可抑制黄曲霉和寄生曲霉的生长[11]。本试验从健康猫、犬和貉粪便中分离到12株对M.canis有抑制作用的芽胞杆菌,说明具有抗真菌作用的芽胞杆菌普遍存在于健康动物粪便中,其在机体拮抗真菌中的作用及对M.canis感染的预防和治疗效果在以后的试验中可进一步探究。
芽胞杆菌产生的Brevibacillin、表面活性素(Surfactin)、杆菌霉素-D(Bacillomycin-D,属于伊枯草菌素家族)、芬芥素(Fengycin)、多球壳菌素(Myriocin)、几丁质酶、蛋白酶、β-l,3-葡聚糖酶、挥发性有机物等具有抗真菌活性[12-16];其中前5种物质可改变细胞膜的通透性[12-13,17-19]。本试验显示,B.velezensisF-15株的发酵液与M.canis菌丝共孵育24 h后,可使PI进入细胞膜内与DNA 结合,表明发酵上清中含有改变菌丝细胞膜通透性的物质,具体是何种成分发挥了此作用待提纯后深入研究。

