犬腺病毒2型的分离鉴定和致病性分析
刘彩红,崔宁宁,陈亚磊,廖均乐,2,朱进华,刘玉秀,田克恭,2
(1. 国家兽用药品工程技术研究中心,河南 洛阳 471000 ; 2. 河南农业大学动物医学院,河南 郑州 450002 ;3. 河南省动物检疫总站,河南 郑州 450002)
犬腺病毒(Canine adenovirus,CAV)分为两型,犬腺病毒1型(Canine adenovirus type 1,CAV-1)主要在血管内皮细胞和肝、肾实质细胞中增殖,可引起犬急性败血性肝炎以及熊和狐脑炎;犬腺病毒2型(Canine adenovirus type 2,CAV-2)主要在呼吸道上皮和肠上皮内复制,可引起犬科动物传染性喉气管炎和传染性腹泻等[1-3]。1947年,Rubarth最先描述了犬的传染性肝炎[4]。1962年暴发了犬传染性喉气管炎,Ditchfield等在此期间从犬呼吸道中分离出可单纯引起犬呼吸道症状(喉气管炎)而不引起肝炎的腺病毒,即A26株(TorontoA26/61)[5]。CAV-2和CAV-1的形态结构、理化特性和核酸序列大致相似,且CAV-1也能引起犬呼吸道症状,因此认为CAV-2是CAV-1的变异株。随后研究发现,CAV-2不仅能在犬上呼吸道中繁殖引起传染性喉气管炎[6-8],也能在消化道上皮中增殖引起犬传染性肠炎,进而导致犬腹泻[9-10],甚至有的CAV-2可引起神经症状[11],这可能与CAV-2发生变异有关。
CAV在全世界中普遍存在,分布广泛,散播严重,对犬养殖业及相关毛皮经济动物养殖业的经济效益和动物健康造成重大损失和危害,世界各国对其高度重视。其中犬传染性喉气管炎是由CAV-2感染引起的一种犬常见的上呼吸道传染性疾病。
CAV属于腺病毒科哺乳动物腺病毒属,为双链DNA病毒,基因组长为26 163~48 395 bp,病毒粒子无囊膜,直径为80 nm左右,呈二十面体立体对称结构。纤突(Fiber)蛋白在腺病毒感染过程中发挥重要作用,腺病毒依靠纤突小节与细胞表面的特异性受体相结合,纤突小节与腺病毒的组织亲嗜性密切相关[12]。六邻体(Hexon)蛋白是结构最大、数量最多的腺病毒衣壳蛋白,构成整个腺病毒粒子的衣壳表面。五邻体(Penton)蛋白在腺病毒的内化过程中发挥作用,可与细胞内的整合素结合[12]。Penton基因负责病毒的内化,其编码的Penton蛋白对腺病毒的稳定性起着重要作用[13]。腺病毒唯一能够允许外源基因介入的是E3区,是病毒复制的非必需区,该区的编码蛋白具有免疫抑制作用[14],腺病毒感染后转录和表达的第1个基因是E1区(E1a和E1b),E1区对于调控腺病毒复制、转录和激活其他病毒基因表达等方面起着重要作用[15-16]。目前尚未发现与CAV毒力密切相关的氨基酸序列或位点,对于其强弱毒株的判定没有分子生物学标准。但是与其他许多病毒变异一样,在长期的遗传进化过程中,当与CAV毒力密切相关的氨基酸发生变异后,就会引起毒力和致病性改变。
目前我国犬在免疫CAV-2相关疫苗后仍会发病,对于免疫后犬仍感染CAV-2的分离株的研究较少。本试验从武汉市某养殖场免疫过犬四联活疫苗的临床CAV-2发病犬中,分离获得3株CAV-2毒株;并对其E3、Fiber、Penton和E1b基因进行系统进化树分析和致病性试验,旨在为湖北省乃至全国开展CAV-2的流行病学调研、疫苗毒株筛选和预防治疗提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 病料来源 于2020年收集来自湖北省武汉市某比格犬养殖场发病犬的眼、鼻和肛拭子12份(免疫过犬四联活疫苗,且出现呼吸道症状),将其置于1 mL PBS(pH 7.0)中,涡旋混匀,保存于-80 ℃超低温冰箱。
1.1.2 细胞来源 犬肾细胞(MDCK细胞),由国家兽用药品工程技术研究中心鉴定和保存。
1.1.3 实验动物 60日龄左右的健康比格犬[眼、鼻和肛拭子的CAV、犬瘟热病毒(Canine distemper virus,CDV)、犬细小病毒(Canine parvoviurs,CPV)和犬副流感病毒(Canine parainfluenza virus,CPIV)核酸检测均为阴性,且CAV血清中和效价不高于1∶4],购自湖北逸挚诚生物科技有限公司,实验动物生产许可证号:SCXK(鄂)2021—0020,动物试验经普莱柯生物工程股份有限公司实验动物伦理委员会批准,伦理批准文号:202104001。
1.1.4 主要试剂 病毒核酸提取试剂盒Viral Nucleic Acid Extraction Kit Ⅱ,购自Geneaid Biotech Ltd.;2×Prime SRAR Max Premix、DNA Marker DL-5 000和DNA Marker DL-2 000,均购自宝日医生物技术(北京)有限公司;Dulbecco's Modification of Eagle's Medium(DMEM)培养基,购自美国Gibco公司; 胎牛血清,购自Cegrogen Biotech公司;注射用硫酸链霉素和青霉素,均购自华北制药股份有限公司;抗CAV单克隆抗体,购自洛阳普泰生物技术有限公司;FITC标记的山羊抗小鼠IgG,购自洛阳安进商贸有限公司;胶回收试剂盒TIAN Gel Midi Purification KIT(购自天根生化科技(北京)有限公司)、Easy Blunt载体和Trans-T1感受态细胞,均购自北京全式金生物技术(TransGen Biotech)股份有限公司。
1.1.5 主要仪器 PCR基因扩增仪(美国伯乐公司),生物安全柜(苏州安泰空气技术有限公司),电泳仪(北京君意东方电泳设备有限公司),凝胶成像仪(美国UVP公司),倒置显微镜和倒置荧光显微镜(尼康株式会社)。
1.2 方法
1.2.1 病料反转录聚合酶链式反应(Reverse transcription polymerase chain reaction,RT-PCR)/聚合酶链式反应(Polymerase chain reaction,PCR)检测 按照病毒核酸提取试剂盒说明书提取病料样品核酸,参考GenBank公布的CDV、CPV、CPIV和CAV序列,设计CDV、CPV、CPIV和CAV-1/-2鉴定引物(表1),引物由苏州金唯智生物科技有限公司合成。RT-PCR反应体系为10 μL:核酸1 μL,2×One-Step Reaction Mix 5 μL,上、下游引物各 0.5 μL,EasyScript One-Step Enzyme Mix 0.2 μL,ddH2O 2.8 μL。PCR反应体系为10 μL:核酸1 μL,2×EasyTaq PCR Super Mix 5 μL,上、下游引物各 0.5 μL,ddH2O 3.0 μL。RT-PCR反应条件:45 ℃ 30 min;98 ℃ 5 min;95 ℃ 30 s、50 ℃ 30 s、72 ℃ 30 s,共30个循环;最后72 ℃ 10 min。PCR反应条件:95 ℃ 3 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 60 s,共30个循环;最后72 ℃ 10 min。RT-PCR/PCR扩增产物进行1%琼脂糖凝胶电泳检测,CDV、CPV、CPIV、CAV-1和CAV-2的目的条带大小分别为668、800、475、520和1 030 bp。

表1 RT-PCR/PCR扩增引物序列信息
1.2.2 病毒分离和培养 取长成良好的单层MDCK细胞,弃去上清,用无血清DMEM培养基清洗3次,取1.2.1检测为CAV-2单纯阳性的病料1 mL,用0.45 μm滤器过滤后全部接种于MDCK细胞,于37 ℃、5%CO2培养箱吸附培养1 h,每15 min轻轻摇动1次;加入含2%胎牛血清的DMEM培养基补至15 mL。同时设置正常细胞对照,置37 ℃、5%CO2培养箱培养,每日观察细胞病变。若出现“葡萄串”状典型细胞病变,待细胞病变达80%以上时,反复冻融3次收毒,分装,置-80 ℃超低温冰箱保存备用;若未出现细胞病变,盲传3代。对分离株病毒液进行CAV-1、CPV、CPIV和CDV四种病毒的RT-PCR/PCR检测,同时以正常细胞作为对照。
1.2.3 病毒含量测定 将MDCK细胞按照2×104个/孔铺于96孔细胞培养板,每孔加入100 μL含4%胎牛血清的DMEM培养基,置37 ℃、5%CO2培养箱中培养。将1.2.2中从病料样品分离培养得到的第1~5代病毒液,用无血清DMEM培养基进行10倍倍比稀释(10-1~10-6)。将稀释的病毒液按每孔100 μL接种到细胞培养板中,每个稀释度接种6个细胞孔,同时设置正常细胞对照(每孔加入100 μL无血清DMEM培养基),置37 ℃、5%CO2培养箱中培养,3 d后观察并记录结果。根据2020版《中华人民共和国兽药典》三部附录中的Reed-Muench法计算分离株的病毒半数感染量(Tissue culture infective dose,TCID50)。
1.2.4 病毒电子显微镜观察 将培养第5代的病毒液加入到有支撑膜的金属网上,用1%磷钨酸染色液进行染色,用滤纸吸掉金属网上多余的染色液,于透射电子显微镜下观察病毒颗粒的外观和大小。
1.2.5 病毒间接免疫荧光鉴定 将分离病毒株按照感染复数(Multiplicity of infection,MOI)为1.0分别接种至单层MDCK细胞,同时设置正常细胞对照,将96孔细胞培养板置37 ℃、5%CO2培养箱中培养4 d,弃去上清,PBS洗涤细胞2次,加预冷的80%丙酮溶液,4 ℃固定20 min,弃去溶液,PBS洗涤细胞2次,加入1∶400倍稀释的抗CAV单克隆抗体,37 ℃孵育1 h,PBS洗涤细胞2次,避光条件下加1∶500倍稀释的FITC标记的山羊抗小鼠IgG,37 ℃孵育45 min,PBS洗涤细胞2次,于倒置荧光显微镜下观察结果。
1.2.6 病毒E3、Fiber、Penton、E1b基因PCR扩增和序列分析 参照GenBank发布的CAV-2全基因组序列,设计CAV-2E3、Fiber、Penton和E1b基因的特异性PCR扩增引物(表2)。PCR反应体系为50 μL:上、下游引物各2 μL,cDNA 4 μL,2×Prime SRAR Max Premix 25 μL,ddH2O 17 μL。PCR反应程序:95 ℃ 3 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 1 min 45 s,共30个循环;72 ℃ 10 min。按照胶回收试剂盒将PCR产物回收,克隆至pEASY-blunt载体中构建质粒,选取5个阳性重组质粒送至苏州金唯智生物科技有限公司测序。使用MegAlign对测序结果和NCBI上发布的E3、Fiber、Penton和E1b基因核酸序列进行相似性分析,使用MEGA 7.0软件对E3、Fiber、Penton和E1b基因序列构建系统发育树,采用邻接法(Neighbor-Joining method)进行进化树分析。

表2 CAV-2 E3、Fiber、Penton和E1b基因PCR扩增引物序列信息
1.2.7 病毒致病性试验 将比格犬随机分为2个组,攻毒组5只犬,每只滴鼻1.0 mL(106.75TCID50/mL)CAV-2 HB405株第5代病毒液,对照组3只犬,不攻毒,连续观察14 d。攻毒前3 天和攻毒后每天测量犬的直肠温度,观察并记录犬的精神、食欲和呼吸道等临床症状。攻毒后每天采集犬的眼、鼻拭子和肛拭子,采用PCR方法检测CAV-2核酸。攻毒后第14天对所有犬安乐后,放血处死,拍照并记录组织病变,剖检收集组织样品,特别是出现病变的组织,如肺脏、喉头、气管、肠系膜淋巴结、颌下淋巴结、肠和脾脏等,用10%福尔马林固定组织,常规组织脱水、透明和包埋,制备组织切片,经过脱蜡至水、苏木精-伊红(Hematoxylin-eosin,H.E.)染色、脱水、透明和封片后,普通光学显微镜下观察结果并拍照记录。
2 结果
2.1 病料PCR/RT-PCR检测 结果显示,病料样品利用CAV特异性引物经PCR扩增后得到大小约1 030 bp的条带,与预期CAV-2阳性片段大小一致(图1),共检测12份样品,3份为CAV-2阳性,分别命名为HB078株、HB404株和HB405株;CDV、CPV、CAV-1和CPIV的PCR鉴定结果均为阴性(图略),说明病料中存在CAV-2。
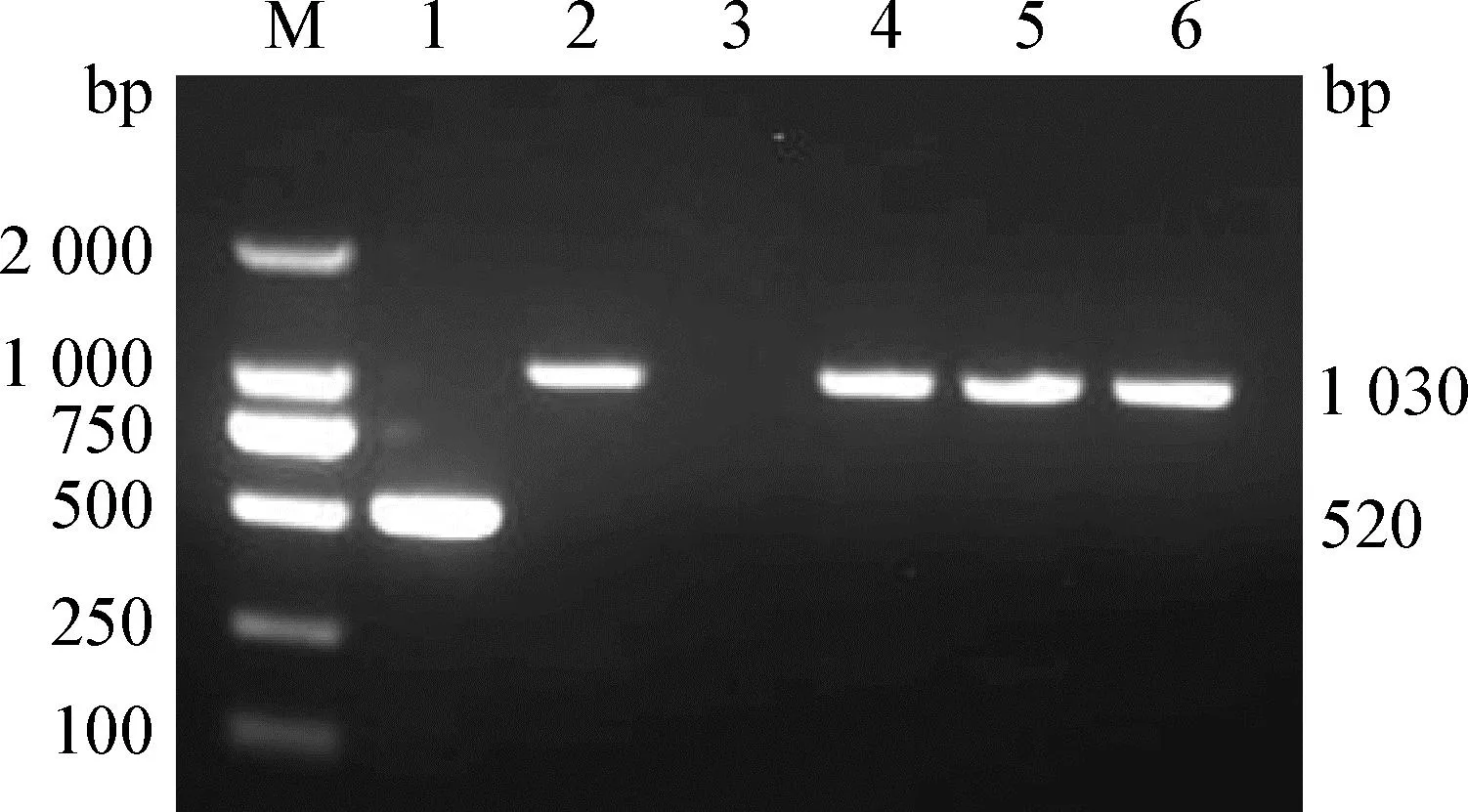
图1 病料中CAV的PCR检测
2.2 病毒分离和培养 将单纯CAV-2核酸阳性病料接种MDCK细胞,培养约48 h,可见80%的MDCK细胞出现体积变大、变圆、通透性变强、细胞聚集成“葡萄串”状,随着接种时间延长细胞逐渐出现脱落(图2),而正常细胞对照未见细胞病变。对培养获得的病毒液进行PCR/RT-PCR检验,结果显示,分离到的3株病毒均为CAV-2核酸阳性,而CAV-1、CPV、CDV和CPIV核酸均为阴性(图3)。结果表明,分离的3株CAV-2均无外源性病毒污染,纯净性良好。

图2 不同CAV-2分离株接种MDCK细胞的细胞形态观察(200×)

图3 不同CAV-2分离株的PCR/RT-PCR检测
2.3 病毒含量测定 对分离获得3株病毒的第1~5代病毒液进行病毒含量测定,结果显示,HB078株的病毒含量为104.00~106.00TCID50/mL;HB404株的病毒含量为104.00~106.00TCID50/mL;HB405株的病毒含量为105.75~106.75TCID50/mL,随着代次升高,病毒含量逐渐升高,说明病毒能够在MDCK细胞上稳定增殖,其中HB405株的病毒含量整体较高,最高可达106.75TCID50/mL(表3)。

表3 不同CAV-2分离株各代次的病毒含量测定
2.4 病毒电子显微镜观察 对分离的HB405株第5代病毒液进行电子显微镜观察,结果显示,观察到的病毒粒子没有囊膜,直径介于80~90 nm,表面有衣壳,具有典型的犬腺病毒粒子形态特征(图4)。

图4 CAV-2 HB405株的电子显微镜观察
2.5 病毒间接免疫荧光鉴定 将3株病毒接种至MDCK细胞,在37 ℃、5%CO2培养箱中培养4 d,进行间接免疫荧光鉴定,结果显示,3株分离株感染的MDCK细胞均出现特异性绿色荧光,正常的MDCK细胞无特异性荧光(图5),进一步证实分离的3株病毒均为CAV-2。

图5 不同CAV-2分离株感染MDCK细胞的间接免疫荧光鉴定
2.6 病毒E3、Fiber、Penton和E1b基因系统进化分析 将3株分离株的E3、Fiber、Penton和E1b四种基因分别与NCBI发布的国内外CAV-2流行毒株和国外疫苗毒株相关基因核苷酸序列进行相似性比较并构建系统进化树,结果显示,3株CAV-2分离株E3基因的相似性为98.8%~100%;与国外疫苗毒株的相似性为98.4%~99.6%,与国内流行毒株的相似性仅为96.6%~97.5%;且3株CAV-2分离株与国外疫苗毒株在同一分支,与国内流行毒株不在同一分支(图6A)。3株CAV-2分离株Fiber基因的相似性为100%;与国内流行毒株的相似性为98.5%~99.7%,与国外疫苗毒株的相似性为99.3%~99.9%,3株CAV-2分离株与国外疫苗毒株A、B在同一分支,与国内流行毒株不在同一分支(图6B)。3株CAV-2分离株Penton基因的相似性为100%;与国内流行毒株的相似性为99.4%~99.9%,与国外疫苗毒株的相似性为99.8%~99.9%,3株CAV-2分离株与国外疫苗毒株A、B在同一分支,与国内流行毒株不在同一分支(图6C)。3株CAV-2分离株E1b基因的相似性为100%,3株CAV-2分离株与国外疫苗毒株在同一分支,与国外疫苗毒株的相似性为99.5%~99.7%(图6D)。结果表明,3株CAV-2分离株各个基因均与国外疫苗毒株位于同一分支,与国内流行毒株相比,3株CAV-2分离株的亲缘关系与国外疫苗毒株较近。

图6 不同CAV-2分离株的系统进化树
2.7 CAV-2 HB405株对犬的致病性试验
2.7.1 临床症状和剖检观察 结果显示,对照组犬均未见异常(图7A);攻毒组犬于攻毒后第2~4天出现体温升高,第5天恢复正常,持续1~3 d不等;从攻毒后第3天开始,犬出现眼鼻分泌物(图7B~7D)和打喷嚏等临床症状;在攻毒后第4~7天,犬出现食欲减退、精神不振,且眼鼻分泌物增多,严重者出现咳嗽、流眼鼻脓性分泌物;在攻毒后第11天,5只犬均开始出现转归,症状逐渐减轻;在攻毒后第14天,除1只犬有少量眼鼻分泌物和打喷嚏症状外,其余4只犬基本转归。大体剖检观察结果显示,对照组犬肺脏未见异常(图8A);攻毒组犬肺脏可见大面积实变(图8B)。H.E.染色结果显示,对照组犬肺脏均未见异常(图8C),攻毒组犬肺脏、气管和喉头出现严重程度不一的病理变化,严重者肺脏出现肺泡上皮细胞增生,肺泡壁增厚,支气管周围有大量炎性细胞浸润,并伴有出血;个别犬可见嗜酸性核内包涵体(图8D);个别犬的气管、喉头黏膜层和黏膜下层有大量炎性细胞浸润,肠系膜淋巴结髓窦内出血,脾脏局部淤血,颌下淋巴结小灶性出血,肠和扁桃体等脏器未见异常(图略);对照组犬喉头、气管、肠系膜淋巴结、颌下淋巴结、肠和脾脏等器官均未见异常(图略)。

图7 CAV-2 HB405株人工感染犬的临床症状观察
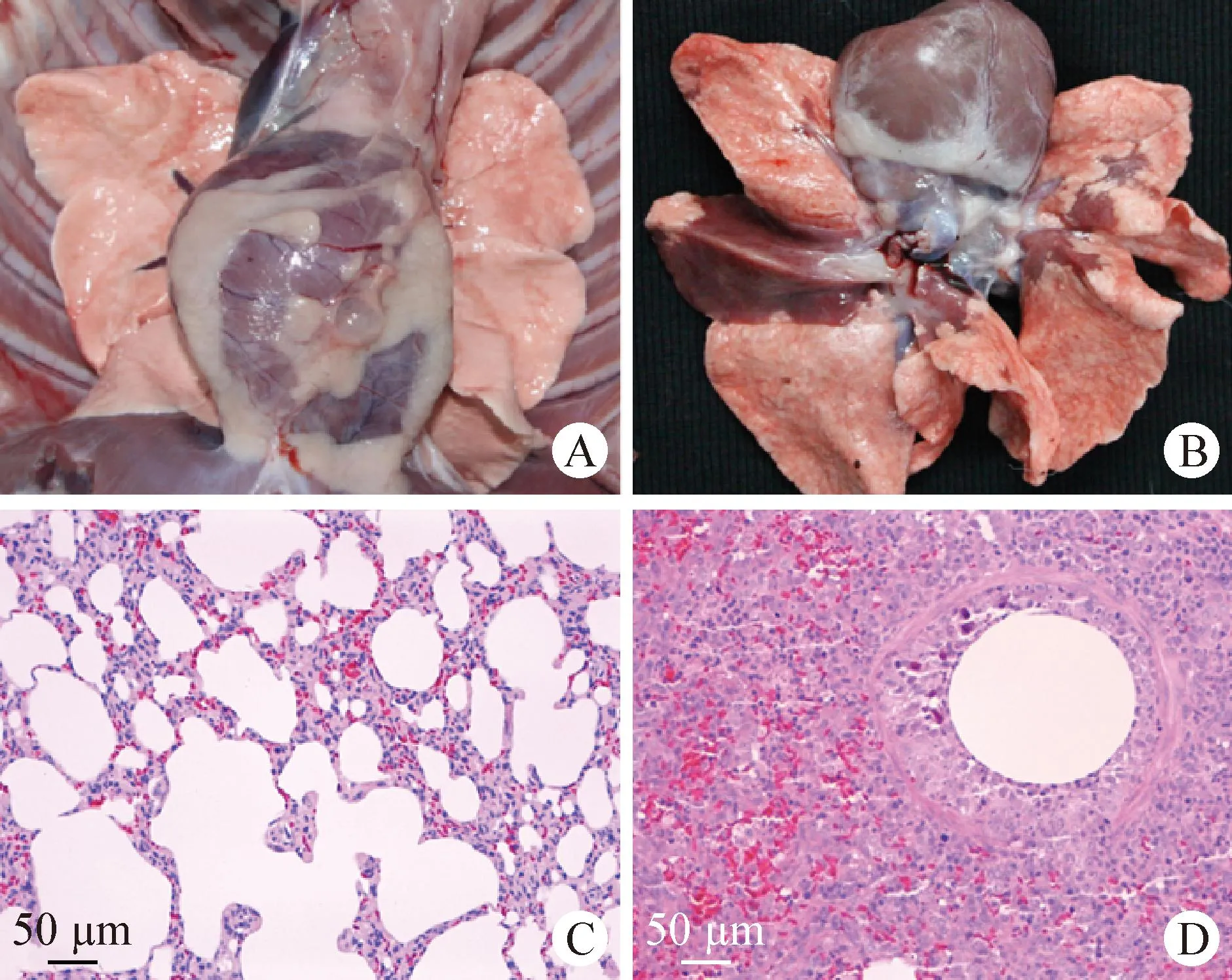
图8 CAV-2 HB405株人工感染犬的肺脏剖检和组织病理学观察(H.E.染色,200×)
2.7.2 CAV-2 HB405株感染犬拭子的CAV-2核酸检测 采用PCR法检测CAV-2核酸,结果显示,对照组所有犬均未检测到CAV-2,攻毒组所有犬均检测到CAV-2,眼、鼻和肛拭子从攻毒后第2天开始即可检测到CAV-2,一直持续到攻毒后第8天,攻毒后第9天开始逐渐转阴,至攻毒后第11天所有犬均未检测到CAV-2(表4)。结果表明,CAV-2 HB405株感染后能够在犬体内复制并排出体外。

表4 CAV-2 HB405株人工感染犬的眼、鼻和肛拭子的排毒检测
3 讨论
CAV-2是引起“犬窝咳”的主要病原之一,免疫CAV-2疫苗能够减轻患犬感染症状并降低CAV-2感染率,但免疫过CAV-2疫苗的犬仍发病的现象时常发生[17-19],CAV-2除了引起犬出现传染性喉气管炎外,还能使犬出现腹泻和神经症状,说明CAV-2毒株一直在变异,提醒我们应重视对CAV-2的防控,同时对CAV-2的防控提出了新的挑战。
本试验从免疫过犬四联活疫苗后仍感染CAV-2的犬的眼、鼻和肛拭子中分离到3株CAV-2,E3、Fiber、Penton和E1b基因序列分析结果显示,与国内流行毒株相比,3株CAV-2分离株与国外疫苗毒株的相似性更高;系统进化树结果显示,3株CAV-2分离株与国外疫苗毒株A、B在同一分支,与国内流行毒株处在不同分支,表明3株CAV-2分离株的亲缘关系与国外疫苗毒株较近。有报道表明,免疫过CAV-2疫苗的犬仍可感染CAV-2,且出现多灶性坏死性支气管肺炎,测序结果显示,感染毒株与疫苗毒株相似性为100%,说明是疫苗中的CAV-2引起犬出现了多灶性坏死性支气管肺炎;虽然活疫苗的疫苗毒株是弱毒株,但仍可能存在毒力返强[20]。早期使用的CAV-1弱毒疫苗出现过毒力返强,引起犬出现“蓝眼”和肾炎等[21]。本试验从患病犬群中分离出CAV-2病毒,人工感染犬后出现食欲减退、精神不振、打喷嚏、咳嗽和眼鼻分泌物等临床症状,且引起犬肺脏的病变,说明CAV-2分离株对犬有较强的致病力,提示应注意疫苗的安全性。
当前的CAV疫苗毒株均采用CAV-2,我国各研究机构、养殖场和宠物医院使用的预防CAV-2的疫苗大多为国外疫苗,尽管疫苗的使用能降低CAV-2感染率,但仍会出现免疫失败的现象。疫苗免疫失败的因素很多,主要有以下几个方面:(1)可能是病毒株出现变异,疫苗与流行毒株不匹配;(2)母源抗体过高;(3)免疫时动物处于疾病的潜伏期或机体处于免疫抑制状态;(4)疫苗运输过程中保存不当引起疫苗中的抗原含量不足。本试验可对我国CAV-2的流行病学研究提供资料,有助于了解武汉地区CAV-2的遗传变异规律,为后续CAV-2疫苗的研究提供参考。

