不同替米考星制剂的体外溶出和体内吸收比较
邱 梅,赵良明,于欢坤,王海峰,许国防,孙晓鸣,刘志海,李 秋
(1. 青岛农业大学化学与药学院 农用生物药物创制技术国家地方联合工程实验室,山东 青岛 266109 ;2. 莱山区动物疫病预防与控制中心,山东 烟台 264003)
替米考星(Tilmicosin,TMC)属于大环内酯类药物,是畜禽专用的一种抗生素,具有较强的抗菌活性,抗菌谱较广,主要通过抑制细菌蛋白质合成和协同巨噬细胞杀菌发挥作用,常作为防治畜禽呼吸道疾病的首选药物。替米考星除了具有抗菌和抗支原体作用外,还具有一定的抗病毒作用,尤其是针对猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)[1],并在临床上得到了广泛应用。替米考星临床应用较为安全,但其经静脉或肌肉注射时会对动物的心血管系统产生一定的毒副作用,因此在兽医临床上主要采用口服给药方式。《中华人民共和国兽药典(2020版)》收录的替米考星制剂有注射液、预混剂和溶液,其中预混剂主要在猪临床中应用[2]。目前,我国已有替米考星肠溶颗粒制剂被批准用于兽医临床,一定程度上提高了该药物在动物体内的生物利用度。
已有研究报道了不同替米考星制剂在猪体内的药动学特征,给药方式多为灌服[3-5],鲜少有同时开展体外溶出研究的报道,故本试验选取市售的4个不同厂家的替米考星制剂进行体外溶出试验,并遵循猪临床实际拌料给药方式进行体内吸收试验,考察4种替米考星制剂的体外溶出和体内吸收情况,为进一步研究替米考星制剂体外溶出与体内吸收的相关性提供参考。
1 材料与方法
1.1 药品与主要试剂 替米考星肠溶颗粒R(包被制剂,含量:20%,规格:1 kg/袋,批号:20220104)、替米考星预混剂X(包被制剂,含量:20%,规格:500 g/袋,批号:202206242)、替米考星预混剂Q(普通制剂,含量:20%,规格:200 g/袋,批号:902104020)、替米考星预混剂H(普通制剂,含量:20%,规格:1 kg/袋,批号:A20220606),均为市售药物;替米考星标准品(含量:93.9%,规格:0.1 g,批号:K0311407),购自中国兽医药品监察所;甲醇(色谱级)和乙腈(色谱级),均购自美国天地有限公司;二正丁胺、磷酸和磷酸钠,均购自国药集团化学试剂有限公司;四氢呋喃,购自天津市科密欧化学试剂有限公司。
1.2 主要仪器 高效液相色谱仪(型号:1260),安捷伦科技(中国)有限公司;高效液相色谱仪(型号:UltiMate3000),赛默飞世尔科技(中国)有限公司;离心机(型号:TGL-18M),湖南沪康离心机有限公司;微量移液器(20~200 μL,100~1 000 μL),艾卡(广州)仪器设备有限公司;电子分析天平(型号:SQP),赛多利斯科学仪器(北京)有限公司;氮气吹干仪(型号:KL-512A),北京康林科技有限责任公司;溶出试验仪(型号:RC8MD),天津市天大天发科技有限公司。
1.3 试验动物 24头健康三元杂交断奶仔猪(公母各半),58日龄,体重(20±2)kg,购自山东信成养殖技术服务有限公司。预饲1周不含任何抗生素的全价料,给药前停饲12 h。
1.4 体外溶出 按照《中华人民共和国兽药典(2020年版)》一部“附录0931溶出度及释放度测定法”中的“肠溶制剂方法1”[2],采用浆法,转速为75 r/min。分别取1 g替米考星受试制剂放入750 mL温度为(37.0±0.5)℃的0.1 mol/L盐酸溶液中运转0.5、1.0、1.5和2.0 h,然后加入250 mL温度为(37.0±0.5)℃的0.2 mol/L磷酸钠溶液,调pH至6.8,继续运转15、30、45和60 min,在规定取样时间点吸取5 mL溶出液(同时向溶出仪中补加同温度新鲜溶出介质5 mL),快速过滤后通过高效液相色谱(High performance liquid chromatography,HPLC)检测替米考星累积溶出量,检测条件参照《中华人民共和国兽药典(2020年版)》一部“替米考星”项下的“含量测定”方法[2]。
1.5 体内吸收 本试验经青岛农业大学动物伦理委员会批准(批准号:IACUC-20220910-1)。
1.5.1 试验分组与处理 24 头仔猪随机分为4个组,替米考星肠溶颗粒R组、替米考星预混剂X组、替米考星预混剂Q组和替米考星预混剂H组,每组6 头,公母各半。每组试验仔猪采用单次拌料给药[替米考星给药剂量为20 mg/(kg·bw)],分别于给药前及给药后0.25、0.50、0.75、1、2、4、6、12、24、48和72 h采集前腔静脉血,每次采血约5 mL于肝素钠管内,3 000 r/min离心10 min,分离血浆后于-20 ℃保存备用。
1.5.2 血浆样品处理 参照参考文献[1,3-4,6-7]进行血浆样品处理方法的优化,最终处理方法为:将冷冻保存的血浆样品自然解冻,取血浆样品 0.5 mL 置于 2 mL 离心管中,加入 1 mL 乙腈,涡动混合 2 min,13 000 r/min 离心 10 min,将上清液移至玻璃试管中,置于氮气吹干仪于40 ℃吹干,取出试管,加入 0.25 mL 流动相复溶,涡旋混合2 min,复溶液移至 2 mL 离心管中,13 000 r/min 离心10 min,吸取上清液经 0.22 μm有机滤膜过滤,取 50 μL 进样检测。
1.5.3 色谱检测条件 参照参考文献[1,3-4,6-7]进行HPLC检测条件的优化,最终检测条件为:色谱柱:Agilent TC-C18(250 mm×4.6 mm,5 μm);流动相:水∶乙腈∶磷酸二丁胺(取二正丁胺 168 mL,加 10%磷酸溶液700 mL,边加边搅拌,放冷后,用磷酸调节pH值至 2.5±0.1,加水至1 000 mL。)∶四氢呋喃(720∶180∶50∶50,V/V/V/V);检测波长:290 nm;柱温:30 ℃;流速:1.0 mL/min。
1.5.4 方法学验证 分别取替米考星标准工作液、猪空白血浆、猪空白血浆添加替米考星标准工作液、猪饲喂替米考星后的血浆样品,按“1.5.2 血浆样品处理”方法处理样品后按“1.5.3 色谱检测条件”进行HPLC检测,分析方法适用性;取猪空白血浆添加一定浓度的替米考星标准工作液,采用倍比稀释,按“1.5.2 血浆样品处理”方法处理样品后按“1.5.3 色谱检测条件”进行HPLC检测,取信噪比 S/N≥3 为检测限(Limit of detection,LOD);S/N≥10 为定量限(Limit of quantitation,LOQ)。取猪空白血浆分别加入替米考星标准工作液,制备成替米考星含量分别为0.05、0.10、0.25、0.50、1.00、2.50、5.00和10.00 μg/mL的空白添加样品,按“1.5.2 血浆样品处理”方法处理样品后按“1.5.3 色谱检测条件”进行HPLC检测,以浓度为横坐标,以峰面积为纵坐标建立标准曲线,得到线性回归方程和相关系数。取猪空白血浆,添加低、中、高3个浓度的替米考星标准工作液,制备成添加浓度分别为0.05、0.50和5.00 μg/mL的样品,每个浓度设置5个平行,按“1.5.2 血浆样品处理”方法处理样品后按“1.5.3 色谱检测条件”进行HPLC检测,计算平均回收率和日内精密度,并连续3 d制备和检测3个批次的样品,计算日间精密度。
1.6 统计分析 各组药物采用Excel拟合血药浓度-时间曲线;采用WinNonlin 5.2.1软件分析药动学参数;采用SPSS 23软件进行药动学参数差异显著性检验,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果
2.1 体外溶出 4种替米考星受试制剂在0.1 mol/L盐酸溶液和0.2 mol/L磷酸钠溶液中的溶出情况见表1,累积溶出曲线见图1。由表1和图1可知,替米考星肠溶颗粒R和预混剂X在0.1 mol/L盐酸溶液中2 h的累积溶出量分别为2.61%和12.86%,在0.2 mol/L磷酸钠溶液中30 min的累积溶出量均在90.00%以上,60 min时基本均达到100%,基本满足肠溶制剂的体外溶出要求[2];而预混剂Q和H在0.1 mol/L盐酸溶液中0.5 h的药物累积溶出量均已超过70.00%,在0.2 mol/L磷酸钠溶液中15 min时的累积溶出量基本均为100%。结果表明,肠溶颗粒R和预混剂X在制剂工艺上可耐酸不耐碱,预混剂Q和H的制剂工艺则不耐酸和碱。

图1 替米考星制剂在0.1 mol/L盐酸溶液和0.2 mol/L磷酸钠溶液中的累积溶出曲线
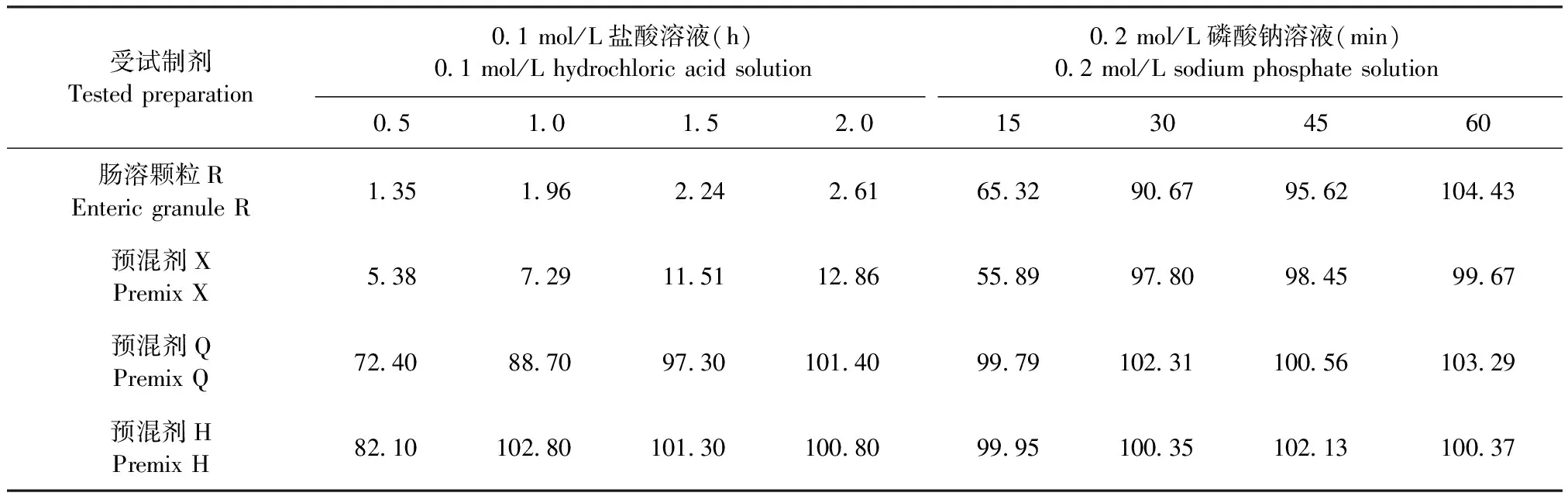
表1 替米考星受试制剂在0.1 mol/L盐酸溶液和0.2 mol/L磷酸钠溶液中的累积溶出量
2.2 体内吸收
2.2.1 方法学验证 替米考星反式异构体峰和顺式异构体峰的保留时间分别约为6.4 min和7.2 min,无杂峰干扰。猪血浆中替米考星药物浓度在0.05~10.00 μg/mL范围内线性良好,回归方程为y=1.986 2x-0.072 4,相关系数r=0.999 7(n=7)(图2)。该检测方法的LOD和LOQ分别为0.025 μg/mL和0.050 μg/mL。猪血浆中替米考星在低、中、高(0.05、0.50和5.00 μg/mL)3个浓度水平下的平均回收率为73.64%~100.26%,日内精密度为1.34%~7.42%,日间精密度为1.35%~13.86%。

图2 替米考星在猪血浆中的标准曲线
2.2.2 血药浓度和药动学参数 受试猪给予不同替米考星制剂后,不同时间点替米考星的血浆药物浓度实测值见表2,药动学参数见表3,血药浓度-时间曲线见图3。

图3 猪给予不同替米考星制剂后替米考星的血药浓度-时间曲线

表2 不同替米考星制剂中替米考星在猪体内的血药浓度

表3 不同替米考星制剂中替米考星在猪体内的药动学参数
由表3可知,替米考星肠溶颗粒R在猪血浆中的主要药动学参数Tmax、AUClast、AUCINF_obs和Cl_F_obs均与预混剂Q具有显著差异(P<0.05),AUClast与预混剂H具有显著差异(P<0.05);预混剂X的主要药动学参数Tmax和Cl_F_obs均与预混剂Q存在显著差异(P<0.05);与预混剂H相比,肠溶颗粒R、预混剂X和Q的相对生物利用度分别为160.35%、153.37%和94.56%。结果表明,替米考星肠溶颗粒R和预混剂X在猪体内吸收和利用效果优于预混剂Q和H,具有达峰浓度高、吸收程度大、消除缓慢和滞留时间较长等药动学特征。
3 讨论
替米考星因为具有独特的肺脏靶向性分布的体内吸收特点,及对畜禽呼吸道感染病原菌和支原体的敏感性,成为了控制畜禽呼吸道疾病最为有效的药物之一,也是目前兽医工作者在防治此类疾病时的首选药物。但因替米考星本身具有苦味,适口性差,很大程度上限制了替米考星制剂口服给药途径的应用。随着替米考星包被制剂的出现,逐渐改善了这一问题。目前,常用的制剂包被工艺包括胃溶性和肠溶性,因替米考星具有胃刺激性,且在胃液中提前释放会降低药物的体内生物利用度,故多选用肠溶性包被工艺。而对制剂工艺优劣的评价主要通过体外溶出和体内吸收等指标进行判定。
本试验通过体外溶出和体内吸收对4种市售替米考星制剂进行比较,其中肠溶颗粒R采用肠溶包被工艺,预混剂X采用微囊包被工艺,预混剂Q和H均为普通制剂。体外溶出结果显示,替米考星肠溶颗粒R和预混剂X在0.1 mol/L盐酸溶液中累积溶出量很少(<13%),在0.2 mol/L磷酸钠溶液能够很好的释放(30 min累积溶出量均在90%以上),基本满足肠溶制剂的体外溶出要求[2]。肠溶颗粒R和预混剂X在制剂工艺上显示了良好的耐酸不耐碱特性,包被工艺保护了替米考星不被酸液破坏,并能够实现在碱性溶液中的良好溶出。
在体外溶出研究的基础上,本试验进行了体内吸收研究。体内吸收结果显示,替米考星肠溶颗粒R和预混剂X在猪体内吸收和利用效果优于预混剂Q和H,具有达峰浓度高、吸收程度大、消除缓慢和滞留时间较长等药动学特征,且具有较好的生物利用度(与替米考星预混剂H相比,相对生物利用度分别为160.35%和153.37%)。国内外有关于替米考星在猪体内的药动学研究报道较多[4-5,8-10],其中Xiong等[5]和钱坤等[9]研究显示,替米考星肠溶颗粒与预混剂相比的相对生物利用度分别为(114.97±7.19)%和(133.93±12.03)%,与本试验的结果基本一致。从提高体内吸收和生物利用度方面考虑,肠溶包被制剂是目前临床上替米考星经口给药途径的较优选择剂型。
综上所述,替米考星肠溶包被制剂能够解决普通制剂存在的易被胃酸破坏、体内吸收差和生物利用度低等问题。根据4种替米考星制剂体外溶出和体内吸收情况的比较,推测替米考星制剂的体外溶出和体内吸收存在一定相关性。近年来研究口服固体制剂体外溶出与体内吸收相关性(Invitro-invivocorrelations,IVIVC)的报道越来越多[11-16],尤其是对于难溶性药物,若能够建立IVIVC,则可以借助体外溶出试验较为快捷、直观地揭示药物在体内的吸收情况,进而快速评价制剂工艺的可行性。目前针对替米考星制剂的体内外相关性的研究报道较少,而替米考星在畜禽临床上应用较广泛,且生产厂家众多,具有多种剂型和规格,如何快速对不同厂家、不同规格或剂型的替米考星产品的一致性进行评价,降低评价成本,IVIVC显得尤为重要,故需要进一步深入研究替米考星的体内外相关性。

