林麝出血性肺炎病原菌的分离鉴定和菌影疫苗的制备
韩金洁,冯梦瑶,房军洋,吕岱玥,王晶钰
(西北农林科技大学动物医学院,陕西 杨凌 712100)
林麝(Moschusberezovsky)属于偶蹄目、麝科(Moschidae)、麝属(Moschus),是亚洲特有野生动物,我国的Ⅰ级重点保护野生动物,被《中国濒危动物红皮书》列为濒危或易危物种。林麝的麝香有较高的药用和经济价值,但由于生境破坏等原因导致林麝数量下降,分布逐步缩减[1]。陕西省是我国林麝人工养殖的主要省份,其中凤县的林麝养殖场数量最多、种群最大,2001—2011年间凤县林麝驯养场由11个增至150个,年均增长率达29.86%,林麝存栏量达到1.9万头[2-3]。
大肠杆菌(Escherichiacoli,E.coli)是自然界中普遍存在的环境致病菌,可引起多种动物的出血性肺炎和其他传染病[4-5]。E.coli引起的肺炎和化脓性疾病是林麝养殖过程中发生的主要疾病之一,常见于幼龄动物,严重时可导致林麝死亡[6-7]。出血性肺炎已经对林麝养殖业的发展造成了不可忽视的威胁。
细菌菌影(Bacterial ghosts,BGs)是细菌的基因组与细胞质内容物从细菌细胞空隙中排出后形成的细菌空壳。菌影疫苗免疫后能诱导免疫系统的固有免疫和适应性免疫应答,可实现预防疾病的作用[8]。菌影疫苗制作有E基因裂解法、化学处理法等多种方法。氢氧化钠(NaOH)能够水解蛋白质和核酸,破坏菌膜的结构,对细菌的代谢产生一定的影响,NaOH处理法是制备菌影疫苗的一种常用方法[9]。
本试验对陕西省凤县发生出血性肺炎的死亡林麝进行病理剖检,采取病变肺脏进行细菌分离纯化、生化和16S rRNA测序鉴定及耐药性检测,并制备E.coli菌影疫苗开展小鼠免疫保护试验,为林麝养殖中E.coli感染导致的肺炎的防控提供技术支持。
1 材料与方法
1.1 病死林麝来源 陕西省宝鸡市凤县某林麝养殖场,死亡林麝发病突然,口鼻流出带血液体,先后共送检10只。
1.2 主要试剂 细菌生化反应管和药敏纸片,均购自杭州滨和微生物试剂有限公司;革兰染色液试剂盒,购自北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒和通用型DNA纯化回收试剂盒,均购自天根生化科技(北京)有限公司;牛肉膏、蛋白胨、氯化钠和琼脂等,均购自北京奥博星生物技术有限公司;LB营养琼脂平板、脱纤维羊血、LB肉汤、哥伦比亚血琼脂基础、麦康凯琼脂平板、伊红美蓝琼脂平板和Mueller-Hinton琼脂(Mueller-Hinton agar,MHA)平板,均购自青岛高科技工业园海博生物技术有限公司;DL2 000 DNA Marker和2×TaqPCR Master Mix,均购自南京诺唯赞生物科技股份有限公司。
1.3 主要仪器 超净工作台,购自北京亚泰科隆实验科技开发中心;37 ℃恒温培养箱,购自黑龙江东拓仪器制造有限公司;恒温摇床,购自西安辉腾生物科技有限公司;PCR扩增仪,购自德国艾本德股份公司;电泳仪和凝胶成像系统分析仪,均购自伯乐生命医学产品(上海)有限公司;台式高速冷冻离心机,购自湖南湘仪实验室仪器开发有限公司。
1.4 实验动物 昆明小鼠,雄性,6~8周,体重15~20 g,购自西北农林科技大学实验动物中心[生产许可证号:SCXK(川)2020—030]。动物试验经西北农林科技大学动物管理及伦理审查执行委员会批准(审批号:XN2022—0106)。
1.5 试验方法
1.5.1 死亡林麝剖检 将死亡林麝置于解剖台上,消毒液清理皮毛后用无菌剪刀沿着腹中线剪开,对林麝体内各个器官组织进行观察,对典型病变拍照并记录。
1.5.2 细菌分离培养和形态学观察 无菌采取剖检林麝的肺脏病健交界处组织,将其分别涂抹于LB营养琼脂平板、5%血琼脂平板(50 mL脱纤维羊血添加于1 000 mL哥伦比亚血琼脂基础中制备成5%血琼脂平板)、麦康凯琼脂平板和伊红美蓝琼脂平板中,分别在有氧和无氧环境下培养24 h,对可疑菌落进行挑纯培养。将可疑菌落常规涂片后进行革兰染色,显微镜观察细菌着色情况和形态。
1.5.3 菌株生化试验 挑取单菌落接种LB肉汤扩增培养,采用细菌生化反应管对分离株进行生化试验,包括葡萄糖、麦芽糖、乳糖和阿拉伯糖发酵试验、甲基红(Methyl red,MR)试验、乙酰甲基甲醇(Voges-Prokauer,V-P)试验、靛基质试验以及柠檬酸盐试验,每个试验分别重复3次,依据《伯杰氏细菌鉴定手册》[10]判定试验结果。
1.5.4 菌株16S rRNA基因PCR扩增和分析 用细菌基因组DNA提取试剂盒提取过夜培养菌液的细菌DNA,将其作为PCR扩增模板进行16S rRNA基因的PCR扩增,使用引物为27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为20 μL:2×TaqPCR Master Mix 10 μL,上游引物(27F)1 μL,下游引物(1492R)1 μL,模板2 μL,双蒸水6 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳检测,并用通用型DNA纯化回收试剂盒回收阳性扩增片段,送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI BLAST中进行比对,再利用MEGA 5.0软件,选择邻近法构建系统进化树。
1.5.5 药敏试验 挑取单菌落至LB肉汤,于37 ℃培养16 h,参照参考文献[11]的方法测定细菌浓度,并用无菌PBS将菌液稀释至浓度为1×108CFU/mL,取100 μL菌液涂抹在MHA平板上。选用10种抗菌药物分别对3株分离株进行药敏试验,将药敏纸片贴在MHA平板上,于37 ℃恒温培养箱中倒置培养24 h,观察结果并测量抑菌圈直径。每种药物重复3次,计算抑菌圈直径的平均值,参照《兽医微生物学实验教程》[12]评定细菌耐药程度。
1.5.6 小鼠致病性试验 将小鼠随机分为4个组,每组3只。3个试验组每组分别腹腔注射5×107CFU/只3株分离株,空白对照组腹腔注射200 μL/只无菌PBS作为阴性对照。小鼠感染后分笼饲养,每4 h观察1次小鼠健康状态,对发病死亡小鼠及时进行剖检并观察记录病变。
1.5.7 菌影制备 参照参考文献[13]的制备方法,将Shaanxi-MX003的分离株LB肉汤培养菌液用无菌PBS调整浓度为2×108CFU/mL,分别将0.1、0.2、0.4、1、2、5和10 mg/mL NaOH与菌液按体积比1∶1混合,37 ℃处理30 min,取少量菌液涂布于LB营养琼脂平板,37 ℃培养24 h后观察,无细菌生长的最小浓度判定为NaOH的最小抑菌浓度。将最小抑菌浓度的NaOH和无菌PBS分别与2×108CFU/mL 的Shaanxi-MX003分离株菌液按体积比1∶1混合,每3 min取样,将样品梯度稀释,通过平板活菌计数法计算菌落数,并按公式(1)计算裂解效率,达到裂解效率为100%的最短处理时间为最佳处理时间。以处理时间为横轴,裂解效率为纵轴,绘制裂解效率曲线。
裂解效率(%)=(1-NaOH处理组菌落数CFU÷PBS处理组菌落数CFU)×100%
(1)
使用最小抑菌浓度的NaOH在最佳处理时间制备的菌影即为E.coli细菌菌影,用2.5%戊二醛在4 ℃条件下固定2 h,扫描电子显微镜观察E.coli细菌菌影的形态结构。
1.5.8 菌影疫苗小鼠免疫保护试验 菌影疫苗制备:取1.5.7中制备的E.coli细菌菌影,在4 ℃条件5 000 r/min离心10 min,弃上清,PBS洗涤沉淀3次,用无菌PBS重悬沉淀即为菌影疫苗。E.coli全菌灭活疫苗制备:参照参考文献[14]的方法向菌液中加入0.5%甲醛溶液,摇床200 r/min、37 ℃培养48 h进行灭活,灭活后的菌液以5 000 r/min离心10 min,PBS洗涤沉淀3次,用无菌PBS重悬沉淀,制成5×108CFU/mLE.coli全菌灭活疫苗。将试验小鼠随机分为5个组,每组5只。空白对照组小鼠皮下注射200 μL/只无菌PBS,灭活疫苗组小鼠皮下注射1×108CFU/只E.coli全菌灭活疫苗,A1、A2和A3菌影疫苗组小鼠分别皮下免疫0.5×108、1.0×108和2.0×108CFU/只菌影疫苗,间隔2周加强免疫1次。参照参考文献[15]中平板凝集试验抗原制备方法,制备大肠杆菌平板凝集抗原(含菌量4.0×109CFU/mL),在二免后2周采血进行平板凝集试验,测定小鼠血清抗体效价。随后各组小鼠均皮下注射5×107CFU Shaanxi-MX003分离株进行攻毒试验,连续7 d每天观察各组小鼠的临床症状并统计死亡率,评价疫苗免疫保护效果。
2 结果
2.1 死亡林麝剖检 死亡林麝剖检前可见口鼻流出带血黏液,剖检后可见心包积液、胸腔积液或积血、肺脏充血和出血,并存在大面积的肺脏淤血(图1)。
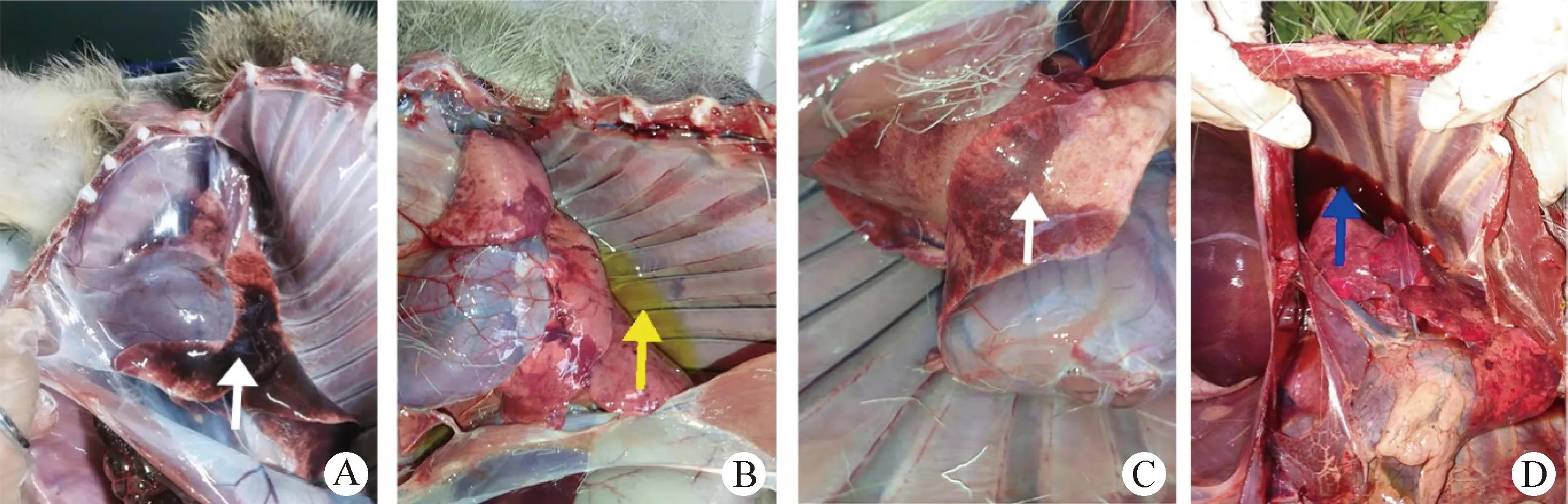
图1 死亡林麝肺脏和胸腔的病变观察
2.2 细菌分离培养和形态学观察 病料接种LB营养琼脂平板培养24 h,可见大量呈灰白色、表面光滑、半透明、直径3 mm左右的菌落,伊红美蓝琼脂平板上菌落表面有金属光泽,麦康凯琼脂平板上菌落呈现粉红色(图2)。挑取特征菌落进行革兰染色镜检,可见两端钝圆的革兰阴性短杆菌,散在或成对(图3)。共分离出3株细菌,命名为Shaanxi-MX001、Shaanxi-MX002和Shaanxi-MX003。
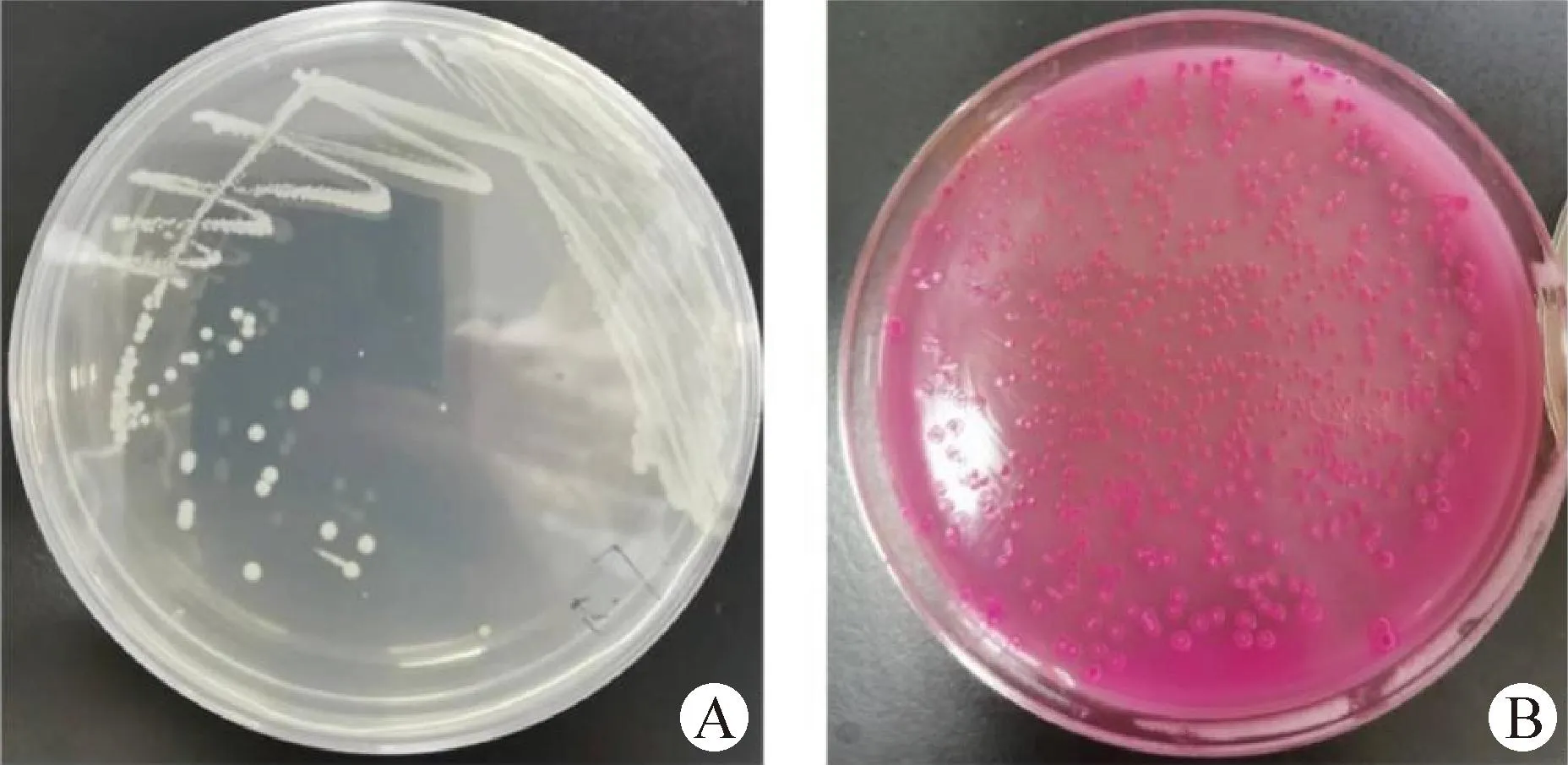
图2 菌株在不同平板上的形态观察
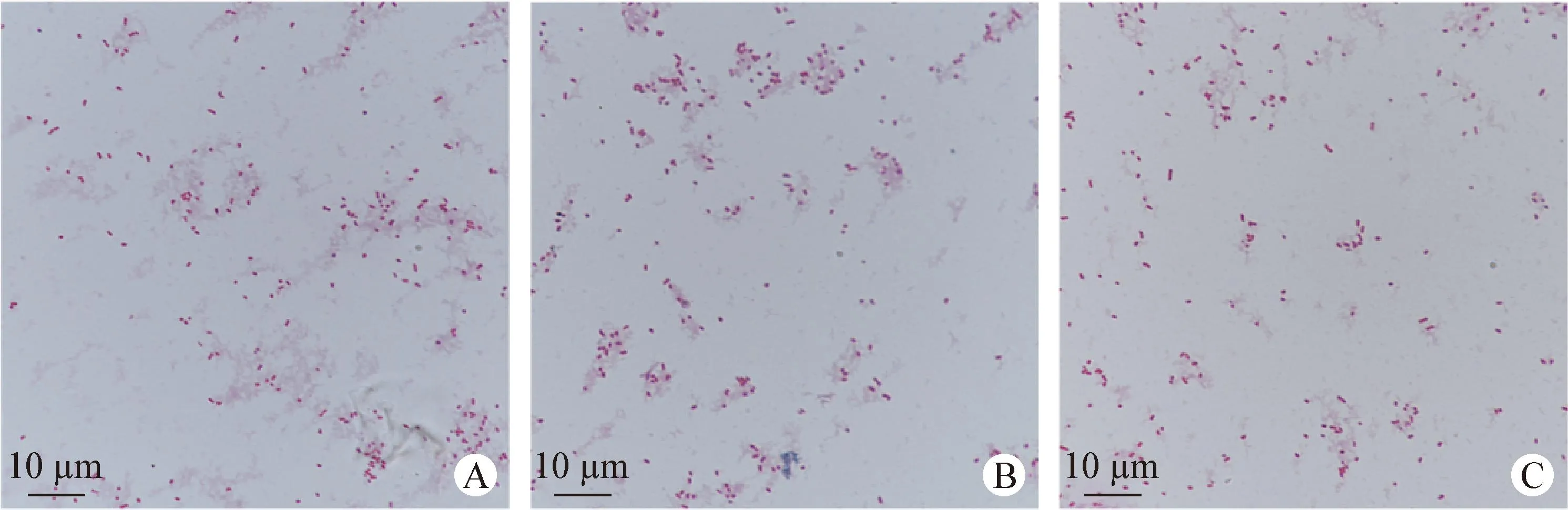
图3 分离株革兰染色的显微镜观察(1 000×)
2.3 菌株生化试验 生化鉴定结果如表1所示,3株分离株均能发酵葡萄糖、麦芽糖、乳糖和阿拉伯糖,MR试验和靛基质试验呈阳性,V-P试验和柠檬酸盐试验呈阴性,根据《伯杰氏细菌鉴定手册》判断标准,可以确定分离株Shaanxi-001、Shaanxi-002和Shaanxi-003均为E.coli。

表1 生化鉴定试验结果
2.4 菌株16S rRNA基因PCR扩增和分析 用16S rRNA引物27F和1492R对细菌DNA进行PCR扩增,可扩增出约1 500 bp的特异性条带(图4)。测序结果与NCBI BLAST数据库进行比对并构建系统发育进化树,Shaanxi-MX001与E.coliCRMY50、Shaanxi-MX002与E.coliSCU-308、Shaanxi-MX003与E.coliE166同源性较高(图5),表明这3株分离株均为E.coli。

图4 分离株16S rRNA基因的PCR扩增

图5 分离株16S rRNA基因的系统发育进化树
2.5 药敏试验 结果如表2所示,3株分离株均为多重耐药菌株。分离株Shaanxi-MX001对头孢唑林、头孢噻吩、哌拉西林、卡那霉素和妥布霉素5种抗菌药物中介,对氨苄西林钠耐药;分离株Shaanxi-MX002对头孢吡肟、头孢哌酮、氧氟沙星和妥布霉素4种抗菌药物中介,对头孢曲松、头孢唑林、头孢噻吩、哌拉西林、氨苄西林钠和卡那霉素6种抗菌药物耐药;分离株Shaanxi-MX003对头孢吡肟中介,对头孢曲松、头孢哌酮、头孢唑林、头孢噻吩、哌拉西林、氨苄西林钠、氧氟沙星、卡那霉素和妥布霉素9种抗菌药物耐药。
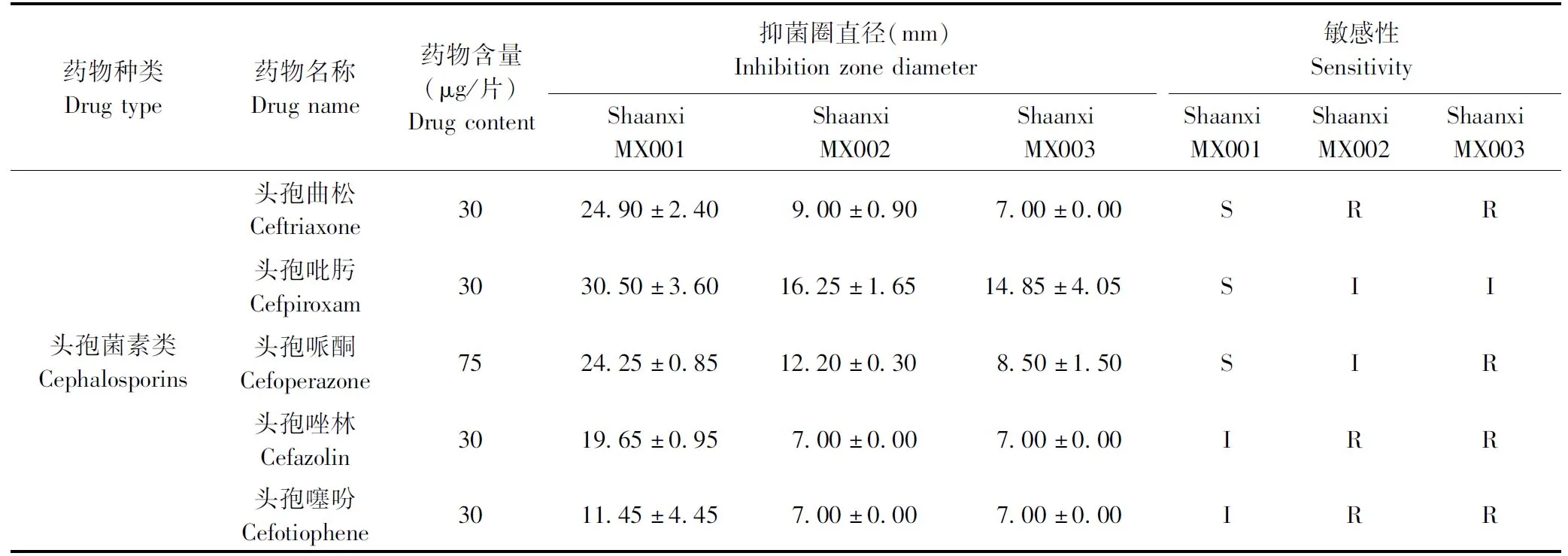
表2 药敏试验结果
2.6 小鼠致病性试验 3株分离菌感染的试验组小鼠均在接种1 d后发生精神沉郁和腹泻的症状,3 d后死亡。剖检可观察到死亡小鼠的肺脏有淤血。无菌采取试验组死亡小鼠肺脏,进行细菌分离鉴定,结果分离出与分离株相同的E.coli。
2.7 菌影制备 LB营养琼脂平板培养结果显示,NaOH对分离株Shaanxi-MX003的最小抑菌浓度为0.4 mg/mL。用0.4 mg/mL NaOH溶液处理菌液,每3 min取样,构建裂解效率曲线,结果显示,NaOH对Shaanxi-MX003分离株的最佳处理时间为15 min(图6),即用0.4 mg/mL NaOH溶液对2×108CFU的菌液处理15 min可成功制备出E.coli细菌菌影。扫描电子显微镜观察显示,E.coli细菌菌影在内容物流失的同时保持了菌体的完整性(图7)。

图6 菌影裂解效率曲线

图7 菌影扫描电子显微镜观察(40 000×)
2.8 菌影疫苗小鼠免疫保护试验 二免后2周,A1、A2和A3菌影疫苗组小鼠血清凝集抗体效价均高于5log2,灭活疫苗组小鼠血清凝集抗体效价在4log2~5log2。攻毒试验结果显示,致病菌感染后3 d,空白对照组小鼠全部死亡(5/5);灭活疫苗组有内毒素反应,小鼠大多精神状况不佳,食欲减退,有1只小鼠死亡(1/5);A1、A2和A3菌影疫苗组小鼠均精神状况良好,未发生死亡;菌影疫苗组比灭活疫苗组有更高的保护率(表3)。
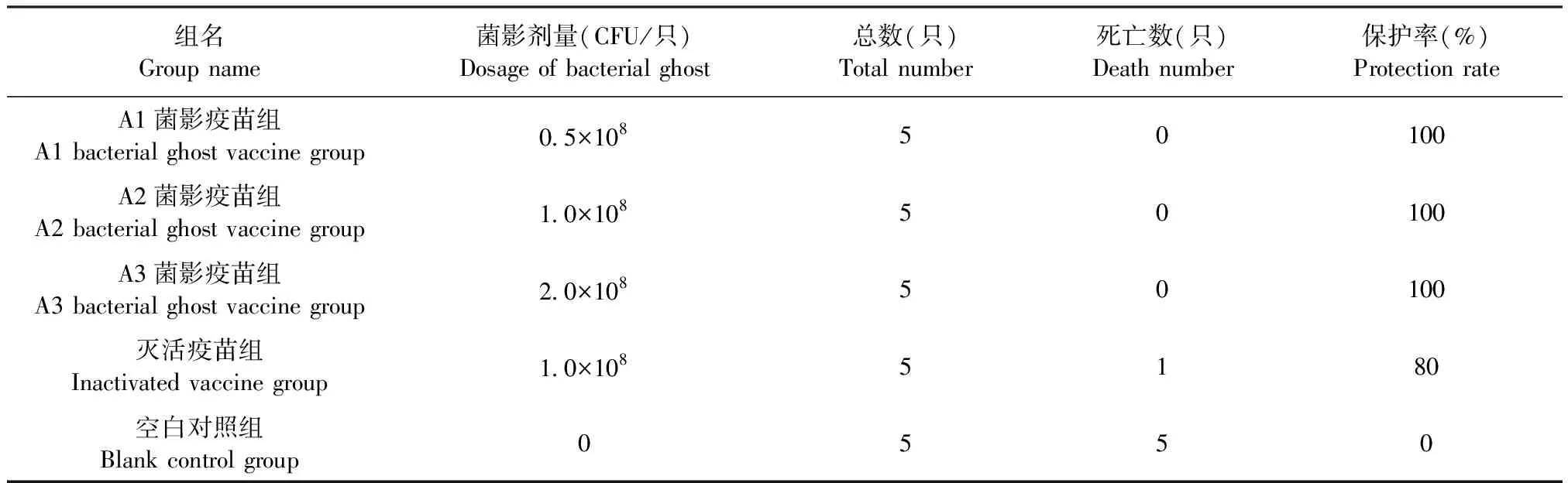
表3 攻毒保护效果
3 讨论
林麝作为我国一级保护动物,其麝香有较高的经济价值,在陕西、四川和甘肃等省份均有规模化人工养殖[16]。林麝肺源性疾病在临床上表现出不同程度的咳嗽、咯血和精神倦怠等症状,并可导致急性死亡,是养殖中面临的一个重要问题[17-18]。
致病性E.coli可以导致人类和不同动物的呼吸道感染,引起严重的肺部疾病[19-21]。由于抗生素的滥用,E.coli的耐药性逐步上升[22]。本试验从发病林麝的肺脏分离出3株致病性E.coli,分离株均具有多重耐药性,且对养殖生产中常用药物(如头孢菌素类)具有明显的耐药性。细菌耐药性的监测,无论是对于人类的未来健康还是养殖业的长期发展,都具有重要的意义。
菌影保留了完整的细菌空壳,而表面的外膜基本成分(如菌体蛋白、脂多糖和肽聚糖等)得到了保留,因此具有良好的免疫原性,能以类似自然感染的方式进入机体,通过巨噬细胞吞噬和抗原递呈细胞诱导机体产生较强的免疫应答,从而增强重组蛋白或DNA等免疫原的免疫原性[23-24]。菌影疫苗作为新型疫苗,在临床上既可以作为疫苗使用,也可以作为递送载体,在药物递送系统中发挥作用[25]。扫描电子显微镜观察显示,本试验中制备的菌影疫苗为细菌的外壳,缺乏所有细胞质物质,但保留有细胞形态和所有细胞表面结构。目前,菌影疫苗主要通过2种方式制备,一种是将裂解基因E引入细菌中裂解菌壁,一种是通过化学手段对菌壁进行裂解[26-28]。NaOH可以通过水解蛋白质来破坏细菌细胞壁的完整性,所以在动物细菌性疾病的菌影疫苗制备中,NaOH是一种常用的裂解手段[29-30]。菌影疫苗具有安全、有效、制备简单和成本低廉等优点。郑文浩[31]在制备细菌菌影疫苗时使用0.75 mg/mL NaOH裂解70 min后可获得裂解完全的菌影疫苗。本试验中用0.4 mg/mL NaOH溶液对2×108CFU的E.coli菌液诱导15 min后,能够高效制备出E.coli菌影,用时较短,推测是因为菌株的差异所导致。
相比传统灭活苗,菌影疫苗能更强地诱导机体免疫反应;相比弱毒疫苗,菌影疫苗没有返毒可能性,安全性更高[13]。研究表明,O157∶H7E.coli菌影疫苗通过口服和皮下注射免疫犊牛2次后,攻毒保护率可达到100%[32]。本试验制备的E.coli菌影疫苗以0.5×108CFU/只的剂量通过皮下2次免疫小鼠后,攻毒保护率可达到100%。下一步计划在发生出血性肺炎的林麝养殖场,将制备的E.coli菌影疫苗用于林麝的免疫预防,为养殖场防控大肠杆菌感染导致的林麝出血性肺炎提供新的方法。

