2019—2021年皖南地区地方品种鸡源沙门菌的血清型鉴定、毒力基因和耐药性检测
吴萍萍,贺绍君
(1.池州职业技术学院生物与健康系,安徽 池州 247000 ; 2. 安徽科技学院动物科学学院,安徽 凤阳 223100)
在鸡养殖过程中,沙门菌成为危害蛋鸡和肉鸡的主要细菌之一[1]。国内外相关研究表明,不同血清型的沙门菌在各个国家不同地区的种鸡场中广泛流行,可以通过水平传播和垂直传播,因此,对种鸡场中沙门菌的净化和防控具有重要意义,目前没有有效的沙门菌疫苗用于种鸡的免疫,这也是导致不同血清型沙门菌流行的主要原因之一[2-3]。在蛋鸡和肉鸡的养殖过程中,沙门菌病主要通过抗菌药物进行治疗,抗菌药物的不合理使用导致沙门菌对临床常用药物表现多重耐药性[4]。沙门菌可以引起多种动物(猪、鸡、鸭、鹅、牛、羊等)发病,是临床常见的食源性病原菌之一,其可以通过食物感染人,以肠炎和腹泻为主要临床症状,严重者可致其死亡[5]。
研究表明,我国地方品种鸡沙门菌感染较严重[6]。因此,对地方品种鸡进行有效的沙门菌净化和防控具有重要意义。鉴于此,本试验以皖南地区地方品种鸡(淮南麻黄鸡、淮北麻鸡、霍邱鸡和五华鸡)为研究对象进行沙门菌感染鉴定,并检测所分离菌株的生物学特性(血清型、毒力基因、耐药性和耐药基因),以期为皖南地区地方品种鸡沙门菌病的防控提供参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 2019—2021年采集安徽省皖南地区地方品种鸡(淮南麻黄鸡、淮北麻鸡、霍邱鸡和五华鸡)养殖场中疑似沙门菌感染病死鸡病料样品(肝脏组织、肛拭子和死胚等)共计456份。
1.1.2 主要试剂 四硫磺酸钠亮绿培养基(Tetrathionate broth base,TTB)、普通营养肉汤、沙门菌-志贺菌琼脂(Salmonella-Shigellaagar,SS)培养基和沙门菌科玛嘉显色培养基,均购自上海户实医药科技有限公司;药敏纸片和沙门菌生化鉴定试纸条,均购自北京百欧博伟生物技术有限公司;沙门菌属血清型鉴定试剂盒,购自广州创仑生物制品有限公司;DL-2 000 Marker,购自广州鼎国生物技术有限公司;2×TaqMaster Mix,购自上海联迈生物工程有限公司;PCR产物回收试剂盒和细菌基因组DNA提取试剂盒,均购上海一基生物试剂有限公司。
1.1.3 主要仪器 双人(单面)垂直超净工作台(SW-CJ-VS2型),无锡易纯净化设备有限公司产品;叠加式恒温恒湿培养箱,上海继普电子科技有限公司产品;PCR扩增仪,翌圣生物科技(上海)股份有限公司产品;凝胶成像系统,广州博鹭腾生物科技有限公司产品。
1.2 方法
1.2.1 细菌分离和鉴定 将采集并处理的病料样品放入PBS,6 000 r/min离心5 min,取上清液,按照1∶100比例分别在无菌条件下接种于TTB培养基,于37 ℃、200 r/min振荡培养8~12 h,取培养物分别接种于沙门菌科玛嘉显色培养基和SS培养基,于37 ℃恒温条件鉴别培养12 ~18 h,经革兰染色后使用显微镜观察分离菌株的形态学特征。
1.2.2 细菌生化鉴定 按照沙门菌生化鉴定试纸条说明书操作,对分离菌株进行生化特性鉴定。
1.2.3 细菌PCR鉴定 参照参考文献[7]报道的沙门菌保守区的invA基因鉴定引物,引物序列为F1:5′-ACAGTGCTCGTTTACGACCTGAAT-3′,F2:5′-AGACGACTGGTACTGATCGATAAT-3′,目的基因片段大小为241 bp,引物由深圳华大基因股份有限公司合成。以提取的分离菌株的基因组DNA为模板,用invA基因鉴定引物进行PCR鉴定。参照PCR产物回收试剂盒说明书操作,将鉴定为阳性的PCR产物进行回收,送深圳华大基因股份有限公司进行基因序列测定,将测序结果与GenBank中登录的参考株进行同源性对比,以同源性>97%进行细菌种属鉴定[8]。
1.2.4 细菌血清型鉴定 参照参考文献[9]报道的Kauffmann-White方法,对临床分离的沙门菌株进行纯化培养并编号(S1~S127),按照沙门菌属血清型鉴定试剂盒说明书操作,进行血清型鉴定。
1.2.5 细菌毒力基因和毒力岛基因检测 参照参考文献[10-11],由深圳华大基因股份有限公司合成沙门菌spvR、spvA、spvB、spvC和spvD 五种毒力基因检测引物,SPI-1、SPI-2、SPI-3、SPI-4和SPI-5 五种毒力岛基因检测引物,采用 PCR 方法对分离的沙门菌株的毒力基因和毒力岛基因进行测定,并利用SPSS 20.0 软件Bivariate功能对分离的沙门菌的血清型与携带的毒力基因和毒力岛基因进行相关性分析。
1.2.6 药敏试验 参照美国临床检验标准委员会(National Committee for Clinical Laboratory Standards,NCCLS)2020年推荐的标准K-B纸片法进行药敏试验,按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的标准判断分离菌株对8种临床常见抗菌药物的耐药性,用耐药(Resistance,R)、敏感(Sensitive,S)或中介(Intermediary,I)表示,统计分析其耐药性数据[12]。
1.2.7 细菌耐药基因检测 参照参考文献[13-14],合成氨基糖苷类耐药基因2种[aac(3)-Iv、aac(6′)-Ib],磺胺类耐药基因3种(sul1、sul2、sul3),β-内酰胺类耐药基因3种(tem、cmy、shv),四环素类耐药基因3种[tet(A)、tet(M)、tet(R)],喹诺酮类耐药基因3种[gyr(A)、gyr(B)、qur(S)],酰胺醇类耐药基因1种[flo(R)],多肽类耐药基因1种(mcr-1),共7类抗生素16种耐药基因。采用 PCR 方法对分离的沙门菌株的16种不同耐药基因进行测定,并利用SPSS 20.0 软件 Bivariate 功能对分离的沙门菌的血清型与携带的耐药基因进行相关性分析。
2 结果
2.1 细菌分离和鉴定 通过细菌分离和培养,疑似沙门菌的分离菌株在沙门菌科玛嘉显色培养基上长出典型的浅绿色菌落,在SS培养基上长出典型的中间带黑心的菌落。分离菌株通过革兰染色并进行显微镜观察,可见两端钝圆、无荚膜的阴性短杆菌。疑似沙门菌菌株的培养特性和形态学特征与《伯杰细菌鉴定手册》中报道的沙门菌培养特性和形态学特征基本一致。
2.2 细菌生化鉴定 沙门菌生化鉴定试纸条检测结果显示,分离菌株的生化特性与标准参考沙门菌株的生化特性符合率为 98.0%~99.9%,被鉴定为沙门菌,经统计共 127株分离菌株初步鉴定为沙门菌。
2.3 细菌PCR鉴定 对临床分离的127株疑似沙门菌株,进一步进行PCR扩增鉴定,结果显示,127株分离菌株均扩增出约为241 bp的目的条带(图1)。测序结果显示,127株分离菌株的测序结果与GenBank中登录的沙门菌参考菌株invA基因片段的同源性均大于97.9%。根据PCR扩增和测序结果,127株分离菌株被鉴定为沙门菌。

图1 分离菌株的PCR鉴定
2.4 细菌血清型鉴定 对分离的127株沙门菌进行血清型鉴定,结果显示,127株沙门菌分属于13种血清型,其中,鸡白痢沙门菌、禽伤寒沙门菌和肠炎沙门菌为流行沙门菌优势血清型,分别占分离菌株的26.0%、20.5%和17.3%;通过分析,13种血清型分别分布于4种不同地方品种鸡中(表1)。

表1 不同地方品种鸡源沙门菌的血清型分布情况(n=127)
2.5 细菌毒力基因和毒力岛基因检测 采用PCR方法检测分离菌株的毒力基因和毒力岛基因的携带情况。结果显示,127株沙门菌中spvA、spvB、spvC和spvR四种毒力基因的检出率介于7.1%~74.8%,SPI-1、SPI-2、SPI-3和SPI-5 四种毒力岛基因的检出率介于38.6%~81.1%,其他的毒力基因和毒力岛基因均未检测出(表2)。相关性分析结果显示,皖南地区地方品种鸡流行优势血清型分离菌株携带的毒力基因和毒力岛基因种类较多,分离的127株沙门菌的血清型与毒力基因和毒力岛基因存在相关性(表3)。
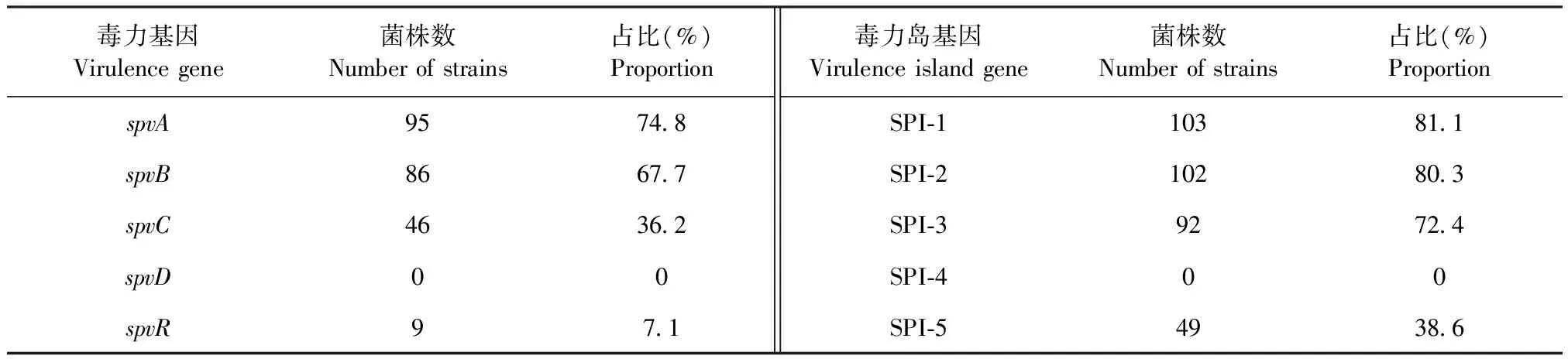
表2 分离菌株的毒力基因和毒力岛基因检测

表3 分离菌株血清型与毒力基因和毒力岛基因的相关性分析
2.6 药敏试验 结果如表4所示,从皖南地区4种地方品种鸡中分离的127株沙门菌对阿莫西林、氨苄西林和磺胺二甲氧嘧啶等8种药物的耐药率介于56.7%~99.2%,对头孢噻呋、大观霉素和多西环素等8种药物的耐药率介于在7.1%~33.1%。结果表明,该地区4种地方品种鸡中分离的127株沙门菌存在不同程度的耐药性。由表5可知,从4种地方品种鸡中分离的127株沙门菌呈现多重耐药性,其中耐10(12.6%)、9(15.0%)、8(20.5%)种药物的分离菌株最多,分离的127株沙门菌株至少耐5种药物。

表4 分离菌株耐药性检测(n=127)

表5 分离菌株多重耐药性检测
2.7 细菌耐药基因检测 采用PCR方法检测分离菌株耐药基因的携带情况。结果如表6所示,127株沙门菌中sul1、sul2、sul3、tet(A)、tet(M)和tet(R)共6种耐药基因的检出率介于32.3%~89.8%;tem、cmy、shv、gyr(A)、gyr(B)、qur(S)、flo(R)、mcr-1、aac(3) -Iv和aac(6′)-Ib共10种耐药基因的检出率介于4.7%~29.9%。相关性分析结果显示,皖南地区地方品种鸡流行优势血清型分离菌株携带的耐药基因种类较多,分离的127株沙门菌血清型与耐药基因存在相关性(表7)。
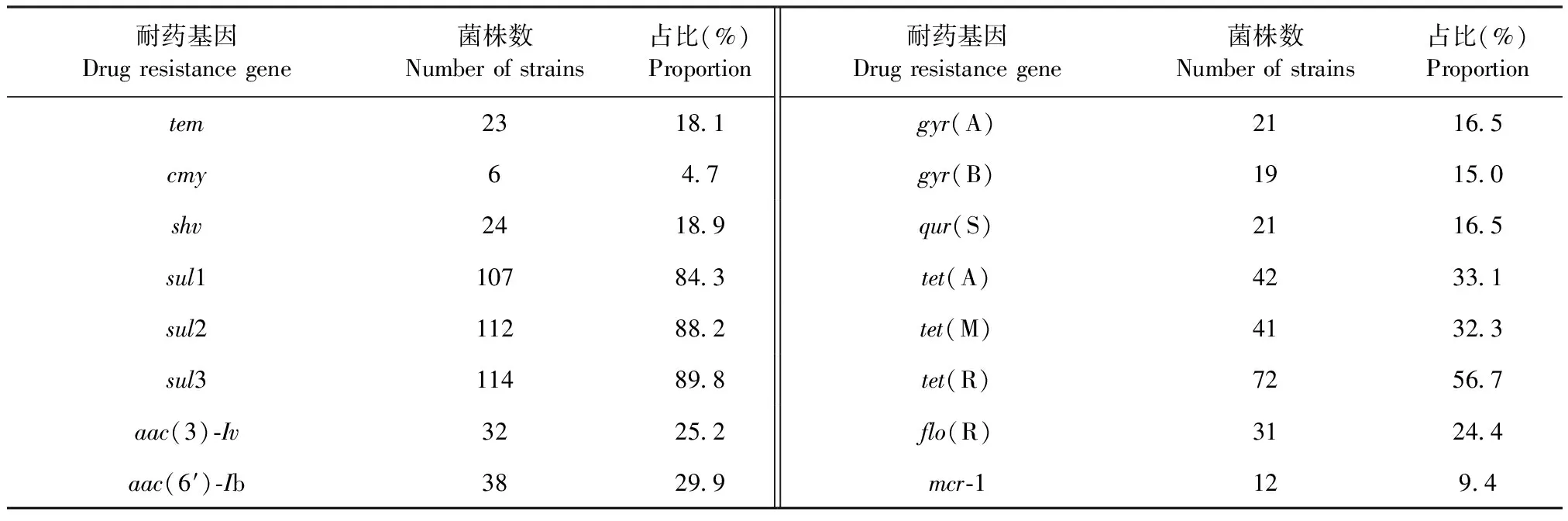
表6 分离菌株耐药基因检测

表7 分离菌株血清型与耐药基因的相关性分析
3 讨论
沙门菌为禽类养殖业中较为常见且危害严重的病原菌之一,该菌可以通过多种途径感染不同种类的禽类(鸡、鸭和鹅等),可以引起腹泻、败血症和卵黄腹膜炎等一系列的炎症反应,严重时可以导致死亡[15-16]。国内许多研究表明,鸡、鸭和鹅等家禽是沙门菌感染的主要宿主,禽类不仅是沙门菌重要的携带者,还是重要的传播者,沙门菌在禽类养殖过程中可以通过多种途径进行传播,最常见的传播方式为水平传播和垂直传播,尤其是种鸡垂直传播危害较大,是导致沙门菌在养殖过程中广泛流行和传播的因素之一[17-20]。本试验结果显示,2019—2021年于安徽省皖南地区地方品种鸡(淮南麻黄鸡、淮北麻鸡、霍邱鸡和五华鸡)养殖场中分离获得127株沙门菌,说明该地区4种地方品种鸡群中沙门菌的流行较严重。可能由于养殖场或者养殖户对地方品种鸡群沙门菌的防控意识较差,导致其地方品种鸡场中沙门菌流行严重,因此,应该注意地方品种鸡群沙门菌的防控和净化。研究表明,鸡源沙门菌具有多种不同的血清型,目前沙门菌尚无有效的疫苗进行预防,且不同地区血清型流行性也存在一定差异[21-22]。本试验从皖南地区4种地方品种鸡中分离获得的127株沙门菌的血清型鉴定结果显示,其分别属于13种血清型,其中以鸡白痢沙门菌、禽伤寒沙门菌和肠炎沙门菌3种优势血清型流行为主。与杨瑞等[9]、崔鹤馨等[11]和罗薇[21]的研究结果存在差异,可能与采样地区和宿主鸡的品种(地方品种、商品蛋鸡)有关,说明不同地区沙门菌的流行血清型呈现多样性。
相关研究表明,沙门菌毒力基因存在于质粒和染色体中,主要包括毒力岛、质粒毒力和肠毒素等,其中毒力岛(Pathogenicity island,SPI)基因主要参与调控沙门菌对宿主细胞的入侵和损伤,毒力基因主要作用于肠道,损伤肠道黏膜。综上所述,毒力基因和毒力岛基因可以有效调控沙门菌的致病性,沙门菌携带的毒力基因和毒力岛基因可能具有潜在致病性[23-25]。本试验结果显示,分离的127株沙门菌分离株中spvA、spvB、spvC和spvR四种质粒毒力基因检出率介于7.1%~74.8%,SPI-1、SPI-2、SPI-3和SPI-5 四种毒力岛基因检出率介于38.6%~81.1%,说明从该地区4种地方品种鸡中分离的127株沙门菌携带多种毒力基因和毒力岛基因,经分析沙门菌血清型与毒力基因和毒力岛基因存在相关性。刘青霄[23]和宋伟[24]均报道地方品种鸡源沙门菌携带多种毒力基因和毒力岛基因,说明毒力基因和毒力岛基因在鸡源沙门菌分离菌株中普遍存在。但是,沙门菌的毒力基因和毒力岛基因作用机理尚未明确,需要进一步研究。
文献报道显示,不同地区的不同养鸡场中流行的沙门菌已经对多种临床中常用的抗生素产生不同程度的耐药性,且部分沙门菌株产生了严重的多重耐药性,沙门菌的耐药性问题已很普遍[26-27]。本试验结果显示,127株沙门菌对阿莫西林、氨苄西林和磺胺二甲氧嘧啶等8种药物的耐药率在56.7%以上,以耐10、9和8种药物为主,说明从该地区4种地方品种鸡中分离的127株沙门菌耐药性严重,且呈现多重耐药性。吴晓君等[7]、羊扬等[28]和晏玲等[6]报道显示,鸡源沙门菌对常用的抗菌药物出现严重的耐药性,说明不同地区养殖场中分离的鸡源沙门菌的耐药性已经成为比较普遍的问题,应该引起重视,合理的使用抗生素,减少耐药性的产生。研究表明,沙门菌的耐药性问题已很普遍,研究沙门菌的耐药机制,对减少其耐药性产生和保护人类健康具有重要的意义[8,15,18]。本试验结果显示,从皖南地区的4种地方品种鸡中分离的127株沙门菌携带多种耐药基因,且分离沙门菌的耐药性与携带的耐药基因存在相关性,说明分离沙门菌的耐药性可能与携带的耐药基因相关。姜梦等[14]报道显示,鸡场分离的沙门菌耐药性较强且携带多种耐药基因。沙门菌耐药基因的作用机理尚未明确,需进一步研究。

