BVDV 非结构蛋白NS4B 的结构分析及其蛋白表达与鉴定
柳凯月,董亚尊,吴双双,马一瑄,刘鸿雁,王北艳,于立权,宋佰芬,马金柱
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.中国农业大学动物医学院)
牛病毒性腹泻病毒(Bovine Viral Diarrhea Virus,BVDV)为黄病毒科瘟病毒属的成员[1],是牛病毒性腹泻病的病原,会引起牛的流产、先天性缺陷、肠炎、呼吸系统疾病、不孕症和乳房炎等症状[2-6]。BVDV 传染性极强,呈世界性流行,严重阻碍了农场养殖业的健康持续发展,给各个国家的养殖业造成了巨大的经济损失。
BVDV 是单股正链RNA 病毒,全基因组长约12.4 kb,共编码11 种蛋白,包括4 种结构蛋白和7种非结构蛋白。NS4B 是BVDV 编码的非结构蛋白之一。研究表明[7-8],NS4B 是诱导膜交替的完整膜蛋白,可作为形成病毒复制复合物的支架[7-8]。BVDV NS4B蛋白显著抑制RIG-I 样受体(RLR)介导的干扰素-β(IFN-β)启动子活性和内源性MDA5 mRNA 水平,BVDV NS4B 蛋白直接与MDA5 的N 末端CARD 相互作用,定位于细胞质中发挥免疫抑制功能[9]。此外,NS4B 蛋白能显著抑制RIG-I 或Cardif 诱导的IFNβ 启动子的激活,而STING 诱导的IFN-β 激活则被NS4B 蛋白抑制,这表明NS4B 蛋白在帮助BVDV 逃逸宿主免疫方面,也发挥着重要的作用[10]。
目前为止,关于牛病毒性腹泻病毒NS4B 作用机制的研究报道较少。对BVDV ns4b 基因进行了结构分析,该序列全长为1 041 bp,可编码347 个氨基酸,且编码的蛋白是疏水性的稳定蛋白。同时成功克隆出BVDV ns4b 基因全长序列,构建了p3×Flag-CMV10-ns4b 真核表达载体,并在HEK-293T 细胞中稳定表达。实验为后续研究BVDV NS4B 蛋白在抗病毒反应中所发挥的作用奠定了基础。
1 材料与方法
1.1 生物信息学分析软件
使用 Prot-Param 在线分析软件分析 BVDV ns4b 基因编码的氨基酸组成、理论分子质量、等电点等基本理化性质;利用在线分析工具TExpasy 对BVDV NS4B 蛋白进行亲疏水性分析;采用SignalP-4.1 程序对蛋白质进行信号肽预测;用SOPMA 在线程序对BVDV NS4B 蛋白的二级结构进行预测;通过SWISS MODEL 程序对BVDV NS4B 蛋白三级结构进行分析。
1.2 材料
PCR 试剂、内切酶(NotⅠ和XbaⅠ)购于New England Biolabs 公司;大肠杆菌(Escherichia coli,E.Coli)感受态细胞DH5α 购于上海唯地生物技术有限公司;质粒提取试剂盒、琼脂糖凝胶DNA 回收试剂盒购于Omega 公司;pcDNA3.1-ns4b 重组质粒由黑龙江八一农垦大学动物科技学院朱战波教授惠赠;T4 连接酶购于TaKaRa 公司;p3×Flag-CMV10 载体质粒购于长春库美生物公司;LB 培养基购于海博生物公司;DMEM(Dulbecco’s Modified Eagle Medium)高糖培养基、青霉素链霉素混合液购于美国HyClone公司;胰蛋白酶-EDTA(0.25%)购于美国Gibco 公司;胎牛血清购于浙江天杭生物科技有限公司;Ultra-Fection 3.0 高效转染试剂购于北京四正柏生物公司;鼠源Flag 抗体、鼠源β-actin 抗体购于北京索莱宝科技有限公司;辣根过氧化物酶标记的羊抗小鼠IgG购于Cell Signaling Technology 公司;ECL 显影液购于Biosharp 公司;HEK-293T 细胞由黑龙江八一农垦大学生命科学技术学院免疫制剂与分子免疫实验室保存。
1.3 目的基因获得
根据GenBank 上提供的BVDV ns4b 基因序列(登录号:NP_776269.1)设计特异性引物,并分别在上下游引物的5′端添加NotⅠ和XbaⅠ的酶切位点和保护性碱基,上游引物序列:5′-CCCGCGGCCGCTGCGTCGGGTGACGTGGAAAAAATC-3′(下划线为NotⅠ酶切位点),下游引物序列:5′-CCGGCTCTAGAGCCAGGTTCCTTATTTTCCCTTGTGAGTCC-3′(下划线为XbaⅠ酶切位点),引物由长春库美生物公司合成。以pcDNA3.1-ns4b 重组质粒为模板进行PCR扩增,PCR 反应体系20 μL:5×Q5 Reaction Buffer 4 μL,2 mM dNTPs 2 μL,上下游引物(10 μmol·L-1)各1 μL,模板1 μL,Q5 High-Fidelity DNA polymerase 0.5 μL,ddH2O 11.5 μL。PCR 反应程序:95 ℃预变性4 min,96 ℃变性30 s,66 ℃退火30 s,72 ℃延伸1 min,35 个循环,72 ℃终止10 min。获得的目的基因ns4b PCR 产物置于-20 ℃冰箱中保存备用。
1.4 重组表达载体构建与鉴定
将获得的PCR 产物和p3×Flag-CMV10 表达载体分别用NotⅠ和XbaⅠ进行双酶切,酶切条件是37 ℃、2 h。载体酶切体系组成:10×buffer 2 μL、NotⅠ内切酶0.5 μL、Xba Ⅰ内切酶0.5 μL、p3×Flag-CMV10 1 μg、去离子水加至20 μL。目的片段酶切体系组成:10×buffer 2 μL、NotⅠ内切酶0.5 μL、XbaⅠ内切酶0.5 μL、ns4b 1 μg、去离子水加至20 μL。纯化后的酶切载体和目的片段采用T4 连接酶在恒温器中16 ℃过夜连接。连接体系组成:T4 连接酶1 μL、10×buffer 1 μL 载体50 ng、目的片段37.5 ng、去离子水加至10 μL,最后,将连接产物转化到E.coli DH5α 感受态细胞中并涂布在含有氨苄抗性的LB 固体培养基上,37 ℃培养箱培养12 h。挑取大小饱满的单一菌落,于37 ℃摇床培养8~12 h 后,用Omega 试剂盒按照操作说明书提取质粒,并采用PCR 扩增和酶切的方法验证获得的重组质粒是否正确。PCR 扩增方法如上所述。重组质粒酶切体系:NotⅠ内切酶0.5 μL、XbaⅠ内切酶0.5 μL、重组质粒1 μg、10×buffer 2 μL、去离子水加至20 μL。酶切产物经1%琼脂糖凝胶电泳进行检测,将验证正确的重组质粒邮寄长春库美公司测序,测序结果正确的质粒命名为p3×Flag-CMV10-ns4b。
1.5 HEK-293T 细胞培养
从液氮罐中取出HEK-293T 细胞,在37 ℃水浴锅中轻轻晃动至细胞融化,将细胞液转移至5 ml DMEM 高糖培养基中,室温下1 000 rpm 离心5 min。离心后,弃去上清,用5 ml 含10%胎牛血清和1%青霉素链霉素混合液的DMEM 高糖培养基吹悬细胞团,置于T25 细胞培养瓶中,于5 % CO2的37 ℃恒温培养箱中培养。待细胞长至培养瓶底部80%~90%融合度,进行细胞计数、传代及冻存。
1.6 重组质粒转染HEK-293T 细胞
将HEK-293T 细胞以5×104cell·mL-1的密度铺板在24 孔培养板中,待细胞长至培养孔底部70%左右融合度时,用UltraFection 3.0 试剂转染。首先弃掉培养基,每孔加入500 μL 新鲜的DMEM 培养基饥饿处理细胞30 min,期间准备UltraFection 3.0/DNA复合物:将0.5 μg p3×Flag-CMV10-ns4b 和0.5 μg p3×Flag-CMV10 质粒分别加入至 25 μL 的无血清培养基中,漩涡震荡混匀;将1.5 μL UltraFection 3.0试剂加入至25 μL 无血清培养基中,旋涡震荡混匀;将后者加入前者中,漩涡震荡混匀10 s,室温下孵育10 min,最后将上述Ult-raFection 3.0/DNA 混合物加入每孔中,轻柔晃动使其分散均匀,37 ℃培养6 h 后更换新鲜的完全培养基,继续培养18 h。
1.7 Western blot 鉴定目的蛋白表达
制取蛋白样品:弃掉原有的完全培养基,用提前预冷的PBS 清洗细胞3 次,将细胞培养板置于冰上,向每孔中加入RIPA 裂解液50 μL 裂解细胞30 min。裂解完成后,4 ℃条件下12 000 g 离心10 min,收集上清裂解液,经BCA 试剂盒蛋白定量后,加入6×Loading Buffer,100 ℃沸水浴处理10 min,随后12 000 g离心5 min。蛋白采用5%浓缩胶和10%分离胶进行SDS-PAGE 电泳,结束后将凝胶湿转NC 膜。转膜条件:电压100 V,时间42 min。将NC 膜放入3% BSA封闭液中室温下孵育2 h。洗膜之后,采用鼠源Flag抗体(1∶2 000)和鼠源β-actin 抗体(1∶2 000)分别4度过夜孵育,之后,用羊抗小鼠辣根过氧化物酶标记IgG(1∶3 000)抗体室温孵育2 h,每次孵育结束后用1×TBST 洗膜3 次,每次10 min,最后显影曝光,保存结果。
2 结果与分析
2.1 BVDV NS4B 的结构分析
2.1.1 BVDV ns4b 编码蛋白质的理化性质预测及分析
预测和分析BVDV ns4b 编码蛋白质的理化性质,结果显示,该蛋白质的原子数是5 458,分子式为C1748H2752N444O505S9;分子量为38.4 kDa;理论等电点为7.95;含有347 个氨基酸,带正电荷(Arg+Lys)的氨基酸残基总数为37,带负电荷(Asp+Glu)的氨基酸残基总数为36;脂肪指数为98.16;不稳定指数为31.51,属于稳定性蛋白。
2.1.2 蛋白信号肽预测
运用SignalP-4.1 程序预测BVDV ns4b 氨基酸序列,结果显示,NS4B 蛋白不存在信号肽,因此推测,该蛋白不属于分泌蛋白(图1)。

图1 BVDV NS4B 蛋白信号肽预测Fig.1 Signal peptide prediction of BVDV NS4B
2.1.3 BVDV NS4B 蛋白亲疏水性预测
运用ExPASY 工具里面的ProtScale 对BVDV ns4b的氨基酸序列进行亲疏水性分析,结果显示,BVDV NS4B 蛋白氨基酸序列最低分值是-2.767(位于第132 位氨基酸),亲水性最强,最高分值是2.422(位于第285 位氨基酸),疏水性最强。总体看来,该蛋白整条肽链大部分为疏水区域,表现为疏水性,因此,BVDV NS4B 蛋白是疏水性蛋白(图2)。

图2 BVDV NS4B 蛋白亲疏水性预测Fig.2 Hydrophobicity prediction of BVDV NS4B
2.1.4 BVDV NS4B 蛋白磷酸化位点预测
利用Netphos 3.1 Server 在线软件对该蛋白磷酸化位点进行预测分析,结果显示,BVDV NS4B 蛋白有49 个位点可能会被磷酸化(图3)。
2.1.5 BVDV NS4B 蛋白糖基化位点预测
利用NetNGlyc 1.0 对BVDV NS4B 蛋白糖基化位点预测分析,结果显示,NS4B 蛋白存在6 个N-糖基化位点,分别位于第57、120、155、158、255 和277位氨基酸处(图4)。

图4 BVDV NS4B 蛋白N-糖基化位点预测Fig.4 N-glycosylation site prediction of BVDV NS4B protein
2.1.6 BVDV NS4B 蛋白二级结构预测
运用SOPMA 在线程序对BVDV NS4B 蛋白的二级结构进行预测,结果显示,BVDV NS4B 的二级结构主要为α-螺旋(66.57%),其余还有无规则卷曲(17.29%)、延伸(10.66%)和β-转角(5.48%)(图5)。

图5 BVDV NS4B 蛋白二级结构预测Fig.5 Secondary structure prediction of BVDV NS4B
2.1.7 BVDV NS4B 蛋白三级结构预测
通过SWISS MODEL 程序对BVDV NS4B 蛋白三级结构进行预测,结果显示,NS4B 蛋白含有α-螺旋、β-转角和无规则卷曲等复杂的结构,与其二级结构预测结果一致(图6)。

图6 BVDV NS4B 蛋白三级结构预测Fig.6 Tertiary structure prediction of BVDV NS4B
2.2 目的基因扩增结果
利用特异性引物进行BVDV ns4b 基因扩增,经琼脂糖凝胶电泳检测PCR 产物,在1 000 bp 处左右出现明显条带,结果与预期基因片段大小相符,表明目的基因扩增正确(图7)。

图7 BVDV 的ns4b 基因PCR 扩增产物Fig.7 PCR products of ns4b gene of BVDV
2.3 表达载体构建及验证
2.3.1 PCR 方法鉴定
利用获得的重组质粒p3×Flag-CMV10-ns4b 为模板进行PCR 鉴定,结果显示在1 000 bp 左右有明显条带,扩增片段大小与预期相符,表明重组质粒p3×Flag-CMV10-ns4b 构建正确(图8)。
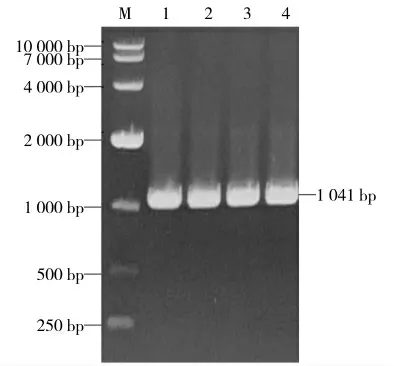
图8 重组质粒p3×Flag-CMV10-ns4b 的PCR 鉴定Fig.8 PCR identification of recombinant plasmid p3×Flag-CMV10-ns4b
2.3.2 酶切鉴定
用NotⅠ、XbaⅠ内切酶进一步验证PCR 方法鉴定正确的重组表达质粒p3×Flag-CMV10-ns4b,酶切产物经1% 琼脂糖凝胶电泳分析,结果如图3 所示,分别在6 400 bp 和1 000 bp 处左右出现了明显条带,大小与目的片段1 041 bp 相符,表明重组质粒p3×Flag-CMV10-ns4b 构建正确(图9)。
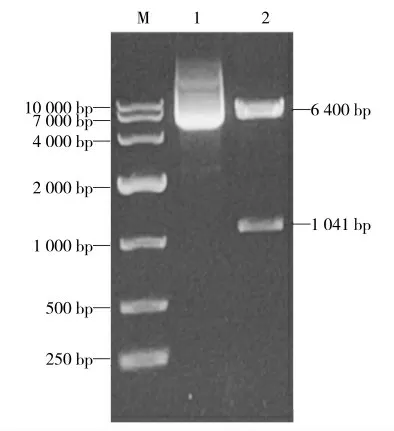
图9 重组质粒p3×Flag-CMV10-ns4b 酶切鉴定Fig.9 Digestion identification of recombinant plasmid p3×Flag-CMV10-ns4b
2.3.3 重组表达载体序列比对分析
将上述鉴定正确的p3×Flag-CMV10-ns4b 重组质粒邮寄库美生物公司进行测序,测序结果经NCBI Blast 比对分析,结果显示,测序结果与目的基因序列一致,与NCBI 上公布的BVDV NADL 株同源性为100%,表明重组表达载体p3×Flag-CMV10-ns4b 构建成功(图10)。

图10 p3×Flag-CMV10-ns4b 与BVDV NADL株ns4b 序列比对Fig.10 Sequence comparison between p3×Flag-CMV10-ns4b and ns4b of BVDV NADL strain
2.4 Western blot 检测目的蛋白表达
利用Western blot 方法,检测重组质粒p3×Flag-CMV10-ns4b 在HEK-293T 细胞中的表达情况,先后利用鼠源抗Flag 标签抗体与辣根过氧化物酶标记的羊抗小鼠IgG 孵育,检测NS4B 蛋白的表达,结果显示在38.4 kDa 处出现明显条带,与预期蛋白大小相符。表明重组质粒p3×Flag-CMV10-ns4b 在HEK-293T 细胞中成功表达(图11)。

图11 Western blot 鉴定目的蛋白表达Fig.11 Identification of target protein expression by western blot
3 讨论
1946 年,美国纽约州的Olafson 等[11]首次发现BVDV,随后在各个国家被陆续报道。1980 年,李佑民等[12]分离出1 株与国外报道相同的BVDV,这是我国首次报道该病毒,并命名为184V 株。此后,此病毒正式传入我国,在我国牛群中广泛流传。近年来,牛病毒性腹泻病/黏膜病(Bovine Viral Diarrhea-mucosal disease,BVD-MD)在北京、河北、江苏等20 多个省、市和自治区均有报道,并有多个省份血清阳性率有逐年上升的趋势[13]。
按照BVDV 分离培养过程中能否稳定繁殖并引起细胞病变,BVDV 可以分为致细胞病变型(CP)和非致细胞病变型(NCP)两种生物型[14]。依据BVDV 的全基因组5′端非翻译区核酸序列(5′-UTR)和抗原性的不同,国际病毒分类委员会将BVDV 分为2 种基因型,即BVDV-Ⅰ型和BVDV-Ⅱ型[15]。如今,我国牛群最主要感染的为BVDV-Ⅰ型,北美洲、西班牙主要流行BVDV-Ⅱ型[16]。BVDV 基因组含有一个大的开放阅读框(Open Reading Frame,ORF),该蛋白前体能够大概形成11 种成熟的蛋白质,它们在整个基因组上的排列为(从N 端到C 端)NH2-Npro-capsid-Erns-E1-E2-P7 -NS2 -NS3 -NS4A -NS4B -NS5A -NS5B-COOH,其 中,Npro、P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B 为非结构蛋白,其他为结构蛋白,参与BVDV 囊膜和外壳[17-18]的组成。随着对BVDV 基因组结构以及功能研究的不断深入,发现BVDV 的非结构蛋白参与病毒的形成,在诱导机体产生天然免疫方面发挥重要作用[19-24]。近几年,有研究表明BVDV 基因组编码的非结构蛋白NS4B 能够介导细胞膜重排的过程[25]。NS4B 蛋白在CP 型和NCP 型两种生物型病毒之间的定位没有差异,NS4B 蛋白对病毒的复制起着重要的作用,若BVDV NS4B 区域中第15 位密码子从酪氨酸突变为半氨酸,可使CP 型的BVDV 转化为NCP 型的BVDV,表明NS4B 蛋白参与BVDV逃逸宿主免疫,这表明此位氨基酸突变是研究BVDV疫苗的一个新作用靶点。因此,BVDV NS4B 重组质粒的构建对后续的功能研究具有重要的作用。
由于NS4B 蛋白在BVDV 形成和抗宿主免疫过程发挥重要作用,因此,采用Prot-Param、TExpasy、SignalP-4.1 等生物信息学软件对BVDV ns4b 的理化性质以及蛋白结构进行了预测和分析,结果表明BVDV NS4B 是含有347 个氨基酸的稳定性蛋白,不是分泌性蛋白;NS4B 蛋白有6 个N-糖基化位点,整条肽链大部分为疏水区域,表现为疏水性蛋白;NS4B蛋白是多磷酸化蛋白,具有49 个磷酸化位点,提示这些磷酸化位点可能参与BVDV 与宿主代谢的调控过程。另外,NS4B 蛋白结构较复杂,主要由α-螺旋、β-转角和无规则卷曲结构组成。上述这些分析结果为进一步研究BVDV NS4B 蛋白的特性与生物学功能提供了参考。此外,研究通过PCR 的方法获得BVDV ns4b 基因,将目的基因ns4b 插入到真核表达载体p3×Flag-CMV10 中,成功构建了重组表达载体p3×Flag-CMV10-ns4b,并将重组表达载体转染HEK-293T 细胞中,Western blot 结果表明,p3×Flag-CMV10-ns4b 能够在细胞中表达NS4B 蛋白,大小为38.4 kDa,与预期大小相符,表明p3×Flag-CMV10-ns4b 在HEK-293T 细胞中能够成功表达。为今后研究NS4B 蛋白在BVDV 形成和抗宿主免疫反应中的作用奠定了基础,同时对进一步预防BVDV 感染具有重要意义。

