lncRNA RMRP 通过JAK/STAT 信号通路在子宫内膜癌细胞增殖和凋亡中的作用研究
方秋满,邓青春,周小飞,黄从妹 (海南医学院第二附属医院妇科,海南 海口 570311)
子宫内膜癌是女性生殖系统最常见的恶性肿瘤,近年来发病率呈上升趋势。目前,由于治疗技术的不断进步,早期子宫内膜癌患者的预后良好。然而,许多子宫内膜癌患者在确诊时已是晚期,而现有的治疗措施对此类患者无效,导致5 年生存率较低[1]。因此,探索子宫内膜癌的分子发病机制并寻找更有效的治疗靶点,对改善子宫内膜癌的治疗效果具有重要意义。随着分子生物学和基因诊断技术的快速发展,越来越多的证据表明,长链非编码RNA(long noncoding RNA,lncRNA)与癌症的发生发展密切相关,可作为肿瘤的特异性生物标志物[2]。研究证实,lncRNA 在子宫内膜癌中存在差异表达,并参与子宫内膜癌发生发展的多种恶性过程[3-4]。近期有研究报道,线粒体处理RNA 的内切酶复合物RNA 组分(RNA component of mitochondrial RNA processing endoribonuclease,RMRP)参与调控乳腺癌、食管癌等多种恶性肿瘤的进展[5-6]。然而,lncRNA RMRP 在子宫内膜癌中的作用及机制尚不明确。有研究报道,在子宫内膜癌中,Janus 激酶/信号转导与转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路参与癌细胞的迁移、生长、凋亡及分化等进程[7]。因此,本研究分析lncRNA RMRP 在子宫内膜癌组织和细胞中的表达水平,探讨其是否通过调控JAK/STAT 信号通路参与子宫内膜癌的进展,并分析其相关分子机制,以期为子宫内膜癌诊断和治疗寻找新的生物标志物和潜在治疗靶点。
1 材料与方法
1.1 材料
正常子宫内膜细胞系HESC 细胞和子宫内膜癌细胞系HEC-1-A 细胞(中国科学院细胞研究所);TRIzol®试剂(美国Invitrogen 公司);PrimeScript®RT 试剂盒(日本Takara 公司);CCK-8 试剂盒(美国Sigma-Aldrich 公司);Annexin V-FITC/PI 细胞凋亡试剂盒(上海碧云天生物技术有限公司);双荧光素酶报告基因试剂盒(北京普洛麦格生物技术有限公司);兔抗人JAK2、p-JAK2、STAT3、p-STAT3 单克隆抗体以及山羊抗兔IgG(H+L)二抗(美国Abcam 公司);化学发光凝胶成像系统(美国Bio-Rad 公司);流式细胞仪(美国BD 公司);酶标仪(美国Molecular Devices 公司);引物设计和合成委托上海生工生物完成。
1.2 方法
1.2.1 临床组织样本收集 纳入2021 年7 月至2022年3月在我院经组织活检和组织病理学分析确诊为子宫内膜癌的30例患者,在其接受手术治疗时收集子宫内膜癌组织标本,并在距离癌组织5 cm 处收集癌旁组织标本。纳入标准:①符合《子宫内膜癌诊断与治疗指南(第四版)》中子宫内膜癌的相关诊断标准,经子宫内膜组织活检和组织病理学分析确诊;②初次确诊;③生存期超过3 个月,且临床资料完整。排除标准:①接受过抗癌治疗,包括免疫抑制剂和/或性激素等相关治疗;②合并其他恶性肿瘤;③合并子宫肌瘤、子宫腺肌症等子宫良性疾病;④合并重要脏器疾病;⑤合并糖尿病和/或其他感染性疾病。本研究方案已由我院伦理委员会批准(202106-03)。所有入选患者均签署手术知情同意书。
1.2.2 细胞培养和转染 将正常子宫内膜细胞系HESC 和子宫内膜癌细胞系HEC-1-A 分别培养于RPMI-1640 培养基(含10%胎牛血清、100 U/mL 青霉素和0.1 mg/mL 链霉素),置于恒温培养箱(37 ℃、5%CO2)中培养。将对数生长期的HEC-1-A 细胞(4×105个/孔)接种至24 孔板中,待细胞融合度达到80%时,根据Lipofectamine 2000 试剂说明书分别将空载体、pcDNA-RMRP、NC-siRNA、RMRP-siRNA、NC mimic、miR-580-3p mimic、pcDNA-RMRP+NC mimic、pcDNA-RMRP+miR-580-3p mimic、RMRP-siRNA+空载体、RMRP-siRNA+pcDNA-JAK2、NC inhibitor 和miR-580-3p inhibitor 转染至HEC-1-A 细胞中,分为空载体组、pcDNA-RMRP 组、NC-siRNA 组、RMRP-siRNA 组、NC mimic 组、miR-580-3p mimic 组、pcDNA-RMRP+NC mimic 组、pcDNA-RMRP+miR-580-3p mimic 组、RMRPsiRNA+空载体组、RMRP-siRNA+pcDNA-JAK2 组、NC inhibitor 组、miR-580-3p inhibitor 组,转染48 h 后收集细胞。
1.2.3 CCK-8 法检测细胞增殖率 将各组转染后的细胞以4×103个/孔的密度接种到96 孔板中,置于恒温培养箱(37 ℃、5%CO2)中培养。孵育0 h、24 h、48 h和72 h 后,分别加入10 μL CCK-8 溶液,然后放回恒温培养箱中继续孵育2 h。使用酶标仪测定450 nm 波长下的吸光度值。
1.2.4 流式细胞术检测细胞凋亡率 使用胰蛋白酶消化各组转染后的细胞,加入完全培养液重悬细胞,离心,弃上清。每个样本中加入Binding Buffer 重悬,然后加入5 μL Annexin V-FITC,在4 ˚C下避光染色15 min。然后加入5 μL PI,在4 ˚C 下孵育5 min。流式细胞仪上机检测,用FlowJo软件分析细胞凋亡率。
1.2.5 RT-qPCR 检测lncRNA RMRP、miR-580-3p 表达 使用TRIzol®试剂分离提取组织和细胞的RNA,然后在微量分光光度计NanoDrop 2000 上检测RNA 浓度以及OD260/OD280,如果OD260/OD280为1.8~2.0,可继续进行下一步实验。使用PrimeScript®RT 试剂盒将RNA 反转录为cDNA。随后使用SYBR Green 试剂盒在PCR 仪上进行PCR 扩增反应,反应条件为:95 °C 30 s,95 °C 5 s,60 °C 30 s,72 °C 30 s,共40个循环。采用2-ΔΔCt法计算基因表达水平。lncRNA RMRP 上游引物(5′-3′):GCTGAAGGCCTGTATCCTAG,下游引物(5′-3′):GCTCAGCGGGATACGCTTC;GAPDH 上游引物(5′-3′):ATTTTGGAGGGATCTCGCTC,下游引物(5′-3′):CAACGGATTTGGTCGTATTG;miR-580-3p 上游引物(5′-3′):AAAATTTCCAATTGGAACC,下游引物(5′-3′):AAGCAGGGTCCGAGGT;U6 上游引物(5′-3′):GCTTCGGCAGCACATATAC,下游引物(5′-3′):ATTTGCGTGTCATCCTTGC。
1.2.6 Western blot 检测JAK/STAT 信号通路蛋白表达 收集各组转染后的细胞,加入RIPA 裂解缓冲液提取总蛋白,在冰上操作。随后使用BCA 试剂盒检测蛋白样品浓度。制备SDS-PAGE 电泳分离胶及浓缩胶,将蛋白样品加入到凝胶孔中,进行恒压电泳,然后转移到PVDF 膜上。转膜结束后,将膜置于5%的脱脂牛奶封闭液中封闭1 h。然后加入一抗,在4 ℃冰箱过夜。PBST 洗膜3 次,每次5 min,加入二抗,室温孵育90 min。最后用ECL 化学发光液显影,用Image J 软件检测免疫印迹条带的灰度值,计算目标蛋白与内参蛋白条带灰度值的比值。抗体工作液稀释度如下:兔抗人一抗JAK2(1:2 000 稀释)、p-JAK2(1:1 500 稀释)、STAT3(1:2 000 稀释)、p-STAT3(1:1 500 稀释),山羊抗兔IgG(H+L)二抗(1:5 000稀释)。
1.2.7 生物信息学分析 使用TargetScanHuman v7.2 网页版(https://www. targetscan. org/vert_72/)对lncRNA RMRP 与miR-580-3p 的直接序列互作位点、miR-580-3p与JAK2 3′-UTR的直接序列互作位点进行分析和预测。
1.2.8 双荧光素酶报告基因实验 使用双荧光素酶报告基因实验分别验证 miR-580-3p 与lncRNA RMRP、JAK2 3′-UTR 之间的靶向序列直接互作关系。将RMRP、JAK2 野生型(WT)或突变型(MUT)3'-UTR序列分别插入pGL3 载体中,构建lncRNA RMRP-WT或lncRNA RMRP-MUT、JAK2-WT 或JAK2-MUT 报告基因载体。按照说明书的方法使用Lipofectamine 2000试剂将lncRNA RMRP-WT 或lncRNA RMRP-MUT、JAK2-WT 或JAK2-MUT 与NC mimic 或miR-580-3p mimic共转染至细胞中。48 h后收集细胞,使用双荧光素酶报告系统检测相对荧光素酶活性。
1.3 统计学方法
使用SPSS 20.0 软件进行统计学分析。所有数据以均数±标准差()表示,Studentt检验用于分析2组间的差异,单因素方差分析用于多组间比较,进一步两两比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 lncRNA RMRP 在子宫内膜癌组织和细胞中的表达
RT-qPCR 实验显示,与癌旁组织比较,lncRNA RMRP在子宫内膜癌组织中的表达显著升高(P<0.05),见图1a。与HESC细胞比较,lncRNA RMRP在HEC-1-A细胞中的表达显著升高(P<0.05),见图1b。以上研究结果提示,lncRNA RMRP 可能参与了子宫内膜癌的发生发展。
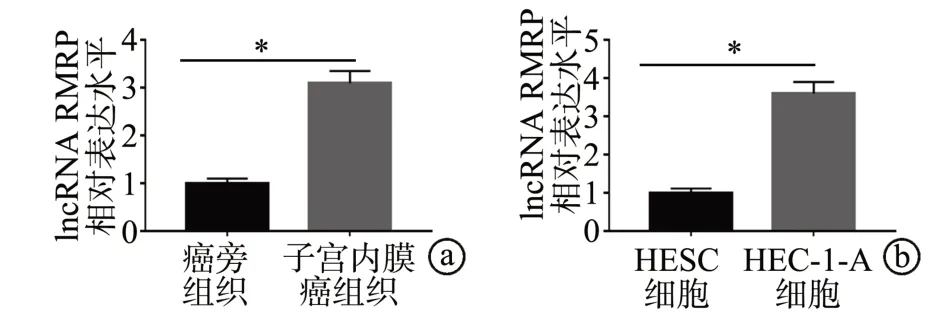
图1 lncRNA RMRP在子宫内膜癌组织和细胞中的表达
2.2 过表达或敲低lncRNA RMRP 对子宫内膜癌细胞增殖和凋亡的影响
与NC-siRNA 组比较,RMRP-siRNA 组细胞中lncRNA RMRP的表达显著降低(P<0.05);与空载体组比较,pcDNA-RMRP 组细胞中lncRNA RMRP 的表达显著升高(P<0.05),见图2a、b。CCK-8 和流式细胞术实验结果显示,与NC-siRNA 组比较,RMRP-siRNA 组细胞增殖率降低(P<0.05),细胞凋亡率升高(P<0.05);与空载体组比较,pcDNA-RMRP 组细胞增殖率升高(P<0.05),细胞凋亡率降低(P<0.05),见图2c~f。以上研究结果表明,过表达lncRNA RMRP 可显著促进子宫内膜癌细胞增殖,抑制细胞凋亡;敲低lncRNA RMRP可显著抑制细胞增殖,促进细胞凋亡。

图2 过表达或敲低lncRNA RMRP对子宫内膜癌细胞增殖和凋亡的影响
2.3 lncRNA RMRP靶向并调控miR-580-3p的表达
通过生物信息学软件发现,lncRNA RMRP 可能含有miR-580-3p 的潜在结合位点(图3a)。双荧光素酶报告基因实验结果显示,与NC mimic 组比较,miR-580-3p mimic 组lncRNA RMRP-WT 报告基因载体的荧光素酶活性显著降低(P<0.05),而lncRNA RMRP-MUT 报告基因载体的荧光素酶活性变化无统计学意义(P>0.05),见图3b。RT-qPCR 实验结果显示,与NC-siRNA 组相比,RMRP-siRNA 组miR-580-3p水平显著升高(P<0.05),见图3c;而与空载体组比较,pcDNA-RMRP 组miR-580-3p 水平显著降低(P<0.05),见图3d。以上研究结果表明,lncRNA RMRP 可靶向并负调控miR-580-3p的表达。
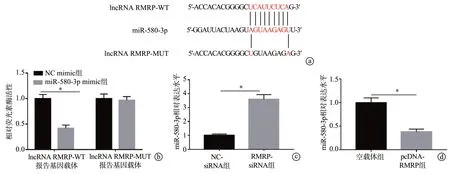
图3 lncRNA RMRP靶向并调控miR-580-3p的表达
2.4 miR-580-3p靶向并调控JAK2的表达
通过生物信息学软件预测发现,miR-580-3p 与下游靶基因JAK2 的3′-UTR 可能含有潜在的结合位点(图4a)。双荧光素酶报告基因实验结果显示,与NC mimic 组比较,miR-580-3p mimic 组JAK2-WT 报告基因载体的荧光素酶活性显著降低(P<0.05),而JAK2-MUT 报告基因载体的荧光素酶活性变化无统计学差异(P>0.05),见图4b。Western blot 实验结果显示,与NC mimic 组比较,miR-580-3p mimic 组细胞中JAK2 蛋白水平显著降低(P<0.05),见图4c;而与NC inhibitor组比较,miR-580-3p inhibitor 组细胞中JAK2 蛋白水平显著升高(P<0.05),见图4d。以上研究结果表明,miR-580-3p可靶向并负调控JAK2的表达。
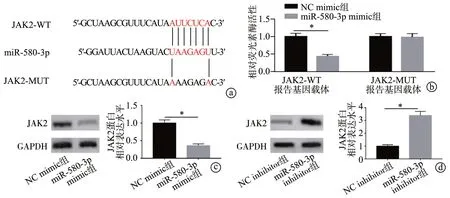
图4 miR-580-3p靶向并调控JAK2的表达
2.5 lncRNA RMRP 通过靶向miR-580-3p 调控JAK/STAT信号通路
Western blot 结果显示,与空载体组比较,pcDNARMRP 组细胞中JAK2、p-JAK2 和p-STAT3 蛋白水平显著升高,差异均有统计学意义(P<0.05),STAT3 蛋白表达水平变化则无统计学意义(P>0.05);与pcDNARMRP+NC mimic 组比较,pcDNA-RMRP+miR-580-3p mimic 组细胞中JAK2、p-JAK2、p-STAT3 蛋白水平显著降低,差异均有统计学意义(P<0.05),STAT3 蛋白表达水平变化则无统计学意义(P>0.05),见图5。以上研究结果表明,lncRNA RMRP 可能作为miR-580-3p的竞争性内源RNA(competitive endogenous RNA,ceRNA)激活JAK/STAT信号通路。
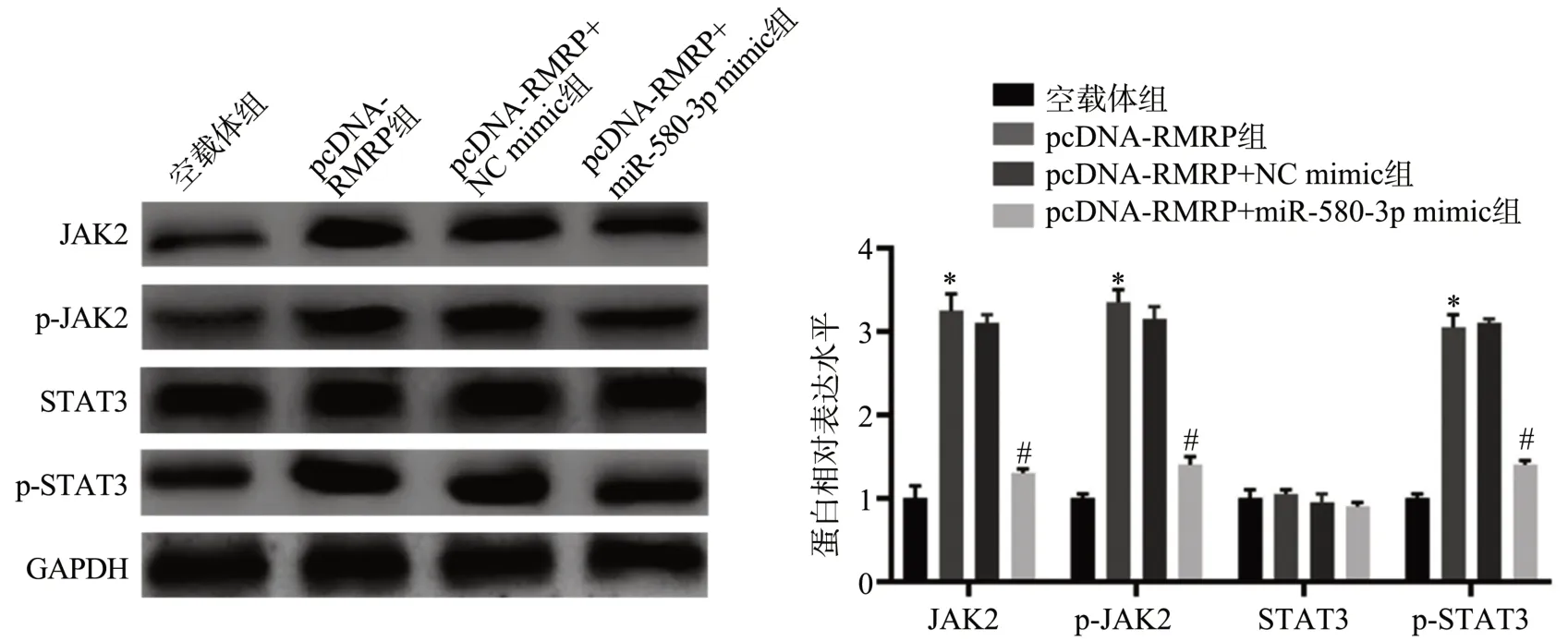
图5 lncRNA RMRP通过靶向miR-580-3p调控JAK/STAT信号通路
2.6 lncRNA RMRP 通过JAK/STAT 信号通路对子宫内膜癌细胞增殖和凋亡的影响
Western blot 结果显示,与NC-siRNA 组比较,RMRP-siRNA组细胞中JAK2、p-JAK2、p-STAT3蛋白水平显著降低(P<0.05),STAT3 蛋白表达水平变化无统计学意义(P>0.05);与RMRP-siRNA+空载体组比较,RMRP-siRNA+pcDNA-JAK2 组细胞中JAK2、p-JAK2、p-STAT3 蛋白水平显著升高(P<0.05),STAT3 蛋白表达水平变化无统计学意义(P>0.05);此外,与RMRPsiRNA+空载体组比较,RMRP-siRNA+pcDNA-JAK2 组细胞增殖率升高(P<0.05),细胞凋亡率降低(P<0.05),见图6。
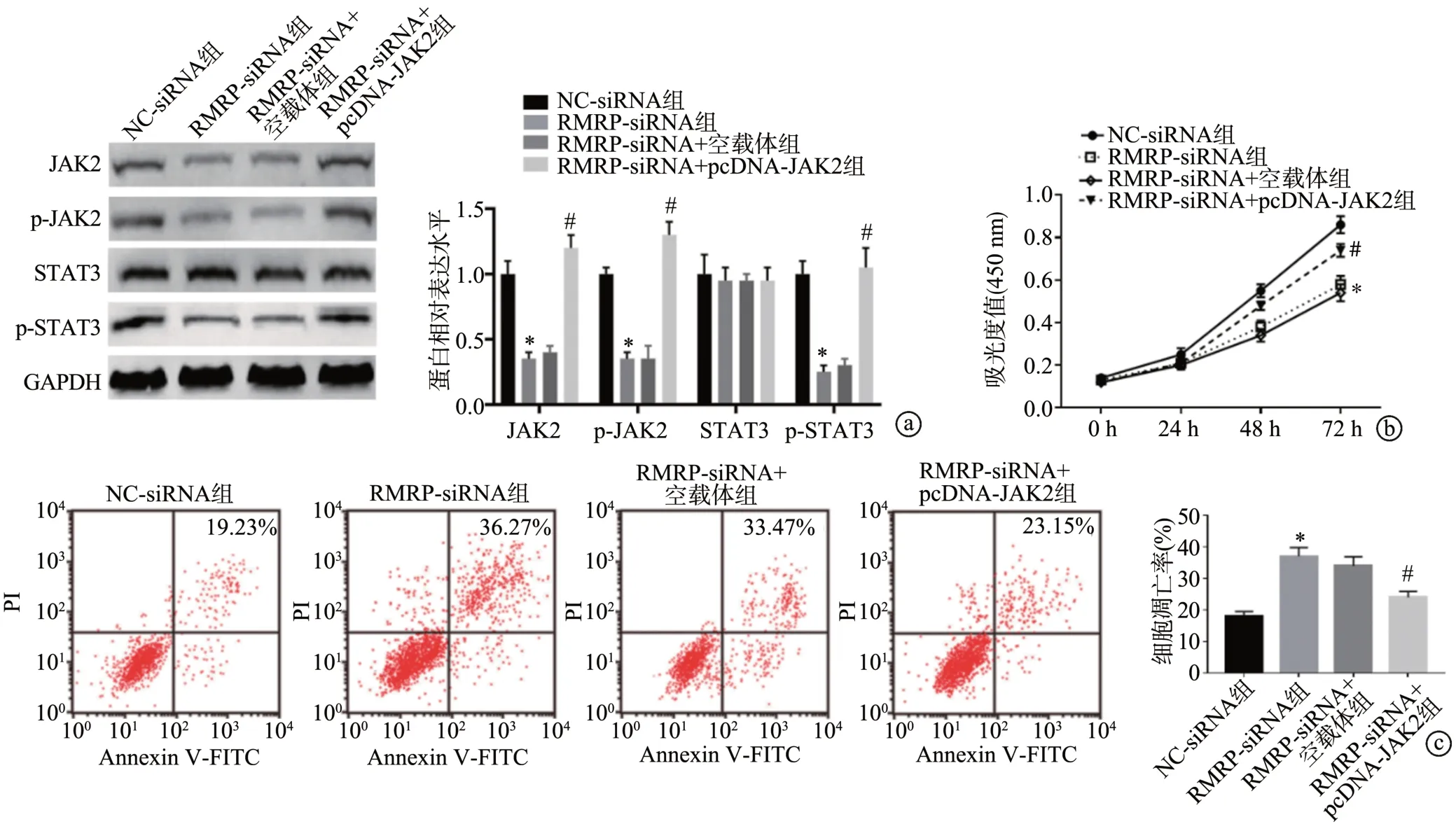
图6 lncRNA RMRP通过JAK/STAT信号通路对子宫内膜癌细胞增殖和凋亡的影响
3 讨论
近年来子宫内膜癌的发病率持续上升。研究表明,lncRNA 可作为潜在的肿瘤标志物和治疗的新靶点[8]。lncRNA是一类转录本长度超过200 nt的RNA分子,不编码蛋白质,而是以RNA 的形式在不同水平(表观遗传调控、转录调控、转录后调控等)调控基因表达。随着临床和细胞实验的深入研究,lncRNA 已被证明是一种具有多种生物学功能的非编码RNA,其在细胞增殖、分化、凋亡以及肿瘤的发生发展中起重要作用[9]。之前的研究已经揭示了lncRNA 在子宫内膜癌中的关键作用。例如,lncRNA TTN-AS1 通过靶向miR-376a-3p/PUM2 轴促进子宫内膜癌细胞增殖和转移[10]。lncRNA RHPN1-AS1 通过激活ERK/MAPK 通路促进子宫内膜癌进展[11]。RMRP 位于人染色体9p13.3上,由10 个不同的亚基和1 个RNA 分子组成,共有277 个nts,其广泛参与调控肿瘤的发生发展。lncRNA RMRP 通过靶向miR-206 促进膀胱癌细胞侵袭、迁移和增殖[12]。lncRNA RMRP 通过miR-613/NFAT5 轴促进非小细胞肺癌细胞的侵袭、迁移和增殖[13]。然而,lncRNA RMRP 是否在子宫内膜癌中发挥作用尚不清楚。本研究发现,lncRNA RMRP 在子宫内膜癌组织和细胞中的表达均显著升高;进一步功能实验显示,过表达lncRNA RMRP 可显著促进子宫内膜癌细胞增殖,抑制细胞凋亡;反之,敲低lncRNA RMRP 可显著抑制子宫内膜癌细胞增殖,促进细胞凋亡。以上研究结果提示,lncRNA RMRP 与子宫内膜癌的进展密切相关,可能成为诊断和治疗子宫内膜癌的潜在靶点。
ceRNA 假说揭示了一种全新的基因表达调控模式,lncRNA 可作为ceRNA 与miRNA 相互作用参与下游靶基因的调控,通过ceRNA 假说可以更好地理解基因调控网络在肿瘤发生发展中的作用。例如,lncRNA SNHG16 可作为ceRNA 调控miR-520/VEGF 轴促进肺癌细胞的迁移[14]。基于这一理论,越来越多的研究表明,lncRNA RMRP 可以通过海绵化miRNA 来影响肿瘤的发生和进展,如miR-206、miR-1-3p、miR-613 等已被鉴定为各种类型癌症中lncRNA RMRP 的作用靶点[15-17]。研究报道,lncRNA RMRP通过调控miR-580-3p/MICU1信号通路提高卵巢癌对紫杉醇的敏感性[18]。然而,lncRNA RMRP 是否海绵化miR-580-3p在子宫内膜癌中发挥作用尚不清楚。本研究通过双荧光素酶报告基因实验证实了lncRNA RMRP 与miR-580-3p 靶向结合;进一步实验表明了miR-580-3p 的表达与lncRNA RMRP 的表达呈负相关。以上研究结果表明lncRNA RMRP可靶向并负调控miR-580-3p的表达。
JAK/STAT信号通路是经典的致癌信号通路,可诱导癌细胞迁移、生长和分化[19]。各种配体(如细胞因子)与细胞表面受体的结合引起受体分子二聚化,从而使得与受体偶联的JAK 相互接近,然后通过酪氨酸残基上的相互磷酸化激活JAK,活化的JAKs 磷酸化STATs 的酪氨酸残基并导致STATs 活化,参与肿瘤进展的调控[20]。研究表明,JAK/STAT 信号通路,尤其是JAK2 和STAT3,可通过提高c-myc 水平刺激细胞增殖[21]。JAK2/STAT3 信号通路作为经典的致癌信号通路,在调控子宫内膜癌进展中发挥着重要作用[22]。本研究双荧光素酶报告基因实验结果显示,JAK2 为miR-580-3p的潜在靶点;进一步研究发现,miR-580-3p可负向调控JAK2 的蛋白表达。本研究还揭示了lncRNA RMRP 对JAK/STAT 信号通路的调控作用,lncRNA RMRP 过表达后JAK2、p-JAK2 和p-STAT3 蛋白水平显著升高,而miR-580-3p mimic 处理细胞后可逆转lncRNA RMRP 对JAK/STAT 信号通路的调控作用;功能实验进一步表明,lncRNA RMRP 敲低显著抑制细胞增殖,促进细胞凋亡,而JAK2 过表达显著逆转了这一结果。虽然大量lncRNAs被认为是子宫内膜癌的诊断和预后标志物以及治疗靶点,但由于子宫内膜癌发病机制复杂,更多参与子宫内膜癌的分子机制还有待进一步探索。
综上所述,本研究表明敲低lncRNA RMRP 通过靶向miR-580-3p 和调控JAK/STAT 信号通路抑制子宫内膜癌细胞的增殖,促进细胞凋亡。这一研究结果阐明了lncRNA RMRP/miR-580-3p/JAK/STAT 轴与子宫内膜癌进展的关系,提示了lncRNA RMRP 在子宫内膜癌治疗中的潜在价值,为子宫内膜癌的治疗提供了新的治疗靶点和新思路。

