关键安全视野在腹腔镜胆囊切除术中的应用体会
李冬冬,江涛
南京中医药大学泰州附属医院 肝胆外科,江苏 泰州 225300
目前,腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)已成为治疗胆石症的金标准。LC造成的胆管损伤(bile duct injuries,BDI)发生率却依然高于开腹胆囊切除术[1]。Meta分析和前瞻性研究数据显示,严重的胆管损伤发生率在0.08%~0.5%,如果考虑到胆管轻度损伤,胆管损伤的总体发生率在0.3%~1.5%[2]。目前在国际上关于安全LC的指南都建议在胆囊管离断之前获得关键安全视野(critical view of safety,CVS)。国内关于CVS的系统性研究不多,医师对CVS的临床应用还不太熟悉[3]。本研究通过对本单位采用CVS行LC术的临床病例进行回顾性分析,探讨CVS在LC中的实际应用价值。
1 临床资料
1.1 一般资料
回顾性分析2021 年1 月至2022年6 月期间在南京中医药大学泰州附属医院肝胆外科行LC术的133例患者完整临床资料。其中男53例,女80例;年龄19~85岁,平均(50.9±14.8)岁。133例中,慢性结石性胆囊炎64 例,急性结石性胆囊炎69 例(单纯性胆囊炎32例,化脓性胆囊炎23例,坏疽性胆囊炎14例)。术前均通过腹部B超、CT、MRI等确诊为胆囊结石伴胆囊炎。部分患者合并有高血压病、糖尿病、心脏病等慢性病。
病例纳入标准:(1)病例资料完整;(2)术前通过腹部B超、CT、MRI等均确诊为胆囊结石伴胆囊炎;(3)术前肝肾功能指标无异常;(4)经麻醉师评估可以耐受LC术;(5)均由同一组医师完成LC术。排除标准:(1)肝硬化,慢性肝炎致肝功能异常,肾功能失代偿;(2)凝血功能异常;(3)上腹部手术史;(4)胆总管结石,肝内胆管结石;(5)术中发现其他病变如胆囊肠道瘘,需要进一步处理;(6)中转开腹。
1.2 手术方法
气管插管全麻成功后,平卧位下常规消毒、铺巾;建立手术通道:分别于脐上或下、剑突下、右锁骨中线与肋骨下缘稍外下侧分别置入10 mm、10 mm、5 mm Trocar。探查腹腔,确定胆囊可以切除,将体位调至头高足低位30°、右侧抬高15°。分离胆囊与周围粘连;主刀牵引胆囊壶腹部以显露胆囊后三角,依胆囊底部、胆囊壶腹、肝门横沟、Rouviere沟、肝Ⅳ段等结构确认胆囊三角所在位置(图1、2)。可联合使用吸引器、分离钳与电切打开胆囊颈处的组织,从前、后视野来回解剖胆囊三角。解剖区域在Rouviere沟和肝Ⅳ段根部上方,紧贴胆囊表面,术中的任何步骤均应在连接这两个标志的连线上方进行。沿胆囊管钝性分离胆囊三角内疏松结缔组织,胆囊下1/3必须与胆囊床分离,彻底清除胆囊三角的脂肪及淋巴组织,有且仅有胆囊动脉和胆囊管通过。离断胆囊动脉及胆囊管前,术中暂停5~10 s,至少从前后两个视角(图3、4),由术者与助手双方确定后,予以可吸收夹夹闭离断。如胆囊肿胀,可行穿刺减压,穿刺减压点可选择靠近胆囊底部,以免胆汁流出影响视野。使用电钩能量时间一般为2~3 s,以防止造成周围区域组织的热损伤。如果出现持续性的出血,则使用纱布压迫止血,寻找出血点,尽量避免首先使用电凝或可吸收夹止血。如果Calot三角解剖严重受损,无法达到CVS标准,考虑采取胆囊大部切除、胆囊次全切除或中转开腹手术。如遇到胆囊及胆囊结石较大取出困难,调整胆囊方向使其长轴与切口垂直,吸净胆汁,夹碎结石,必要时分批取出。取出胆囊的切口常规使用碘伏清洗。
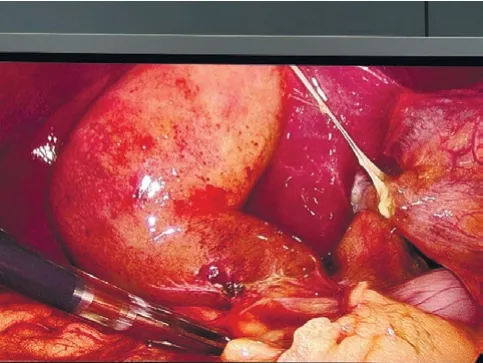
图1 暴露胆囊,寻找胆囊解剖标志,确认胆囊三角所在位置

图2 Rouviere沟
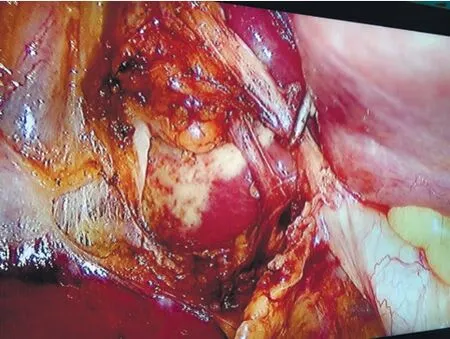
图3 胆囊前三角CVS视图
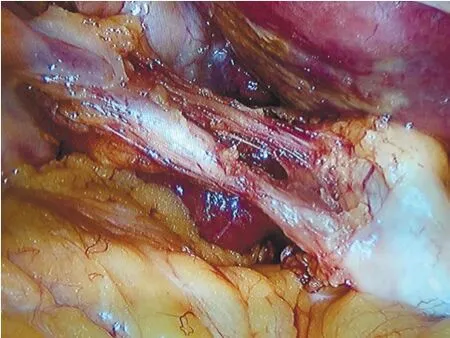
图4 胆囊后三角CVS视图
1.3 结果
所有患者均顺利完成LC术,无中转开腹,无术中BDI发生。术中出血量5~400 mL,手术时间25~175 min,术后住院4~7 d。无胆漏、内出血等术后近期并发症。随访6~12个月,无远期严重并发症。
2 讨论
BDI最常见的原因是手术过程中未能正确识别胆管。CVS作为一种结构识别技术,通过解剖结构进行360°的观察,避免术中肝动脉及门静脉出血、胆管损伤、残余结石等的发生。深入理解CVS的概念及预防胆管副损伤的机制,对减少BDI发生率、减轻胆管损伤严重程度非常有意义。
2.1 LC中CVS的再认识
1995年Strasberg等[4]提出在LC术中采用CVS确认胆囊管及胆囊动脉以预防BDI,并在之后逐渐完善CVS原理。CVS有三个标准:(1)清除胆囊三角内的淋巴和脂肪组织;(2)有且仅有两个管状结构通过胆囊三角,即胆囊管和胆囊动脉;(3)胆囊下部(约1/3)与胆囊床分离。美国胃肠与内镜外科医师协会(SAGES)推荐,行LC时应实现CVS。Meta分析显示,应用壶腹部技术的BDI发生率(1.5/1 000)高于应用CVS的BDI发生率(2/100万),虽然样本存在高度偏倚,但却没有I级临床数据表明应用CVS会带来负面效应[5]。CVS预防BDI没有直接证据,只有间接证据:(1)BDI通常发生在不能实现CVS的病例;(2)在实现CVS的病例中BDI明显低于预期;(3)没有大量研究证据表明CVS会导致严重的不良后果[6]。
虽然常规应用CVS不能完全消除BDI,但可以减少BDI,尤其是严重BDI的发生[7]。笔者临床实践认为,离断胆囊三角管状结构前实行术中暂停,拍摄CVS照片或视频,可以加深对CVS的理解,有助于避免严重的BDI发生。LC术中暂停5 s确定CVS,手术成功率从15.9%提高到44.1%[8]。CVS作为一个手术流程框架,有助于外科医师在进行每个手术步骤之前重新评估。
2.2 LC中重要的解剖标志——Rouviere沟
LC的视野由传统三维立体转变为二维平面,触觉反馈缺失,空间方向迷失,更易产生视觉误判。Rouviere沟是肝右叶唯一固定的解剖标志。胆总管通常位于沟的下方,胆囊管和胆囊动脉位于Rouviere沟的上方。笔者认为,离断胆囊动脉、胆囊管前确认与Rouviere沟的位置关系至关重要。从Rouviere沟的腹侧解剖可以清晰辨别胆囊颈和胆囊管,定位胆总管起始部,避免解剖位置过低。CVS技术、将Rouviere沟作为手术解剖标志,两者结合可有效避免BDI[9]。针对LC,特别是困难的LC,《东京指南(2018)》[10]建议,从后三角、Rouviere沟顶部和肝Ⅳ段底部连线为界的上方找到胆囊颈部,沿胆囊面解剖,标志点为肝脏第4段底部和Rouviere沟顶部。该解剖标志大致勾勒出胆管的位置,代表安全解剖的下边界。此线将胆囊三角分为线上安全区和线下危险区,在危险区域解剖容易把胆总管当成胆囊管,离断损伤胆总管。
2.3 LC术中CVS操作技巧
LC有时会因右肝动脉分支损伤影响手术视野而不能达到CVS。正确地解剖平面和入路,能够减少出血,保证术野清晰。笔者建议优先采用无重要的血管及胆管的“胆囊后三角入路”,对于慢性胆囊炎或轻中度胆囊炎患者,显露胆囊,牵拉胆囊壶腹部,保持有效牵引,寻找导航标志,明确结构的位置关系。分离后三角时,首先使用电钩解剖脏层腹膜,若局部水肿粘连严重,使用吸引器推挤分离,分离钳利用解剖间隙进行扩大分离。切忌左手使用抓钳时力的作用只是单纯牵拉胆囊,应当调整左手持抓钳的姿势,保证对胆囊的牵拉和对肝脏的托举作用,有助于手术部位的显露。针对术中管道样结构再三观察不能确认性质,可采用钛夹等标记,暂不离断。术中持续性出血不可盲目夹闭,优先使用纱布压迫、0.9% NaCl溶液冲洗,寻找出血点进行电凝或使用可吸收夹夹闭出血点。由于CVS需要较多的解剖,电钩在解剖结构不清楚或出现密集纤维化(例如感染胆囊或Mirizzi综合征)时使用要慎重。电钩用力过度导致“跳钩”或方向使用错误,会出现严重的胆管、血管、肠管等意外损伤。
2.4 困难性LC的手术策略
本研究中,急性化脓性胆囊炎、坏疽性胆囊炎患者的胆囊及周围组织水肿粘连,与大网膜、横结肠粘连,其中1例出血量最多,达400 mL。1例患者胆囊萎缩(体积约3.0 cm×1.8 cm×1.0 cm),致胆囊三角呈冰冻状,空间结构变异。困难性LC的手术实践、术中出血量、BDI及术后并发症发生率都高于解剖清晰的胆囊三角。因此困难性LC术中靠近危险区域而CVS无法安全建立时,宜采用替代手术方案[11]。目前没有证据支持中转开腹能避免或降低BDI的发生率[12]。而且,由于局部解剖结构不清晰,术中容易导致严重的肝动脉、门静脉及胆管的损伤。在无法获得CVS时,逆行胆囊切除的方式行腹腔镜胆囊全切术或次全切除术是重要纾困手段,而不是盲目中转开腹。Cengiz等[13]认为,复杂胆囊采用胆囊底部优先切除的方式可使BDI发生率由传统方法的0.9%降至0.07%。胆囊逆行切除的方式减少了对危险区域的解剖,虽然不能完全避免胆管或血管损伤,但能减少中转开腹或医源性BDI的发生。胆囊大部切除术不进入胆囊三角,可有效避免医源性BDI。胆囊次全切除术与胆囊全切除术在住院时间、再入院率和死亡率方面没有差异,但前者的总直接费用更高[14]。在以下情况下应进行中转开腹手术:Calot三角解剖困难,术中难以控制的出血,手术没有进展(高危患者>30 min,低危患者>60 min),或发生BDI。另外,吲哚菁绿显像技术能够实现胆管树的可视化,降低BDI的发生率[15]。
综上所述,充分利用解剖标志,掌握外科解剖平面,应用CVS进行LC是十分有价值的,能有效避免胆总管及其他胆管的损伤。由于本研究病例选择标准不够严谨,患者年龄跨度大、胆囊病变轻重不一,且术者经验有限,CVS的临床价值尚需更严谨的实验设计以提供循证医学证据。

