PD-L1高表达的SMARCA4缺失型未分化肿瘤的临床研究
解淑萍,汪 超,常 金,邓子林
1.山东第一医科大学(山东省医学科学院)研究生部,山东济南 250000;2.山东第一医科大学第二附属医院肿瘤科,山东泰安 271000
SMARCA4缺失型未分化肿瘤(SMARCA4-UT)是一类罕见的恶性肿瘤,LE LOARER等[1]发现这类肿瘤不仅与BAF表达缺陷型肉瘤临床和形态学特征方面密切相关,而且在转录上也高度相似,第一次将其命名为SMARCA4缺陷胸部肉瘤(SMARCA4-DTS)。2021年世界卫生组织肺部肿瘤分类第5版将其重新命名为SMARCA4缺失型未分化肿瘤(SMARCA4-UT),并将其归为“其他肺上皮肿瘤”[2]。因其特殊的病理类型,侵袭性较高、进展较快,初诊时中晚期及转移患者占较大比例。本文报道山东第一医科大学第二附属医院收治的1例SMARCA4-UT并程序性死亡受体-配体1(PD-L1)高表达患者,结合国内外文献对其病理类型、诊断、治疗及预后进行分析,以期为临床诊疗提供参考依据。
1 临床资料
患者,男,56岁,因“咳嗽、咳痰3月余,腰疼2月”于2023年4月就诊于山东第一医科大学第二附属医院肿瘤科。患者既往体健,吸烟30余年,10支/天,无饮酒史。
入院后,胸部+全腹部CT强化检查显示:(1)右肺上叶占位并右肺门、纵隔内淋巴结肿大,考虑恶性肿瘤。(2)双肺多发结节,考虑转移;右肺充盈缺损,癌栓?(3)肝内低密度灶,囊肿?转移?(4)左肾上腺区低密度灶,考虑转移可能。(5)L2棘突及左侧椎弓根骨质破坏,考虑转移。穿刺活检病理检查结果显示:SMARCA-UT(图1)。免疫组化:Ki-67(约70%)、Desmin(-)、STAT6(灶浆+)、SMA(-)、S-100(-)、SMARCA4(-)、P40(-)、NKX3.1(-)、Vimentin(+)、Villin(-)、NapsinA(-)、TTF-1(-)、CK20(-)、CK7(-)、CKpan(+)。GPC-3(-)、Hep-1(-)、GATA3(-)、D2-40(+)、CR(-)、PAX-8(-)、Syn(-)、INI-1(+)、MUC-5AC(-)。外周血基因检测结果显示:未检测到EGFR、KRAS、BRAF、HER2、MET等基因热点突变,也未检测到ALK、RET、ROS1和NTRK1基因融合。PD-L1表达检测:约90%肿瘤细胞阳性。PD-L1-NC:阴性对照良好。 PD-L1阳性对照:阳性对照良好。
结合病理及影像学该患者诊断为右肺上叶SMARCA4-UT并多发转移。
基于患者PD-L1高表达,于2023年4月开始予以腰椎姑息放疗、替雷利珠单抗200 mg联合白蛋白结合型紫杉醇300 mg+卡铂400 mg全身抗肿瘤治疗3个周期,后因经济原因未再入院治疗。
患者初诊时影像学上软组织肿块影最大横截面积为8.9 cm×7.9 cm(图2),治疗1周后肿块缩小为8.1 cm×7.3 cm。免疫联合化疗2个周期后肿块缩小为7.6 cm×6.9 cm(图3),根据RECIST1.1疗效评价为部分缓解。
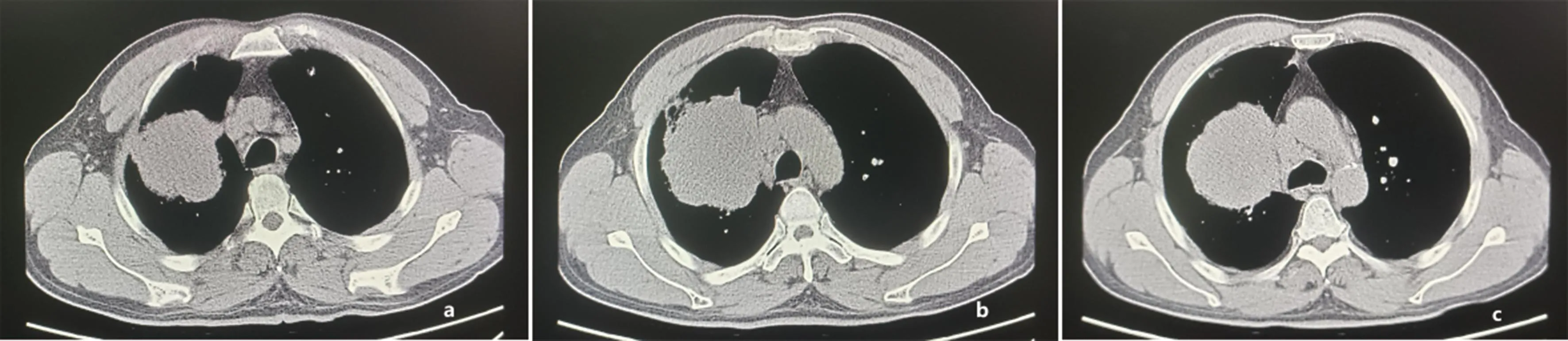
注:a、b、c分别表示患者初诊时主动脉弓及上、下层面胸部CT影像,显示右肺上叶巨大占位(最大横截面积约8.9 cm×7.9 cm)并右肺门、纵隔内淋巴结肿大。
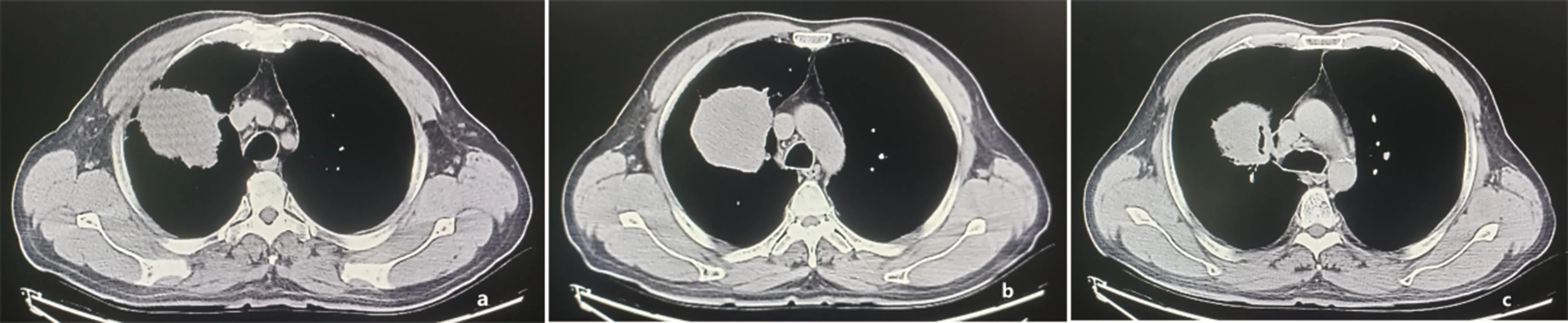
注:a、b、c分别表示患者免疫联合化疗2周期后主动脉弓及上、下层面胸部CT影像,显示右肺上叶占位(最大横截面积约7.6 cm×6.9 cm)明显缩小。
2 文献复习
2.1SMARCA4-UT的发现及命名 SMARCA4基因位于19p13染色体,属于SWI/SNF的核心催化亚基之一,编码BRG1蛋白[3],SWI/SNF是调节基因表达的主要条件因子,同时参与DNA损伤修复[4-5]。SMARCA4基因的缺失已被证实存在于多种恶性肿瘤中,如鼻窦恶性肿瘤、消化道恶性肿瘤和子宫、卵巢恶性肿瘤等[3,6-9]。
2015年LE LOARER等[1]报道,通过RNA测序筛选出19例SMARCA4基因缺失的病例,发现所有病例的病灶都位于胸部,表现出相似的临床和病理特征,但转录组学数据表明,这类肿瘤中肺癌基因改变均为阴性。尽管也有一些关于SMARCA4基因缺失的非小细胞肺癌(SMARCA4-dNSCLC)病例报道[10-13],并且有研究表明两者在基因组图谱中有很大一部分重叠[14],但其临床表现及组织学分化存在差异,2021年《世界卫生组织肺部肿瘤组织学分类(第5版)》对其重新命名,并将其归为“其他肺上皮肿瘤”[2]。
2.2SMARCA4-UT的临床影像及病理诊断 关于临床诊断,首先SMARCA4-UT好发于中年男性,患者初诊时常有胸闷、呼吸困难、咳嗽、咳痰、咯血等症状,并且与吸烟密切相关[15-16]。影像学上,肿瘤负荷主要集中在纵隔、胸膜和肺,表现出浸润和压迫性扩展[17],常伴有肿大和坏死的淋巴结。除了淋巴结转移外,SMARCA4-UT还较早发生肺、肝脏、肾上腺、骨的远处转移,也有其发生大脑和小肠转移的相关报道[18-19],因此患者初诊时全面的影像学检查有助于SMARCA4-UT的诊断。
在病理方面,SMARCA4-UT是一种未分化肿瘤,表现为局灶性去分化和横纹肌样形态[20],细胞坏死明显,呈圆形或卵圆形,胞质嗜酸,核偏位;部分呈上皮样细胞形态,体积大,胞质透明或淡粉色,泡状核,核仁明显[13,16,21-23]。免疫组织化学上,SMARCA4-UT通常表现为SMARCA4(-)、INI-1(+),BRG1、BRM表达缺失,但也有25%的病例呈BRG1表达弱阳性[16]。BRG1表达缺失可用于鉴别胸腺癌、恶性间皮瘤、恶性黑色素瘤等[2-3,12-16]。大多数SMARCA4-UT Ki-67指数较高,P53过量表达,SOX2、CD34、SALL4通常表达,P40、TTF-1、NUT、Claudin-4不表达。另外SMARCA4-UT基因检测常表现为SMARCA4基因缺失,并伴有TP53、KRAS、STK11、KEAP1共突变[24],与本例患者相似,大多缺乏EGFR、ALK、RET、ROS1基因突变。
2.3SMARCA4-UT的鉴别诊断 在鉴别诊断方面,其难点在于与SMARCA4-dNSCLC的鉴别。SMARCA4-UT较容易与一些分化较好的SMARCA4缺失的腺癌和鳞状细胞癌鉴别。尽管LE LOARER等[1]提出SOX2染色可以作为替代标记物,将SMARCA4 DTS与活检标本上SMARCA4缺失的肺癌进行区分,但很难与局部分化表现为横纹肌或肉瘤样形态,并且SALL4、SOX2局灶性和斑片状阳性的SMARCA4-dNSCLC亚群[25-26]进行鉴别。因此NAMBIRAJAN等[27]提出可以从患者发病年龄、影像学表现及临床症状进行鉴别诊断。
2.4SMARCA4-UT的治疗 目前并没有明确的关于SMARCA4-UT的治疗指南,对于分期较早的患者,手术治疗是首选,但仍表现为较早的复发及预后不良[14];对于晚期患者,复习既往文献发现目前仍是以基于铂类的化疗为主,但其对化疗的敏感性存在差异[5,16-17]。另外,SWI/SNF具有拮抗PRC2调节的能力,基于SMARCA4和SMARCA2等的功能丧失可能导致异常EZH2激活这一特征,SMARCA4-UT靶向治疗成为一种可能。并且EZH2抑制剂,如Tazemetostat,已被批准用于治疗上皮样肉瘤[28-29]。另外,由于SMARCA4的缺失,使肿瘤细胞对共济失调-毛细血管扩张突变和Rad3相关(ATR)抑制剂敏感,并且ATR抑制下调PD-L1[30],因此SMARCA4缺失可能是本身就是选择PD-1/PD-L1抑制剂而获益的标志。
3 讨 论
3.1困难和挑战 随着医疗技术的进步,对SMARCA4-UT的诊断已不是难点。但由于SMARCA4-UT在临床上并不常见,因此更需要多学科的诊疗思路。目前SMARCA4-UT的困难在于治疗,随着免疫治疗时代的到来,SMARCA4-UT的免疫治疗既是挑战也是机遇。
免疫检查点抑制剂的应用可能使SMARCA4-UT患者获益,KUNIMASA等[31]报道了1例晚期的SMARCA4-UT予以阿替利珠单抗联合贝伐珠单抗、紫杉醇和卡铂治疗后转手术治疗的患者,该患者术后9个月未复发。熊焰等[32]也报道了1例SMARCA4-UT患者,经新辅助化疗联合免疫治疗获得了病理完全缓解。
是否所有SMARCA4-UT患者都能从免疫检查点抑制剂中获益,答案是否定的。SHINNO等[33]在一项免疫检查点抑制剂对SMARCA4缺陷型胸部肿瘤的疗效研究中,共纳入12例接受免疫检查点抑制剂的患者,仅有5例患者获得了持久反应。PD-L1表达水平能否作为选择免疫治疗的标志物,答案也是存疑的。SHINNO等[33]研究中的5例获益患者PD-L1 TPS评分分别为100%、80%、5%(n=2)和小于1%。同样的NAMBIRAJAN等[34]研究发现,PD-L1的肿瘤比例评分为100%的患者,在应用帕博利珠单抗和伊匹木单抗治疗后存活时间超过22个月,正如SHINNO等[33]研究中提到的,尽管从现有的病例中很难得出PD-L1表达水平可以作为选择免疫检查点抑制剂的标志物,但PD-L1 TPS≥50%的患者客观缓解率要高得多。
3.2未来与展望 现代肿瘤的治疗已经迈向精准时代,各种治疗手段也在不断开发。笔者期待有更多的免疫标志物被发现,能够准确地识别并给予更加精准的治疗,以改善患者生存质量、延长患者生存期。同时笔者也期待有更多大样本的研究来佐证本研究的结论。
综上所述,SMARCA4-UT是一类罕见的恶性肿瘤,大部分患者为中年男性,并与吸烟密切相关。相较于普通肺癌及其他肉瘤样癌,其侵袭性高、进展快、预后较差。早期患者手术治疗仍是首选,基于其特殊的基因表达,对于中晚期患者,PD-1/PD-L1抑制剂联合含铂化疗药可能有较好的治疗前景。