胃癌组织中CPT1C、SERPINH1表达与卵巢转移的关系研究
周 祥,禹 红△,张 婧,邓 敏
湖北省武汉市中医医院:1.检验科;2.内分泌科,湖北武汉 438300
卵巢转移是胃癌预后不良的主要原因,多由腹膜植入转移引起,大多数胃癌卵巢转移患者病理分化差,TN分期较晚,根治性手术机会受限,与其他消化道来源的卵巢转移性肿瘤相比预后较差[1]。目前胃癌卵巢转移瘤缺乏明确有效的治疗手段,探寻相关生物学标志物,有助于早发现、早诊断和早治疗,以改善患者预后。肉碱棕榈酰转移酶1C(CPT1C)是脂肪酸转运到线粒体进行β氧化的介质,在线粒体能量代谢和癌细胞增殖调节中具有重要作用[2]。研究显示CPT1C在转移性结直肠癌[3]、原发性肝癌[4]中表达上调,与癌细胞增殖、迁移、侵袭和转移能力增强有关[4]。Serpin肽酶抑制剂clade H成员1(SERPINH1)是编码丝氨酸蛋白酶抑制剂H亚家族的成员,调节和维持细胞蛋白酶稳态,与肿瘤的发生、发展密切相关[5]。研究显示SERPINH1可通过调节细胞外基质(ECM)蛋白的表达促进癌细胞的侵袭和转移[6]。CPT1C、SERPINH1与胃癌卵巢转移是否有关尚不清楚,本研究拟检测胃癌组织中CPT1C、SERPINH1表达,分析其与胃癌卵巢转移的关系,旨在为临床胃癌卵巢转移风险评估提供参考。
1 资料与方法
1.1一般资料 选择2021年12月至2023年6月本院收治的286例胃癌患者作为研究对象。纳入标准:(1)经术后病理证实为原发性胃癌;(2)既往无卵巢癌病史;(3)年龄18岁以上。排除标准:(1)合并其他恶性肿瘤;(2)临床资料缺失;(3)术前行放疗或化疗者。286例胃癌患者中年龄≥50岁195例,<50岁91例;绝经前101例,绝经后185例;肿瘤最大径:≥5 cm 121例,<5 cm 165例;病理分型:印戒细胞癌28例,非印戒细胞癌258例;分化程度:低分化184例,中高分化102例;T分期:T1~T2分期 150例,T3~T4 分期136例;N分期:N0~N1分期 163例,N2~N3 分期123例;血清癌胚抗原(CEA)升高(>5 ng/mL)172例;血清糖类抗原125(CA125)升高(>35 U/mL)150例。卵巢转移诊断标准[7],符合以下第(1)、(2)中的任意一项及第(3)项即可诊断:(1)短期内出现CA125水平快速升高(>35 U/mL);(2)腹部增强CT或腹部增强MRI或PET/CT提示卵巢肿瘤;(3)经病理检查确诊为卵巢转移瘤。根据是否发生卵巢转移将胃癌患者分为转移组(37例)和无转移组(249例)。本研究未对纳入的患者进行随访,37例胃癌卵巢转移患者经术前影像学或术中确诊为胃癌伴卵巢转移,未发现其他器官转移。本研究已经获得本院医学伦理委员会批准(Z211201)。所有患者均签署书面知情同意书。
1.2检测CPT1C、SERPINH1的表达 取手术切除的癌组织和癌旁组织(距离癌组织5 cm以上),采用TRIzol试剂(美国Invitrogen生命技术公司)提取总RNA,通过Multiskan SkyHigh全波长酶标仪(美国赛默飞公司)选取A260/A280为1.8~2.0的标本,在PrimeScript RT Reagent Kit (大连Takara公司)上将RNA反转录为cDNA。取2 μL cDNA样品加入反应体系,通过CFX96实时定量聚合酶链反应系统(美国Bio-Rad公司)采用实时定量反转录-聚合酶链反应(RT-PCR)进行基因表达分析。采用2-ΔΔCt法计算CPT1C、SERPINH1相对表达水平。引物设计由金斯瑞生物科技公司合成,序列如下:CPT1C上游为5′-ATGGGAATGCGCCCCTTATG-3′,下游为5′-AGGTGGCGGATGTAGTCTTTT-3′;SERPINH1上游为5′-CAGAAGTTTCTCGGGACGGG-3′,下游为5′-GCCTGCCTTTTTCATTCTGGG-3′;U6(内参)上游为5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游为5′-CGCTTCACGAATTTGCGTGTCAT-3′。反应体系:PrimeScript RT Enzyme Mix1 1.0 μL,RT Primer Mix 1.0 μL,5×PrimeScript Buffer 2 4.0 μL,RNase Free dH2O 4.0 μL,cDNA模板2 μL,上、下游引物各1 μL,加水至20 μL。反应条件:95 °C预变性30 s,95 °C变性10 s,58 °C退火10 s,72 °C延伸10 s。从变性到延伸共进行了40次循环。

2 结 果
2.1胃癌组织和癌旁组织中CPT1C、SERPINH1表达水平比较 胃癌组织中CPT1C、SERPINH1表达水平高于癌旁组织(P<0.05),见表1。

表1 胃癌组织和癌旁组织中CPT1C、SERPINH1表达水平比较
2.2不同临床病理特征患者胃癌组织中CPT1C、SERPINH1表达水平比较 低分化、T3~T4分期、N2~N3分期、CA125水平升高的胃癌患者胃癌组织中CPT1C、SERPINH1表达水平高于中高分化、T1~T2分期、N0~N1分期、无CA125水平升高的胃癌患者(P<0.05),不同年龄、肿瘤最大径、组织类型及CEA水平是否升高的胃癌患者胃癌组织中CPT1C、SERPINH1表达水平比较,差异均无统计学意义(P>0.05)。见表2。
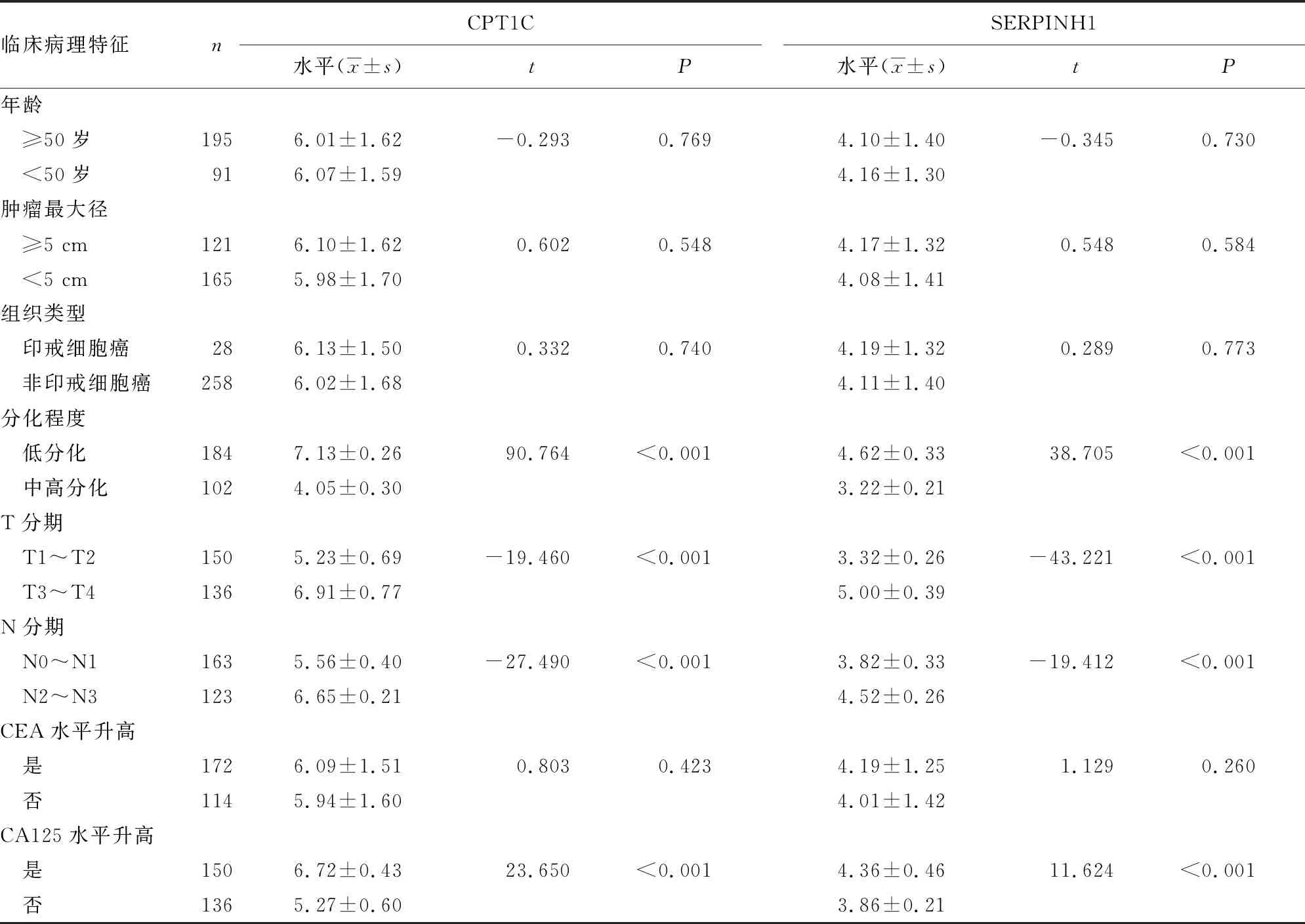
表2 不同临床病理特征患者胃癌组织中CPT1C、SERPINH1表达水平比较
2.3胃癌卵巢转移组与无转移组临床资料比较 转移组年龄<50岁、绝经前、印戒细胞癌、T3~T4分期、N2~N3分期、CA125水平升高的比例及CPT1C、SERPINH1表达水平均高于无转移组(P<0.05),CEA水平是否升高的比例在两组间比较,差异无统计学意义(P>0.05)。见表3。
表3 胃癌卵巢转移组与无转移组临床资料比较[n(%)或
2.4多因素Logistic回归分析胃癌发生卵巢转移的影响因素 以年龄(≥50岁=0,<50岁=1)、月经状态(绝经后=0,绝经前=1)、组织学类型(非印戒细胞癌=0,印戒细胞癌=1)、T分期( T1~T2分期=0,T3~T4分期=1)、N分期( N0~N1分期=0,N2~N3分期=1)、CA125水平升高(否=0,是=1)、CPT1C(原值输入)、SERPINH1(原值输入)为自变量,以胃癌是否发生卵巢转移(无转移=0,转移=1)为因变量,进行多因素Logistic回归分析,采用向后逐步法排除无关变量。最后结果显示组织学类型为印戒细胞癌、N2~N3分期、CPT1C高表达、SERPINH1高表达是胃癌卵巢转移的危险因素(P<0.05),见表4。
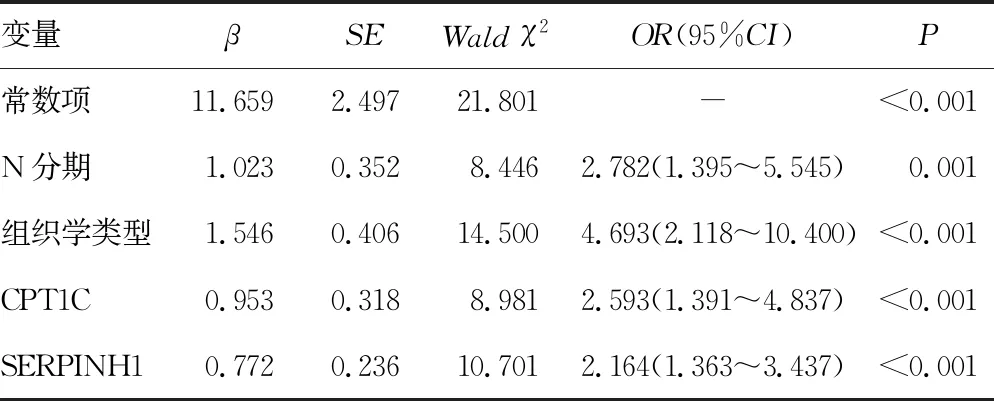
表4 胃癌卵巢转移影响因素的多因素Logistic回归分析
2.5ROC曲线分析各指标预测胃癌卵巢转移的效能 以胃癌发生卵巢转移为阳性样本,无转移为阴性样本,绘制ROC曲线,分析各指标预测胃癌卵巢转移的效能。结果显示:CPT1C、SERPINH1预测胃癌卵巢转移的AUC分别为0.777(95%CI:0.724~0.824)、0.799(95%CI:0.748~0.844),与CEA比较差异无统计学意义(Z=1.988、1.099,P>0.05),略低于CA125(Z=3.290、2.591,P<0.05);CPT1C与SERPINH1并联预测胃癌卵巢转移的AUC为0.902(95%CI:0.861~0.934),高于CPT1C、SERPINH1单项预测(Z=2.671、2.266,P<0.05),与CA125比较差异无统计学意义(Z=0.046,P>0.05)。见表5。
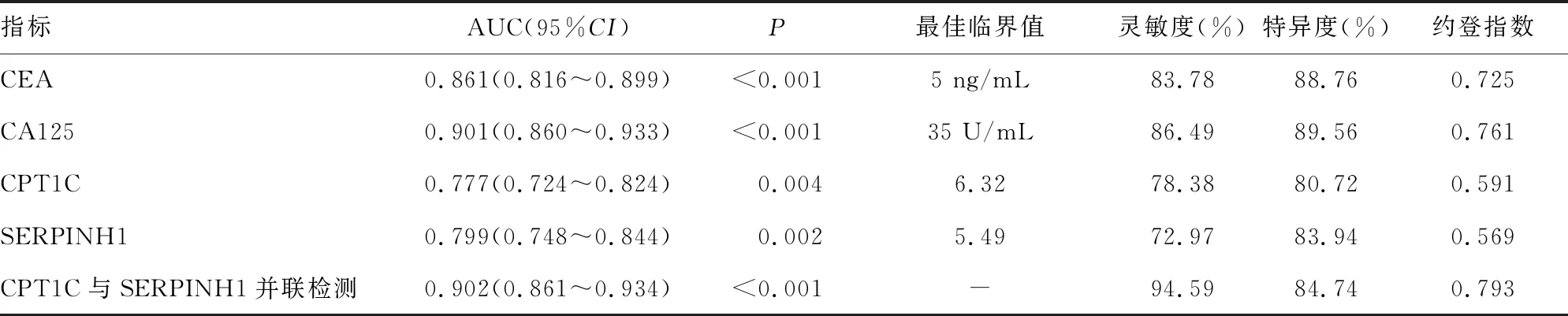
表5 各指标预测胃癌卵巢转移的效能分析
3 讨 论
胃癌转移的主要途径有淋巴结转移、血液转移和腹膜植入,癌组织侵入浆膜后脱落到腹膜腔可引起植入性转移。卵巢是胃癌最常见的腹膜植入转移部位,一旦发生卵巢转移,提示疾病处于晚期,根治性手术机会渺茫,只有当无其他远处转移或腹膜转移时才能实施联合胃、子宫、附件切除手术,大多数患者只能接受化疗和靶向治疗,预后较差[8]。胃癌卵巢转移患者多在绝经前期发病,无特异性临床表现,早期识别胃癌卵巢转移对指导临床治疗、延长患者生存时间有着重要的意义。
CPT1C可通过线粒体相关代谢重编程,保护肿瘤细胞免受缺氧和营养缺乏引起的凋亡,促使肿瘤细胞增殖,与肿瘤进展密切相关[9]。研究发现CPT1C表达异常与人类癌症的不良预后和转移进展有关,CPT1C在胃癌组织中表达上调,且与较差的总生存率和无病生存率有关,沉默CPT1C可显著抑制细胞的脂肪酸氧化(FAO)率,抑制癌细胞增殖,诱导细胞周期阻滞,促使癌细胞凋亡[10]。CPT1C表达上调有助于基底样乳腺癌中FAO的代谢偏好,促使上皮-间质转化(EMT)、癌细胞侵袭和迁移,下调CPT1C表达则抑制基底样乳腺癌细胞生长和肺部定植转移,延长疾病特异性生存期[11]。但是CPT1C与胃癌卵巢转移的关系尚不明确,本研究发现转移组胃癌组织中CPT1C表达水平高于无转移组;CPT1C高表达、N分期高、CA125水平升高均是胃癌卵巢转移的危险因素,表明CPT1C高表达可能促使了胃癌发生卵巢转移。分析其原因:FAO是保证癌细胞能量供给、促进肿瘤转移进展的关键因子,CPT1C作为FAO的限速酶,主要催化脂肪酸肉毒酰化,保证FAO进入线粒体提高FAO率,增加细胞ATP的产生,促使癌细胞增殖和迁移[3]。CPT1C过表达通过上调FAO率促进胃癌细胞迁移和侵袭,发生卵巢远处转移[12]。
现有研究证实SERPINH1在食管鳞状细胞癌中表达上调,与总生存率和无复发生存率低下相关,沉默SERPINH1基因可抑制癌细胞增殖和集落形成[13]。乳腺癌肿瘤浸润性巨噬细胞中SERPINH1高表达与不良预后有关[14]。SERPINH1与胃癌也存在密切关系,胃腺癌组织中SERPINH1表达水平升高[15],SERPINH1高表达与胃癌浸润深度增加以及预后不良有关[16]。SERPINH1也参与癌细胞转移过程,SERPINH1稳定表达与透明细胞肾细胞癌T分期高、远处转移有关,下调SERPINH1表达可抑制癌细胞转移[17]。SERPINH1还可通过未折叠的蛋白反应传感器与肌球蛋白ⅡA相互作用,增强肌动蛋白丝的收缩力,提高癌细胞的侵袭性和转移潜力,促进乳腺癌转移[18]。本研究显示SERPINH1在发生卵巢转移的胃癌组织中表达水平显著增高,SERPINH1高表达与胃癌恶性临床病理特征有关,是胃癌卵巢转移的危险因素,表明SERPINH1高表达可能参与卵巢转移过程。推测可能的机制为EMT可使癌细胞获得间质特性和更强的侵袭性,癌细胞得以进入血液循环并侵入人体其他器官,发生远处转移[19],Wnt/β-catenin信号通路异常激活,β-catenin与E-上皮钙黏附素(E-cadherin)结合形成黏附复合物,增强细胞内β-catenin积累和核易位,促使EMT并显著改变癌细胞的内部信号和外部形态,诱导胃癌细胞转移[20]。SERPINH1可激活Wnt/β-catenin信号通路诱导EMT,增强胃癌细胞侵袭性和转移能力,导致卵巢转移[21]。
ROC曲线分析显示CPT1C、SERPINH1预测胃癌卵巢转移的AUC为0.777(95%CI:0.724~0.824)、0.799(95%CI:0.748~0.844),与CEA接近,略低于CA125;CPT1C和SERPINH1并联预测胃癌卵巢转移的AUC为0.902(95%CI:0.861~0.934),高于CPT1C、SERPINH1单项预测,并且与CA125接近,提示CPT1C、SERPINH1在胃癌卵巢转移评估中具有较高价值,可作为胃癌卵巢转移的潜在标志物。
综上所述,胃癌组织中CPT1C、SERPINH1表达水平显著增高,且与胃癌低分化、TN分期高、CA125水平升高有关,CPT1C、SERPINH1高表达是胃癌患者卵巢转移的危险因素,联合CPT1C、SERPINH1可预测胃癌卵巢转移风险。本研究不足之处在于未分析CPT1C、SERPINH1与胃癌患者预后的关系,尚待开展随访加以证实。