基因编辑技术在猪育种中的研究进展
刘志国,黄 雷,杨丽景,王 楠,2,牟玉莲*
(1.中国农业科学北京畜牧兽医研究所,北京 100193;2.中国农业科学院农业基因组研究所,广东深圳 518120;3.天津市宁河原种猪场有限责任公司,天津 301504)
我国是世界上最大的猪肉生产和消费国,生猪育种和养殖是关系着我国国计民生的大产业,在农业生产和国民经济中占有重要地位,对国民生活水平及肉类供应安全至关重要。传统表型选择育种技术为我国的生猪品种改良做出了重大贡献,但是表型选择育种技术不仅受到种群内现有遗传变异的限制,同时在改良复杂性状尤其是低遗传力性状方面存在先天不足,且在育种周期、育种成本、选种准确性等方面都还需要进一步提升。新型遗传工程技术,特别是以基因编辑技术为代表的高效、精准基因工程技术的出现,为生猪育种提供了前所未有的新工具和新方法。通过CRISPR/Cas9 等基因编辑技术,可以直接对猪基因组进行精确修改,从而对猪的单个或者多个目标性状实现持续性改良,为生猪种质创新和新品种培育提供了革命性的技术手段,是我国养猪业可持续发展和肉类供应安全的保障。本文对基因编辑技术及其在猪遗传育种方面的研究和应用情况进行介绍,以期为相关科研人员、育种工作者以及政策制定者提供参考。
1 基因编辑技术研究进展
1.1 CRISPR/Cas9 基因编辑技术
CRISPR/Cas9 系统的全称为规律成簇间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)以及CRISPR相关蛋白9(CRISPR-associated protein 9,Cas9)。该系统是在细菌和古细菌中广泛存在的一种获得性免疫系统[1],细菌和古细菌通过该系统特异性的抵抗外源基因导入。2013 年,Jennifer 等[2]首次报道了CRISPR/Cas9 系统可改造为可编程的RNA 引导的DNA 核酸内切酶。Cong 等[3]和Mali等[4]利用改造后的CRISPR/Cas9 系统首次在哺乳动物细胞中实现了靶向基因编辑。此后,CRISPR/Cas9 技术因其简单、高效的特点迅速成为植物、动物、微生物基因敲除、基因敲入、大片段删除等遗传操作的首选技术。
CRISPR/Cas9 基因编辑系统由一条单链向导RNA(single guide RNA,sgRNA)和Cas9 蛋白构成,sgRNA 能够与Cas9 蛋白结合并改变其构象,并通过碱基互补配对与靶向DNA 特异性结合。Cas9 蛋白是一种脱氧核糖核酸内切酶,能够在sgRNA 的引导下切割DNA 双链,导致DNA双链断裂(Double strand break,DSB,图1),激活细胞自身DNA 损伤修复机制。DSB 的修复方式主要分为非同源末端连接(Non-homologous end joining,NHEJ)和同源重组修复(Homology-directed repair,HDR)两种类型。大多数情况下,细胞优先启动NHEJ 机制,直接将断裂的DNA 两端连接起来。这种修复方式容易使断裂部位发生碱基对随机的插入或缺失,如果这种随机插入或缺失发生在基因编码区且插入或者缺失的碱基对数量不是3 的倍数时,就会产生移码突变进而导致基因功能丧失[3]。如果存在与DSB 区域序列相同的同源序列,则细胞会有一定的概率激活HDR 机制,根据同源片段序列信息对DSB 区域进行精准修复。利用细胞的HDR 机制,向细胞导入具有同源序列的单链或者双链DNA 片段(供体DNA),即可将供体DNA 中的遗传信息精准复制到细胞基因组DNA 中,实现目的基因敲入[3]。
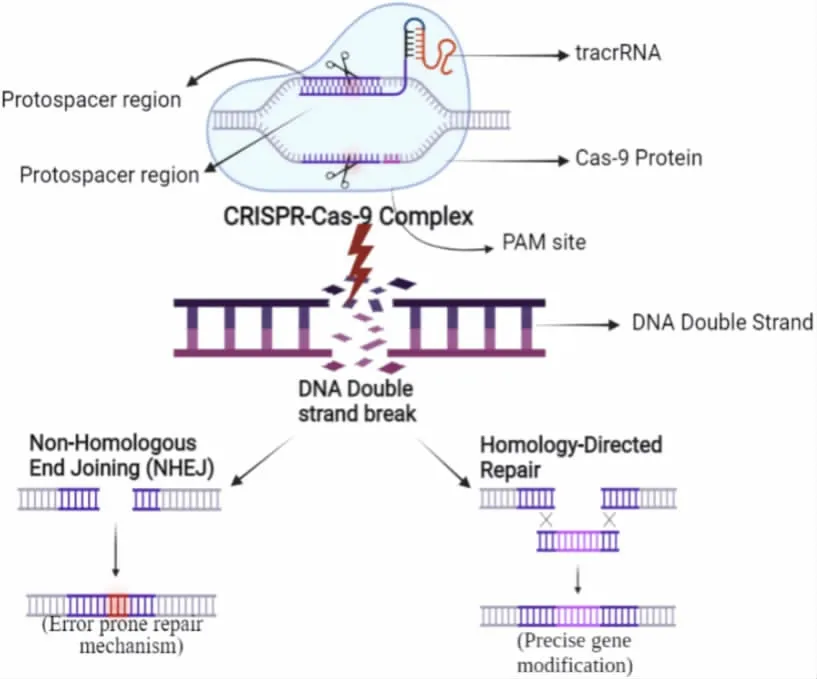
图1 CRISPR/Cas9 系统介导基因编辑的工作原理[3]
1.2 单碱基编辑技术
单碱基编辑器(Base editors,BE)是在CRISPR/Cas9 系统上进一步发展出的一种不依赖于DSB 的新型基因编辑技术,根据碱基转换类型可分为腺嘌呤碱基编辑器(Adenine base editors,ABE)、胞嘧啶碱基编辑器(Cytosine base editors,CBE)等多种类型。David 等[4]率先开发出CBE(图2)碱基编辑器系统。CBE系统主要由无核酸切割活性的Cas9(deactivated Cas9,dCas9)蛋白或者单链切割活性的Cas9(Nickase Cas9,nCas9)蛋白,尿嘧啶DNA糖基化酶抑制剂(Uracil DNA glycosylase inhibitor,UGI),胞嘧啶脱氨酶以及连接肽等元件融合组成,其工作原理是dCas9-胞嘧啶脱氨酶复合物或者nCas9-胞嘧啶脱氨-UGI复合物在sgRNA 引导下特异性与目标DNA 序列结合,dCas9 或者nCas9 蛋白使DNA局部解链,胞嘧啶脱氨酶与非sgRNA 互补配对的DNA 链结合,将该链上特定区域的胞嘧啶(C)脱氨变成尿嘧啶(U),而尿嘧啶(U)则可以通过细胞自身的DNA 修复或DNA 复制机制被胸腺嘧啶(T)替换,最终实现完成C 到T 以及互补链G 到A 的替换。UGI 的作用是抑制哺乳动物细胞内的尿嘧啶DNA 糖基化酶活性,防止其识别U-G 错配并通过碱基错配修复途径将U-G 逆转为原始C-G 碱基对,从而提高哺乳动物细胞内的C到T 转换效率[5]。
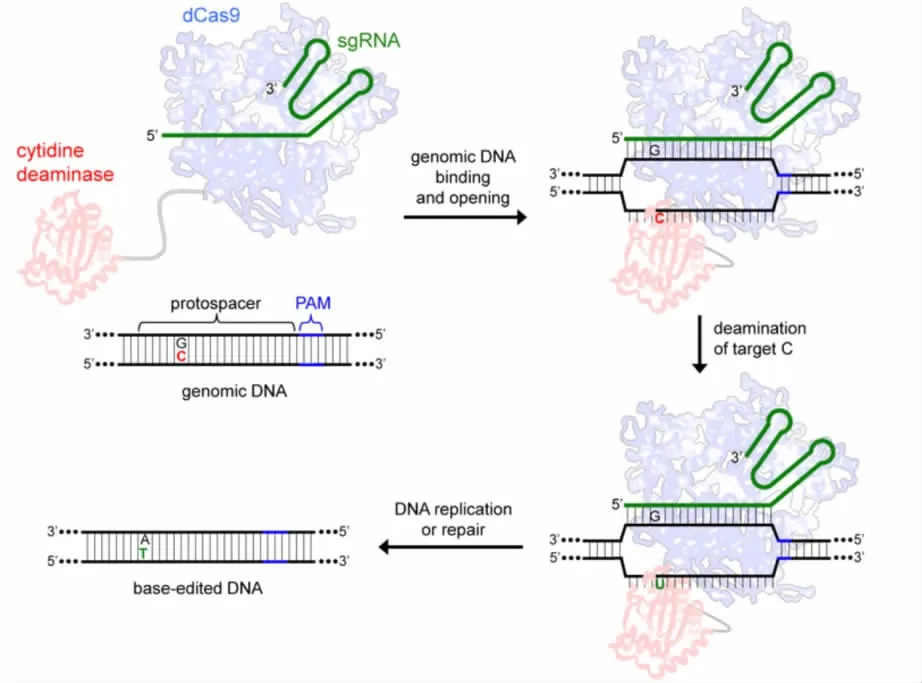
图2 CBE 系统的工作原理[4]
2017 年,David 等[6]进一步开发出ABE 碱基编辑系统(图3)。与CBE 碱基编辑系统类似,ABE 碱基编辑主要由腺嘌呤脱氨酶与nCas9 蛋白融合组成。但是与CBE 系统不同的是,ABE 系统中使用的腺嘌呤脱氨酶并不是自然界天然存在的,而是通过多轮定向进化技术人工优化而来的。ABE 系统的工作原理是腺嘌呤脱氨酶首先将识别区域内的腺嘌呤(A)脱去氨基,变成肌苷(I),在DNA 复制过程中,DNA聚合酶会将I 识别为鸟嘌呤(G),使其与C 配对,随后在DNA 复制过程中I-C 配对会被修正为G-C,实现A-T 碱基对到G-C 碱基对的转换。
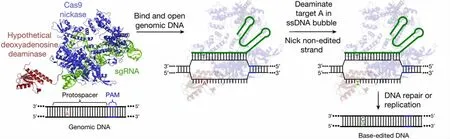
图3 ABE 系统的工作原理 [6]
在CBE 和ABE 系统诞生后,多个团队先后对单碱基编辑系统进行了优化,提高了编辑效率,丰富了碱基转换类型,降低了单碱基编辑器的脱靶效应,扩大了序列识别范围[7]。相比于CRISPR/Cas9 基因编辑技术,单碱基编辑技术不依赖DSB,对动物基因组的扰动更小,安全风险更低,因此在猪育种研究中,单碱基编辑技术已展现了很好的应用前景[8]。
1.3 先导编辑技术
2019 年,David[9]又开发了全新的基因编辑技术—先导编辑(Prime editing,PE),不同于单碱基编辑技术只能实现有限类型的碱基转换,PE 技术(图4)可以实现所有12 种碱基的互换,而且无需供体DNA 即可实现短序列的精确插入和删除。PE 系统包括一个融合了逆转录酶的Cas9 切口酶以及一条先导编辑向导RNA(Prime editing guide RNA,pegRNA)。其中pegRNA 包括3 部分不同的序列,第一部分是单链向导RNA(Single-guide RNA,sgRNA),其作用是引导nCas9 与目标DNA 结合;第二部分是引物结合位点(Prime binding site,PBS),用于与nCas9 产生的切口处3 端互补配对;第三部分是逆转录模板(RT template including edit),用于引入目的突变。PE 系统的工作原理为nCas9-逆转录酶复合体在pegRNA 引导下结合到靶标双链DNA 上,之后nCas9 蛋白再与pegRNA 序列不互补的DNA 链产生单链切口,切口处3'端与pegRNA 上的PBS 序列互补结合,进而引导逆转录酶以PBS 序列下游的RNA 序列为模版进行DNA 合成,形成3' 端编辑Flap 的产物,这时携带3' 端编辑Flap 的产物与携带5'端非编辑Flap 的产物稳定平衡,其中5'端非编辑Flap 在某些情况下会被细胞内核酸酶切除进而留下一条编辑链和一条非编辑链的产物,在细胞进行DNA 修复后最终获得双链都经过编辑的DNA。最初先导编辑的编辑效率相对较低[10],然而通过不断的优化,如最佳引物结合解链温度[11]、使用两种pegRNA[12]、对逆转录酶进行修饰[13]等优化,大大提高了先导编辑的编辑效率。
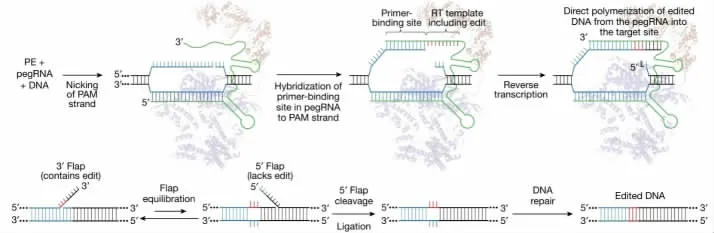
图4 先导编辑系统工作原理 [9]
2 基因编辑技术在猪育种中的应用
2.1 提高猪抗病性能
疫病一直以来都是困扰畜牧业高质量、稳定发展的难题之一,动物疫病不仅给畜牧业造成巨大的经济损失,同时也威胁人类健康。例如包括猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmis sible gastroenteritis virus,TGEV)、猪Delta 冠状病毒(Porcine Delta coronavirus,PDCoV)、猪急性腹泻综合征冠状病毒(Swine acute diarrhea syndrome coronavirus,SADS-CoV)、中东呼吸综合征冠状病毒(Middle east respiratory syndrome coronavirus,MERS-CoV)等多种病毒在内的冠状病毒属,是对人类和牲畜健康危险最大的病毒属之一[14,15]。因此,提高畜禽动物对病原体的抵抗力或耐受力是畜禽育种工作的重要方向。然而,抗病性是一个复杂的多基因性状,采用传统的遗传选择方法进行抗病育种成本高、耗时长、效率低,同时还存在疫病扩散的风险。此外,疫苗和抗生素的广泛应用以及批次化生产方式的推广也在一定程度上削弱了抗病性状选育的紧迫性。基因工程技术的诞生为畜禽抗病育种提供了新思路和新方法,例如利用基因打靶和转基因技术成功培育出不含朊病毒蛋白的牛[16]和抗口蹄疫病毒的猪[17]。近年来,基因编辑技术,特别是CRISPR/Cas9 介导的基因敲除/ 敲入和精确修饰技术极大地降低了抗病育种的成本,提高了抗病畜禽新品种的培育效率,能够有效提升畜禽养殖企业的经济效益,并为畜牧业高质量、稳定发展提供重要推动力(表1)。
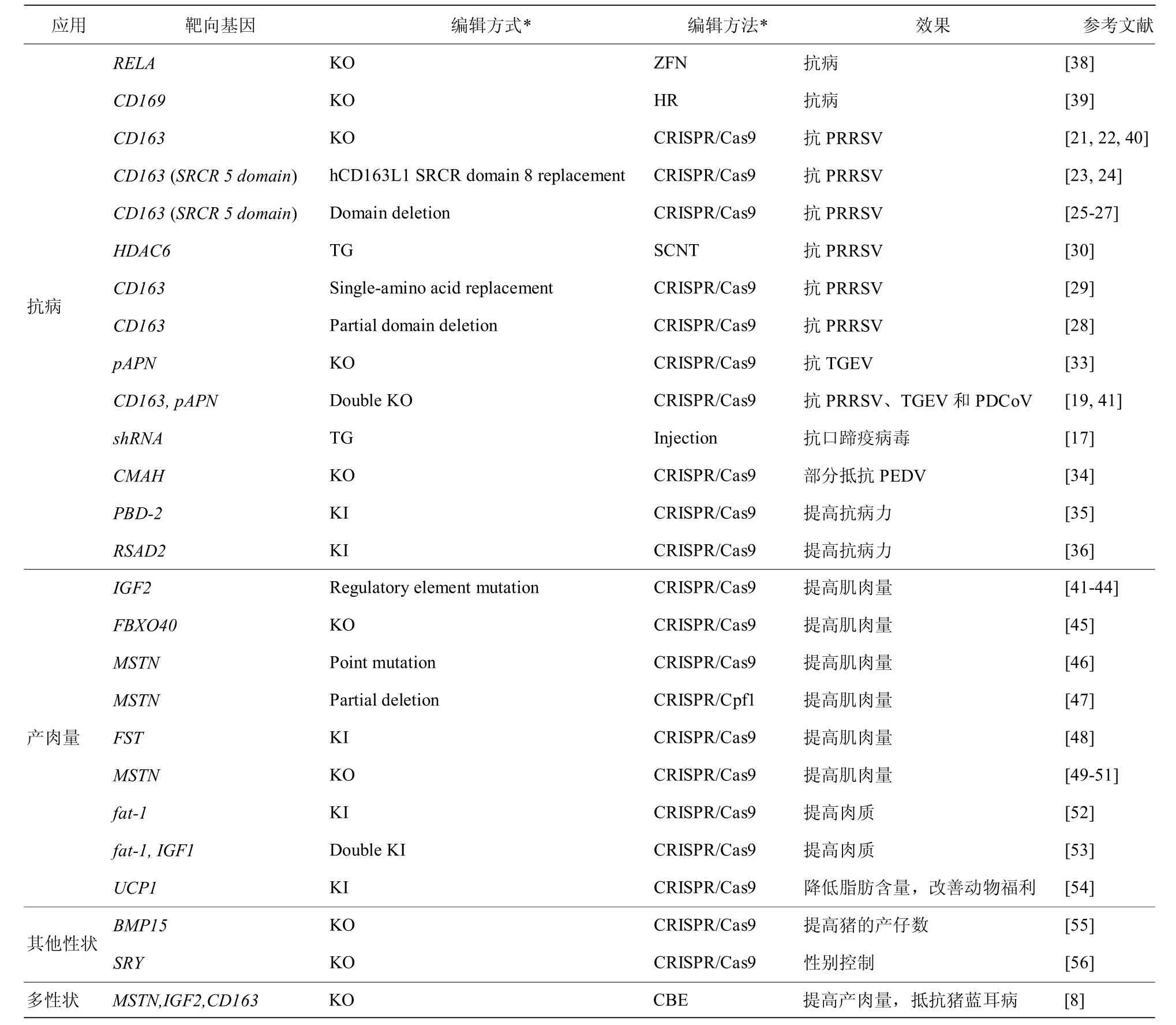
表1 基因编辑技术在猪育种中的应用
猪繁殖与呼吸综合征病毒(Porcine reproduc tive and respiratory syndrome virus,PRRSV)是严重威胁全球生猪养殖业健康发展的一种烈性病毒,可导致母猪流产、死胎以及仔猪的大量死亡[18,19]。从2014 年开始,美国密苏里大学研究团队利用CRISPR/Cas9 基因编辑技术先后敲除了与PRRSV感染宿主相关的CD169 以及CD163 基因,分别获得了CD169 和CD163 基因敲除猪[20]。随后的攻毒实验发现无论是直接感染还是与已经感染猪蓝耳病病毒的猪饲养在同一猪栏中,CD163 双等位基因敲除猪对PRRSV 具有完全抗性[21]。Yang 等[22]研究进一步证明CD163 基因敲除猪对高致病性PRRSV 也具有完全的抵抗力。除直接敲除外,通过同源替换[23,24]或精确删除CD163 蛋白的SRCR5结构域[25-28],也可以实现对PRRSV 的抵抗。Xu等[29]则利用基因编辑技术对CD163 蛋白第561 位精氨酸进行了精准编辑,将其替换为丙氨酸并获得了CD163 蛋白单个氨基酸位点突变的基因编辑猪,利用从该基因编辑猪中分离的肺泡巨噬细胞(Porcine alveolar macrophages,PAM)进行体外攻毒实验,发现该基因编辑猪的PAM 细胞能显著抑制PRRSV 的感染,这一研究首次实现了单个氨基酸的精准替换,是精准基因编辑育种走向应用的第一步。除了CD163 基因外,Lu 等[30]发现组蛋白去乙酰化酶6(HDAC6)也具有抗PRRSV活性,在猪体外和体内过量表达HDAC6 可以增强其对PRRSV 的抵抗力。
除PRRSV 外,病毒性腹泻也是生猪产业的重大威胁之一。常见的猪腹泻病毒包括TGEV、PEDV、PDCoV 等多种。其中,猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是一种以感染仔猪导致严重腹泻和快速脱水进而致死为主要临床特征的病毒性肠道疾病,潜伏期短,传播速度快,发病急,对2 周龄以下的仔猪危害巨大,10 日龄以内仔猪致死率可达100%[31]。成年猪只虽然感染TGEV 后一般不会死亡,但是会使猪只的生长速度变慢,影响其生产效率和生产性能。TGE 发病极为迅速,波及的范围也很广,而且常与PEDV、PDCoV 等病毒混合感染,且多发于冬、春季,给生猪养殖业造成了巨大的经济损失[14,32]。2018 年,美国密苏里大学首次利用基因组编辑技术获得pAPN 基因编辑猪,攻毒试验表明pAPN 基因编辑猪对TGEV 具有抵抗力[33],但是不能抵抗PEDV。2020 年,Xu 等[19]利用基因编辑技术对CD163 和pAPN 基因进行敲除,成功获得CD163 和pAPN 双基因编辑纯合子猪,活体攻毒研究表明,该双基因编辑猪可同时抵抗PRRSV和TGEV 感染,且显著性抑制PDCoV 的感染;性能测定及屠宰实验表明该CD163 和pAPN 双基因编辑猪的繁殖性能和生产性能均与野生型猪无显著差异。Tu 等[34]通过显微注射技术和CRISPR/Cas9 基因编辑技术,获得了CMP-N 糖神经氨酸羟化酶(CMAH)基因敲除猪,攻毒实验显示虽然CMAH 基因敲除仔猪表现出PEDV 发病延迟和疾病严重程度减轻,但它们对PEDV 并不完全免疫。
除了敲除猪基因组中介导病毒感染的受体基因外,还可以通过在猪基因组中稳定表达抗病毒蛋白进而提高猪的抗病性能。例如将具有抗病毒效果的猪β 防御素2(Porcine β-defensin 2,PBD2)[35]以及蝰蛇蛋白基因(Radical S-adenosyl methionine domain containing 2,RSAD2)基因定点整合到猪基因组中的友好位点[36],使其在猪的体细胞中稳定表达,可以显著抑制经典猪瘟病毒(Classic swine fever virus,CSFV)和伪狂犬病毒(Pseudorabies virus,RPV)等病毒的感染。这些研究表明,基因编辑育种技术可以有效的提高猪对某些疫病的抵抗力和免疫力,在新品种培育方面具有巨大的市场前景[18,37]。
2.2 提高猪的生产性能
生产性能是畜禽养殖中最重要的经济指标,提高猪的生产性能长久以来都是猪育种的首要目标。Myostatin(MSTN)基因是骨骼肌生长发育的负调控因子,该基因的敲除会导致动物表现出肌肉质量增加的双肌表型。MSTN 的自然突变已经在牛[57,58]、羊[59]、狗[60]、猪[61]和人类[62]中报道。MSTN 基因敲除猪不仅瘦肉产量显著增加[63-65],同时多不饱和脂肪酸水平显著增加[49,65]。尽管MSTN基因敲除明显增加了猪的瘦肉率,但在西方商业猪种如大白、长白等品种的MSTN 基因敲除猪中观察到较为严重的仔猪后肢无力现象[61]。Fan 等[49]对多个不同品种的MSTN 基因编辑猪进行了长期的评估,他们开发了一种基于编辑位点的解决方案,可以克服MSTN 基因编辑猪后肢无力的问题,并表明MSTN 基因编辑可以可持续地提高猪的瘦肉产量并增加猪肉中多不饱和脂肪酸含量,而且不会对饲料转化率或产仔数产生不良影响。类胰岛素生长因子2(Insulin like growth factor 2,IGF2)基因也是调控肌肉量的基因,对该基因的精准编辑也可以显著提高猪肌肉产量。通过CRISPR/Cas9 基因组编辑技术修改IGF2 基因内含子3 中的ZBED6 结合位点,可以极大地提高中国本土猪种如中国巴马猪和两广小花猪的肌肉量[42,43]。
在肉质改良方面,fat-1 脂肪酸去饱和酶基因可以将n-6 多不饱和脂肪酸转化为n-3 多不饱和脂肪酸,从而提高猪肉品质。Li 等[52]利用CRISPR/Cas9 技术将fat-1 基因敲入到猪Rosa26位点,该基因敲入猪n-3 多不饱和脂肪酸水平显著上升。You 等[53]通过将fat-1 和IGF-1 基因同时插入猪Rosa26 基因座,制造出了双基因敲入猪,能够同时提升猪的肌肉量和肉品质。Zheng 等[54]人采用CRISPR/Cas9 介导的方法,将小鼠解偶联蛋白1(Uncoupling protein 1,UCP1)cDNA 定点插入猪内源性UCP1 基因座,获得的UCP1 基因敲入猪脂肪沉积较少,胴体瘦肉率高,而且在寒冷环境中维持体温的能力有所提高。
2.3 其他性状改良。
在生猪养殖中,通常会对雄性仔猪进行阉割,这样一方面可以减少雄性生殖发育的能量消耗,另一方面可以避免雄烯二酮和甲基吲哚等物质影响猪肉的口感。但是仔猪阉割也存在风险,操作不当会引起仔猪感染甚至死亡,降低生产效率,且仔猪阉割也涉及动物福利伦理等问题。Kurtz 等[56]使用CRISPR/Cas9 技术对猪的性别控制基因SRY(Sex determine region Y)的特定区域进行编辑,发现编辑后的雄性仔猪发育出了雌性生殖器官,证明了通过基因编辑技术控制仔猪性别的可行性。
猪是多胎动物,母猪的产仔数与生猪养殖业的经济效益密切相关。但是母猪繁殖力属于低遗传力性状,通过常规育种技术进行选育费时费力。Shi 等[55]利用CRISPR/Cas9 技术获得了骨形态发生蛋白15(Bone morphogenetic protein 15,BMP15)基因编辑大白猪,单等位基因编辑母猪初产活仔数可达13 头,具有高产潜能。除了单一性状的改良外,基因编辑技术还为猪的多性状改良提供了可能性,Song 等[8]利用单碱基编辑系统同时对CD163、MSTN 以及IGF2 三个基因进行精确编辑,同时提高了猪的生长性能和抗病性。
3 小结
基因编辑育种技术可以提高动植物遗传改良的速度,增强我国动植物育种行业的市场竞争力。目前我国在畜禽基因编辑技术应用研究方面已处于国际先进水平,取得了许多具有重大应用价值的成果。未来经过一系列科学、全面的安全评价,这些研究成果有望进一步进入商业化生产。美国在基因编辑动物商业化应用方面走在了世界前列,已于2020 年12 月14 日批准了“Gal-Safe”基因编辑猪可用于食用和医用,于2022 年3 月7 日又批准了一种基因编辑肉牛可用于食用。我国农业农村部于2022 年1 月24 日发布了 《农业用基因编辑植物安全评价指南(试行)》,并于2023 年4 月28 日发布了 《农业用基因编辑植物评审细则(试行)》,为我国基因编辑动植物的商业化应用奠定了重要的基础,也将进一步推动我国动植物生物育种的研发与应用。

