鸡脾脏METTL3、METTL14 基因对肠炎沙门氏菌感染的表达调控
赵亚男,任艳茹,谢 宾,王园美,李显耀*
(1.山东农业大学动物科技学院,山东泰安 271018;2.济宁市任城区畜牧兽医事业发展中心,山东济宁 272000)
沙门氏菌病是一类由某些特定血清型沙门氏菌引起的动物急性或慢性疾病,是重要的人畜共患病之一,防治沙门氏菌病具有十分重要的公共卫生学意义[1]。肠炎沙门菌(Salmonella enterica serovar Enteritidis,SE)作为一种食源性病原菌,分布广泛且传播途径复杂,主要通过畜禽产品传递给人类,对养鸡业和人类健康危害严重[2]。目前关于应对肠炎沙门氏菌感染的问题,传统的方法,如疫苗接种[3]和噬菌体治疗[4]等生物方法大多存在局限性,如耗费人力物力、治疗周期长、效果低等。随着分子生物学技术的发展,从遗传育种的角度筛选相关抗病育种分子标记或利用同源重组等技术成为未来抗病育种的研究方向,因此如何利用分子手段应对肠炎沙门氏菌的感染显得尤为重要。而m6A 甲基化作为一种表观遗传学修饰,现在已经成为分子生物学的研究热点,利用m6A 甲基化测序技术(meRIP-seq)可以筛选相关甲基化位点从而作为一些分子标记应用到抗病遗传育种中。有研究表明m6A 甲基化参与病毒在宿主细胞中的复制过程[5]。m6A 修饰过程主要涉及甲基转移酶、去甲基化酶和特异性结合蛋白的共同调控。而METTL3 和METTL14 作为甲基化转移酶的重要成员,它们的表达在一定程度上会影响m6A 甲基化修饰过程,从而影响病毒在宿主中的定植[6,7]。除此之外,METTL14 还参与调控肌内脂肪沉积过程,Zhang 等[8]通过甲基化测序(MeRIP-seq)和RNA 测序(RNA-seq)对180 日龄靖远鸡的乳房和腿部肌内脂肪的调控研究,发现METTL14 参与肌肉脂质合成代谢的调节。目前关于m6A 甲基化修饰在肠炎沙门氏菌上的研究还未见相关报道。m6A 甲基化(N6-Methyladenosine Modifications)作为一种可逆的表观遗传修饰,是真核生物中最普遍且最丰富的转录后修饰[9]。甲基转移酶、去甲基化酶和m6A 结合蛋白参与m6A 甲基化的可逆动态调控[10]。m6A 甲基化会影响RNA 的转录、翻译、剪切与降解等生物学过程[11,12]。研究表明,m6A 甲基化在动物繁殖、生长发育、免疫等方面发挥重要的调控作用[13]。METTL3 缺陷可以影响相关mRNA 的m6A 甲基化修饰,抑制IL-7 介导的STAT5 活性以及T 细胞内稳态增殖和分化,从而预防肠炎的发生[14]。METTL14 在诱导自噬和阻碍骨质疏松过程中起关键作用,过表达METTL14 可以通过m6A 修饰调控beclin-1 的表达诱导自噬,从而显著增强骨髓间充质干细胞成骨分化能力[15]。
mRNA 的表达调控参与了机体感染沙门氏菌后的免疫应答过程。有研究表明,鸡感染沙门氏菌后,脾脏FNP1 mRNA 表达显著上调[16]。Wu等[17]通过对鸡灌服接种肠炎沙门氏菌,并对第7天和第14 天鸡的脾脏组织进行基因芯片检测发现,GC、TNFSF8、CD86、CD274、BLB1 和BLB2 基因可能参与应对肠炎沙门氏菌感染调控过程。目前传统方法如疫苗、抗生素等具有一定的局限性,且尚无有效的治疗药物或疫苗。从长远角度来看,可通过抗病育种等技术手段培育抗性品种(品系),提高群体遗传抗性。目前关于利用分子标记应用到抗病育种的研究有很多,通过利用反义基因阻碍病原蛋白的转译法,现已成功克隆出新城疫(ND)、马立克氏病(MD)、传染性支气管炎(IB)、法氏囊病毒(IBD)和禽网状内皮组织增生症(RE)等的基因片段[18]。然而目前关于甲基化转移酶在肠炎沙门氏菌感染的表达调控机制还不清楚,本研究利用实时荧光定量PCR(qRT-PCR)检测鸡感染肠炎沙门氏菌后不同时间点脾脏组织METTL3、METTL14 基因表达量的变化,从而为METTL3、METTL14 基因在鸡肠炎沙门氏菌感染中的调控机制提供理论基础和参考依据。
1 材料与方法
1.1 试验鸡及饲养管理
利用胎粪涂板法对1 日龄济宁百日鸡(父本)×广西瑶鸡(母本)的F1 代预先进行SE 含菌量检测,采集每只鸡的胎粪于含PBS 的离心管中,涂布于SS 琼脂,16~24h 后观察结果,并随机挑选40 只2 日龄肠炎沙门氏菌阴性济宁百日鸡(父本)×广西瑶鸡(母本)的F1 代,试验动物由济宁大唐百日鸡养殖有限公司提供。将40只鸡随机分为2 组,各20 只,分别饲喂于饲养环境相同的2 个无菌隔离器中,自由采食和饮水。
1.2 动物接种及样品采集
试验所用肠炎沙门氏菌购自中国兽医微生物菌种保藏管理中心(CVCC3377)。试验组每只鸡经口灌喂0.3mL 含菌量为6.34×107CFU/mL 的肠炎沙门氏菌菌液,对照组灌喂等量无菌PBS,于接种后第1 天及第7 天采集各采集10 只鸡的脾脏组织,置于液氮中速冻后转移至-80℃超低温冰箱中保存,供后续试验使用。
1.3 组织RNA 提取,反转录及实时荧光定量PCR
使用Trizol 法(试剂均购自南京诺唯赞生物科技有限公司)分别提取感染后第1 天及第7 天试验组和对照组脾脏组织总RNA,利用微量紫外分光光度计(NanoDrop 2000,USA)和琼脂糖凝胶电泳成像系统(Ge1300series,Alpha Innotech)对所提取的总RNA 进行浓度和质量检测,质检合格后利用Evo M-MLV 反转录试剂盒(湖南艾科瑞生物工程有限公司)将总RNA 反转录为cDNA;参照GenBank 中的基因序列,以GAPDH为内参,利用DNAMAN 软件设计特异性引物,所设计的引物由上海生工生物工程技术服务有限公司合成,引物序列如表1 所示。SYBR Green Pro Taq HS 预混型qPCR 试剂盒购于湖南艾科瑞生物工程有限公司;利用SYBR Green Pro Taq HS预混型qPCR 试剂盒(湖南艾科瑞生物工程有限公司)通过实时荧光定量PCR 仪(Roche qPCR仪Light Cycler@96,Roche Diagnostics)。
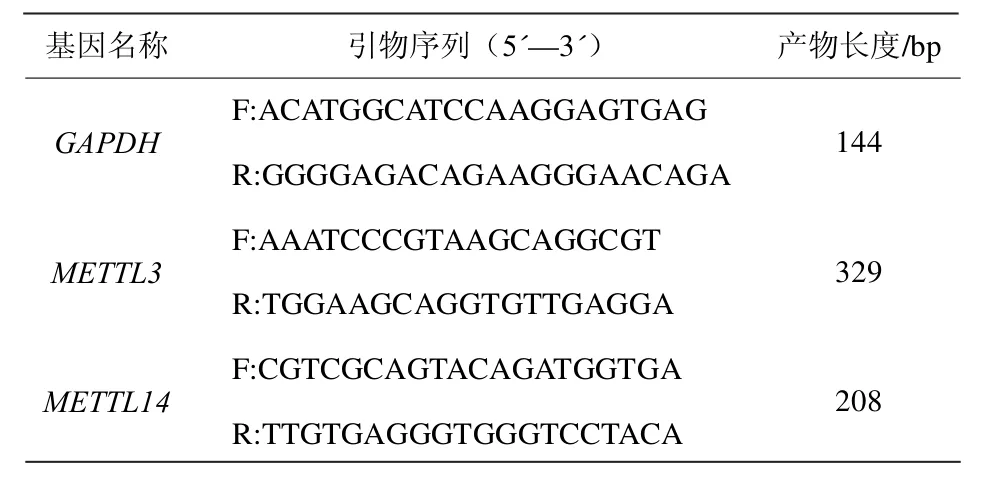
表1 引物序列
1.4 数据处理与分析
利用Excel 对所得数据进行预处理,并利用SAS 9.2 软件进行方差分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。采用2-ΔΔCt法计算目的基因相对表达量,并用GraphPad Prism 8 软件进行作图。
2 结果与分析
如图1a 所示,在感染后第1 天,对照组中脾脏METTL3 的表达量显著低于试验组(P<0.05),感染后第7 天对照组高于试验组,但差异不显著(P>0.05)。对不同时间点相同处理组之间进行分析发现,对照组中感染肠炎沙门氏菌后第1 天METTL3 表达量低于感染后第7 天,而试验组完全相反,感染肠炎沙门氏菌后第1 天METTL3 表达量高于感染后第7 天(图1b)。
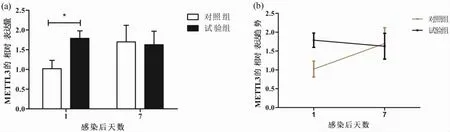
图1 感染肠炎沙门氏菌后METTL3 在鸡脾脏中的表达量及表达趋势
如图2a 所示,对同一时间点对照组和试验组脾脏中相对表达水平进行分析发现,在感染后第1 天,对照组中脾脏METTL14 的表达量显著低于试验组,感染后第7 天对照组高于试验组,且差异均显著(P<0.05);如图2b 所示,对不同时间点相同处理组之间进行分析发现,对照组和试验组中感染肠炎沙门氏菌后第1 天METTL3 表达量均极显著低于感染后第7 天(P<0.01)。
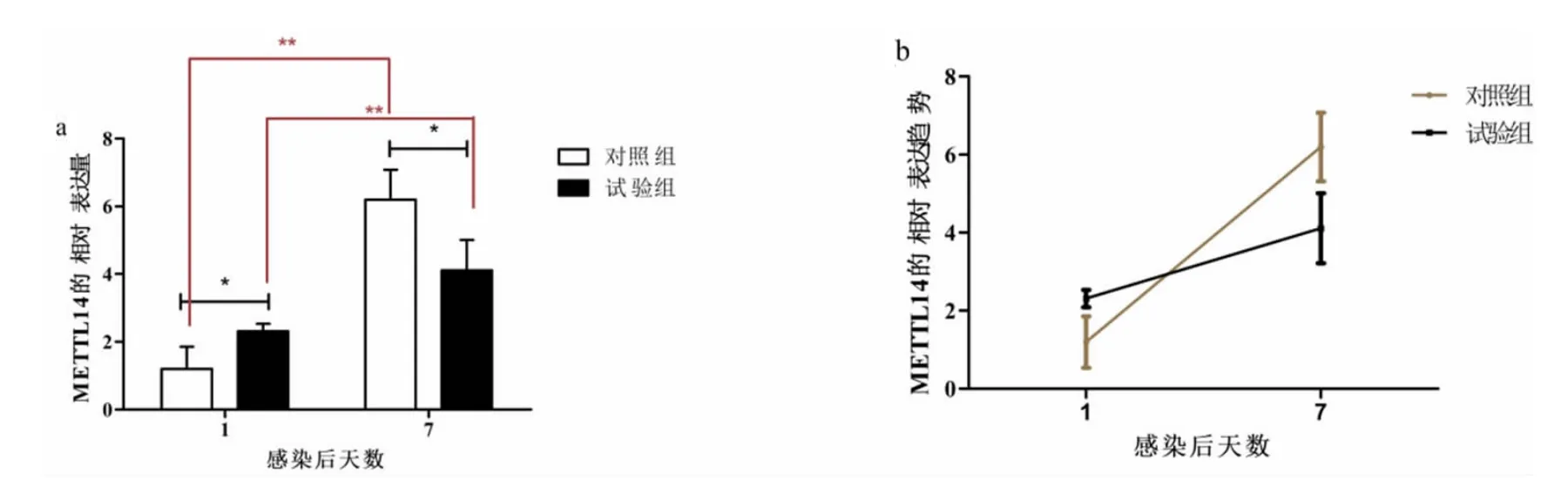
图2 感染肠炎沙门氏菌后METTL14 在鸡脾脏中的表达量及表达趋势
3 讨论
在本试验中,在感染肠炎沙门氏菌后第1天,METTL3 和METTL14 在脾脏中的表达水平均是试验组高于对照组,但是在感染后第7 天,虽然METTL3 和METTL14 在脾脏中的表达水平均有所升高,但是试验组均低于对照组,说明METTL3 及METTL14 表达量在一定程度上是呈现动态变化的,丁浩等[19]通过对不同发育时期骨骼肌中METTL3、METTL14 表达水平进行研究,发现METTL3、METTL14 表达量也具有一定的动态变化趋势,这与我们的研究结果具有一定的相似性。空肠弯曲菌和肠炎沙门氏菌同属于革兰氏阴性菌,机体对他们的免疫调控机制具有一定的相似性。张彩凤等[20]通过研究2 日龄无特定病原菌(SPF)鸡接种空肠弯曲菌后4、8、12、16、20、24h 等时间点脾脏组织METTL3、METTL14 的表达量水平,发现鸡感染空肠弯曲菌可以引起METTL3、METTL14 的差异表达,且具有昼夜节律性。研究表明,m6A 机制表达的变化可以影响细胞基因表达,从而间接调节病毒及细菌的生命周期[21,22]。机体遭受细菌和病毒攻击后会产生一系列免疫反应,免疫系统是一种宿主防御系统,可防止宿主出现感染和疾病发生[23]。近年来,越来越多的研究表明,m6A 修饰参与免疫应答的诱导过程。m6A 甲基转移酶蛋白METTL3 和METTL14可以负向调控HCV(丙型肝炎病毒)的复制过程,且HCV RNA 的m6A 修饰受WTAP 的调控[24]。另外有研究表明m6A 甲基化酶METTL14可以通过Akt/mTOR 信号通路调控心肌缺血/ 再灌注损伤,心肌损伤后会引起m6A 甲基化转移酶METTL14 的表达升高[25]。因此我们推测m6A 甲基化修饰可能参与细菌的防御反应过程,然而具体的机制还需要进一步研究。
4 结论
本研究结果表明,鸡接种肠炎沙门氏菌后,可以引起脾脏组织METTL3 和METTL14 的差异表达,推测m6A 甲基化参与肠炎沙门氏菌的防御反应过程,本研究初步揭示了m6A 甲基化修饰参与细菌的防御反应过程的分子基础,但具体的调控机制还需进一步的研究。

