基于网络药理学及实验验证探讨淫羊藿苷干预强直性脊柱炎的分子机制❋
徐晓涵,刘宏潇,屈馨宁,宋俊垚
(中国中医科学院广安门医院,北京 100053)
强直性脊柱炎(ankylosing spondylitis,AS)是一种以炎症性腰痛、晨僵和脊柱活动受限为特征的慢性进行性自身免疫病,其基本病理改变是附着点处炎症,通常发生在骶髂关节、脊柱关节和椎旁组织等[1],随着病情的发展,附着点处发生广泛钙化,导致关节畸形、活动受限甚至残疾[2]。同时,AS可并发关节外病变,包括眼睛、胃肠道、心血管系统、呼吸系统和神经系统的损伤,严重影响患者的生活质量,给家庭和社会造成巨大负担[3-5]。目前,口服非甾体类抗炎药、改善疾病的抗风湿药物和生物制剂等药物的治疗目的主要是改善临床症状,降低疾病活动度,能否延缓病情进展还存在争议,并且长期应用这些药物存在心血管、胃肠道和肾脏系统的不良反应,增加罹患感染、肿瘤的风险[6]。因此,寻求更有效的AS防治药物是目前研究的主要领域之一。
鉴于AS复杂且尚未明确的发病机制,天然药物的多靶向作用特点为开发新药提供了基础。淫羊藿具有坚筋骨而祛风湿之功效,禀性辛温,辛以润肾,甘温可补阳益精,《日华子》言其“益肾壮阳,并能通行经络”,淫羊藿可通气行血、缓解痹痛,研究发现其有效活性成分对机体主要的免疫器官胸腺和脾脏具有重要的调节作用,通过巨噬细胞、NK细胞等免疫细胞影响特异性和非特异性免疫,通过白细胞介素(interleukin, IL)-2、IL-3、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α等细胞因子发挥免疫调节作用[7],是目前治疗AS常用中药之一。淫羊藿苷(icariin, ICA)是淫羊藿中分离得到的一种黄酮类化合物,被认为是其主要活性成分[8],现代药理学研究发现,淫羊藿苷对包括神经系统、生殖系统和骨骼系统在内的多个系统具有强大的生物学效应[9-11],可以通过调节核因子κB受体活化因子配体(receptor activator of nuclear factor kappa-B ligand, RANKL)/骨保护素(osteoprotegerin, OPG)信号通路调控成骨细胞增殖和分化,可预防软骨退变,促进软骨修复,调节骨代谢[12],但ICA在AS中的作用机制尚需进一步明确。
网络药理学是结合经典药理学、系统生物学、计算机技术、生物信息学等学科,从分子-细胞-器官等多个层面系统研究药物与治疗靶点相互作用的综合方法[13-14]。该方法已被广泛应用于中药药理机制和安全性的研究,对研究和开发当代中药多组分、多靶点、多通路的功能具有重要意义[15-16]。本研究通过网络药理学分析方法,利用多个数据库筛选ICA的潜在药物靶点和AS的疾病靶点,从而预测ICA治疗AS的靶点和途径,并根据这些靶点之间的拓扑相互作用确定关键基因。随后通过分子对接、体外实验验证并确定ICA干预AS的潜在作用靶点。
1 材料与方法
1.1 网络药理学预测
1.1.1 数据库 研究中应用的数据库见表1。
表1 用于靶点筛选及可视化的数据库
1.1.2 ICA相关靶点筛选 使用TCMSP数据库确定ICA的口服生物利用度(oral bioavailability, OB)[17]和类药性(drug-likeness, DL)[18]分别为41.58%和0.61。从PubChem数据库中获取ICA的2D/3D结构用于后续靶点预测,见表2。使用Pharmmapper和SwissTargetPrediction数据库预测靶点,对两个数据库中的靶点进行合并、去重,将结果导入Uniprot数据库进行蛋白质靶点标准化处理。
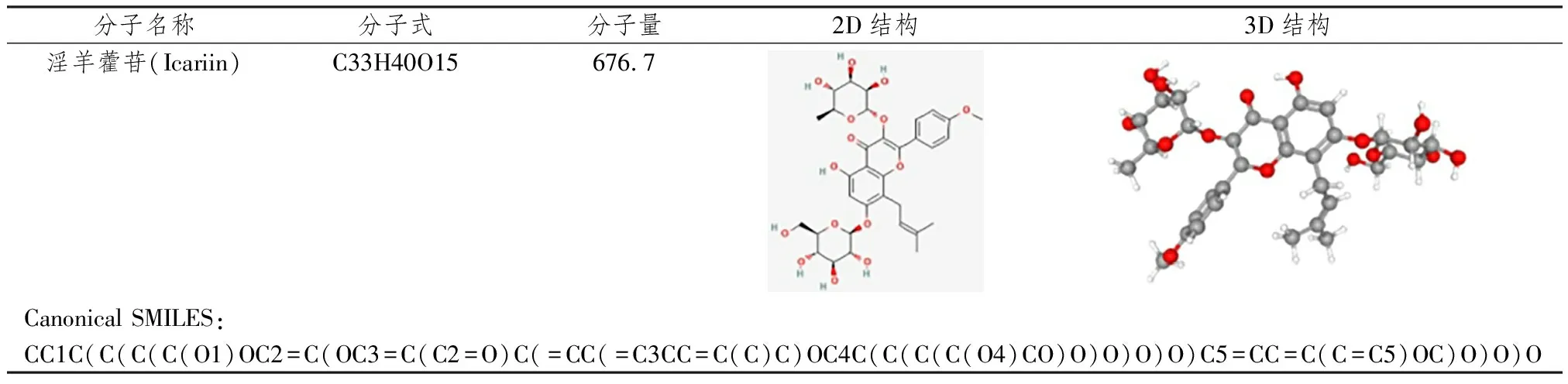
表2 淫羊藿苷基本信息
1.1.3 AS相关基因靶点预测 使用OMMI、DrugBank、GeneCards、Therapeutic Target Database、DisGeNET等5个数据库进行AS基因检索,检索关键词为“Ankylosing Spondylitis”。对结果进行合并、去重后导入 UniProt数据库进行蛋白质靶点标准化处理。
1.1.4 ICA-AS关键基因及蛋白质互作(protein protein interaction, PPI)网络构建 取ICA和AS的预测靶点交集,使用venny 2.1.0在线工具绘制维恩图。将交集靶点导入STRING数据库,设置类型为“Homo sapiens”,“最高置信度(0.900)”为最小交互分数,其他所有参数默认,将得到的结果导入Cytoscape 3.9.1中,生成ICA-AS的可视化PPI网络图。
1.1.5 ICA-AS关键基因的生物信息学分析 将ICA-AS关键基因导入metscape数据库,进行基因本体论(gene ontology, GO)及京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)富集分析,类型选择“Homo sapiens”。使用生物信息学网络工具(http://bioinformatic.com.cn/),对富集结果创建可视化气泡图。
1.2 分子对接
PDB格式的ICA结构从PubChem数据库中获取,关键靶蛋白结构从PDB数据库中获取,以靶蛋白为受体,ICA为配体,通过AutoDock Tools 1.5.6软件,将蛋白质晶体结构去除水分子,插入氢原子,计算电荷,确定分子对接的活性位点[19]。使用Autodock Vina软件对ICA-AS的关键靶点进行分子对接[20],对接评分用于评估ICA与主要靶点的结合亲和力。使用PyMOL 2.2.0软件实现对接结构的可视化,将蛋白渲染成条带,更改配体颜色,设置显示氢键和周围氨基酸,从而优化对接蛋白结构。
1.3 体外实验验证
1.3.1 样本来源 招募就诊于广安门医院风湿病科门诊的活动期患者15名,诊断标准参照1984年修订的纽约标准[21],且Bath强直性脊柱炎疾病活动性指数(bath ankylosing spondylitis disease activity index, BASDAI)≥4。同时于广安门医院体检中心招募性别、年龄相匹配的健康志愿者15名,见表3。本研究获中国中医科学院广安门医院伦理委员会批准(编号:2018-033-SQ)。
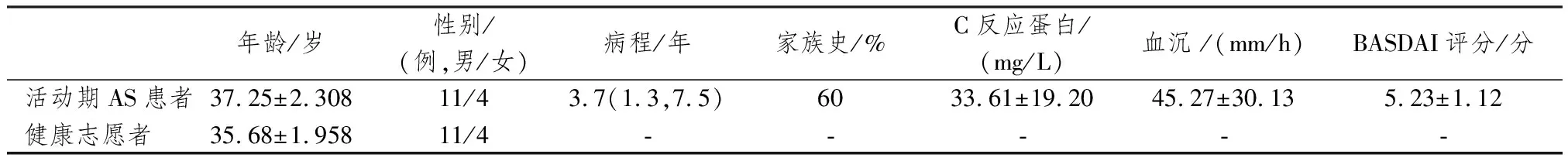
表3 受试者基本临床特征(n=15)
1.3.2 实验试剂 ICA(货号:110737-201516),中国食品药品检定研究院;兔抗人RORc(货号:SAB2102985),美国Sigma公司;兔抗人JAK2、磷酸化JAK2(phosphorylated-JAK2,p-JAK2)、磷酸化STAT3(phosphorylated-STAT3, p-STAT3),货号:ab108596、ab12301、ab76315,英国Abcam公司;鼠抗人STAT3(货号:ab68153),英国Abcam公司;全蛋白提取试剂盒(货号:KGP2100),中国凯基生物科技有限公司;增强化学发光(enhanced chemi luminescence, ECL)发光液(货号:WBKLS0500), 美国MILLIPORE公司;组织细胞RNA提取试剂盒(货号:cw0560s),二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(货号:cw0014s),中国康为世纪生物科技有限公司;High-Capacity cDNA 反转录试剂盒(货号:4374966),美国Applied Biosystems公司。
1.3.3 分离外周血单个核细胞 全部受试者于清晨、空腹取坐位采集肘窝静脉血4 mL,使用乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)抗凝管收集血液样本,于4 ℃静置存放,在2 h内完成外周血单个核细胞(peripheral blood mononuclear cell, PBMC)的分离。将4 mL血液与等量磷酸盐缓冲液(phosphate buffered saline, PBS)混匀,取一支15 mL 无菌无酶的离心管加入4 mL恢复至室温的人外周血淋巴细胞分离液;用1 mL移液器小心、缓慢地将血液加入离心管中。离心后吸取中间呈云雾状的PBMC层,加入等量的PBS缓冲液,离心5 min清洗细胞3次,此时底层白色沉淀即PBMC。
1.3.4 细胞培养 将制备好的PBMC悬浮液接种于细胞密度为2×106个细胞/mL的6孔细胞培养板中(1孔为健康对照组PBMC, 4孔为活动期AS患者PBMC),每孔2 mL,在含5%二氧化碳的培养箱中37 ℃孵育24 h。24 h后,将低剂量(L组)、中剂量(M组)和高剂量(H组)的ICA分别加入3例AS患者的PBMC孔中,溶液最终浓度分别为12.5 μg/mL、25 μg/mL和50 μg/mL,以健康对照组(Con组)和剩余活动期AS患者(AS组)的PBMC孔为空白对照组。在含5%二氧化碳的37 ℃培养箱中继续培养24 h。将各浓度组和对照组的细胞液收集在离心管中,离心5 min收集细胞沉淀物。
1.3.5 Western blot 检测 配制裂解缓冲液用于提取细胞全蛋白,使用BCA法测定蛋白浓度。使用十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE)凝胶电泳分离并将等量的总蛋白转移至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)膜上,在37 ℃下采用5%脱脂奶粉进行膜封闭处理2 h,加入1:1 000稀释后的一抗RORc、JAK2、pJAK2、pSTAT3、STAT3,在4 ℃下孵育过夜。取出PVDF膜用含Tween-20的Tris缓冲液(TBS with Tween-20, TBST)清洗3次,加入稀释后的二抗在室温下孵育2 h。将膜正面接触配制好的ECL发光液进行显影。
1.3.6 实时定量PCR检测 使用超纯RNA提取试剂盒提取总RNA,在1%琼脂糖凝胶上分离,使用Applied Biosystems TM 7500快速实时PCR系统(carlsbad, CA)进行定量mRNA的表达。配置反应体系,扩增40个循环,95 ℃扩增15 s,60 ℃扩增1 min,60 ℃扩增15 s。以GAPDH作为内参基因,采用2-△△ct法定量检测RORc mRNA的相对表达量。引物序列如下表4所示。
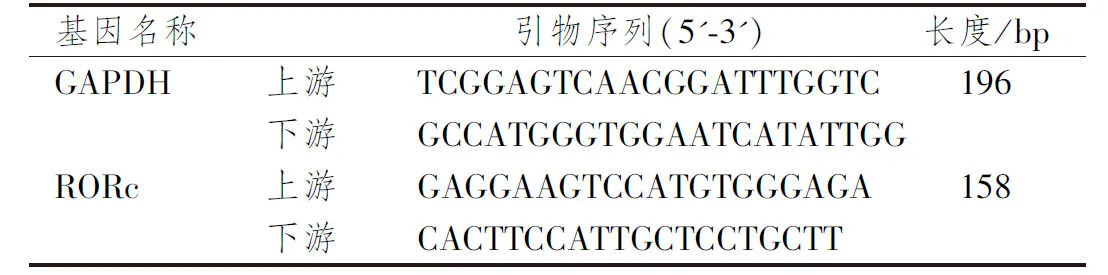
表4 PCR引物序列
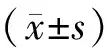
2 结果
2.1 ICA-AS相关靶点筛选
合并和删除SwissTarget Prediction与Pharmmapper数据库中的重复项后,发现了364个ICA作用靶点。同时,通过OMMI、DrugBank、GeneCards、DisGeNET、Therapeutic Target Database等数据库共检索到AS相关靶点2 641个。使用Venny2.1.0的分析工具,共发现了109个ICA-AS交集靶点,见图1。
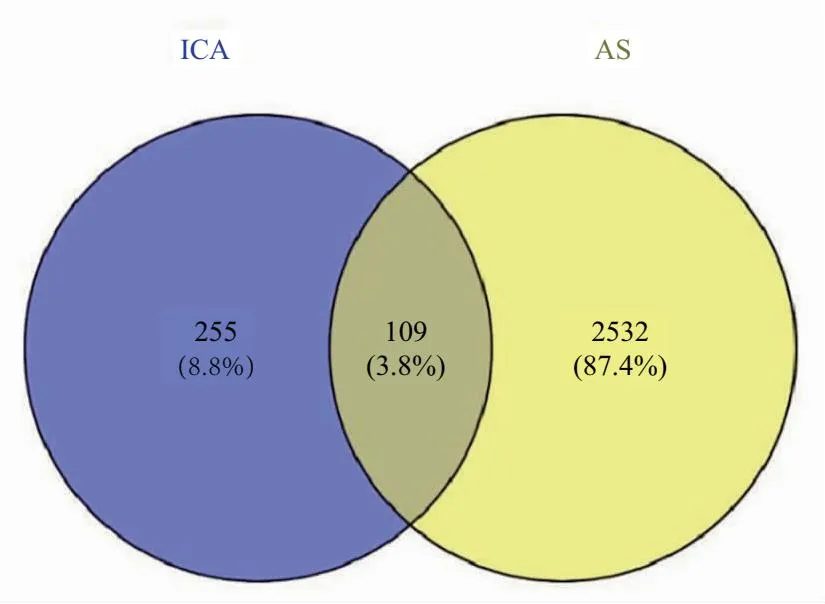
图1 淫羊藿苷(ICA)与强直性脊柱炎(AS)病理交集靶点的维恩图
A.共69个节点161条边的PPI网络;B.7个节点14条边的核心网络
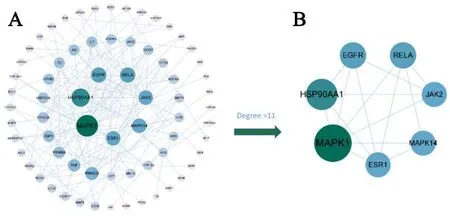
A.分子功能;B.生物过程;C.细胞组成注:仅列出按P值(P<0.01)排序的前20个条目及相应的计数值;气泡的大小表示该条目上富集的目标数量,颜色表示P值
2.2 PPI互作网络分析
PPI分析表明,网络内部有161条连线和69个节点,见图2A。节点的大小和色调由自由度(degree)值决定。节点网络越密集,色调越暗,表示目标越重要。其中MAPK1、HSP90AA1、EGFR、RELA、JAK2、ESR1、MAPK14是网络中最重要的靶点,见表5,利用这些靶点构建一个新的网络,如图2B所示。
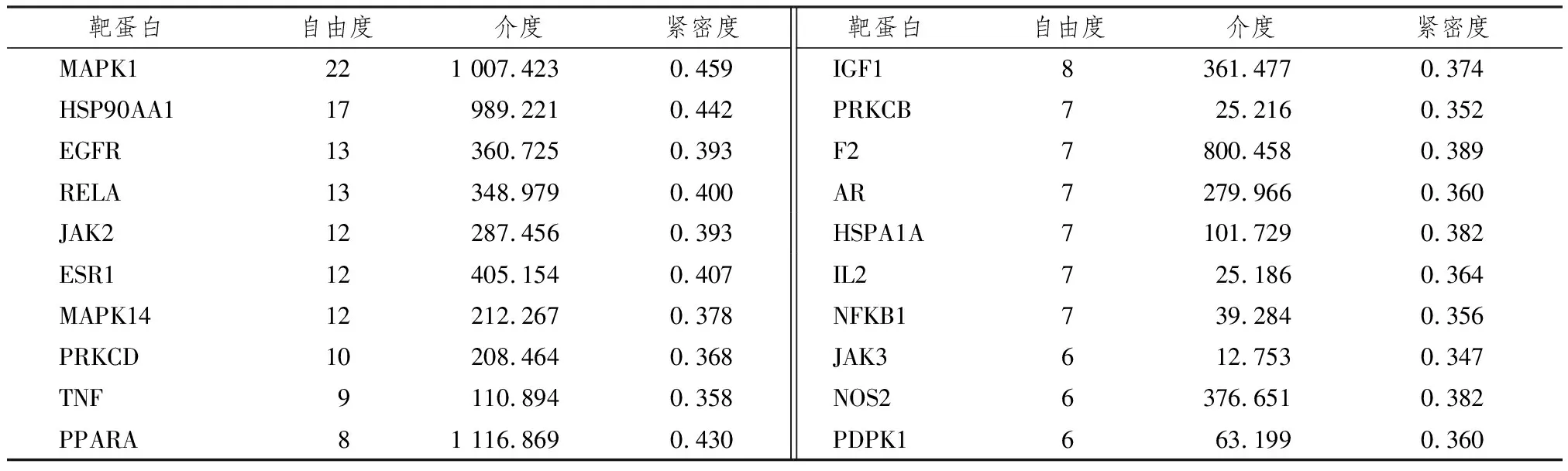
表5 ICA治疗AS的关键靶点拓扑信息分析
2.3 潜在靶点的GO及KEGG功能注释分析
GO富集分析包括生物过程、细胞成分和分子功能3个分项。这109个ICA-AS关键靶点涉及1 286个生物过程、67个细胞成分和125个分子功能。分别取前20个结果形成可视化气泡图,见图3。结果显示,最显著的生物学过程包括omega-羟化酶P450途径、正调控血小板活化、白细胞聚集、负调控急性炎症反应、STAT蛋白酪氨酸磷酸化等。最重要的细胞成分主要包括富含纤维蛋白-1的颗粒、管腔和内溶酶体。在分子功能方面,其最重要的分子功能包括腺嘌呤核苷三磷酸(a denosine triphosphate, ATP)依赖性蛋白解聚酶活性和C3HC4型环指结构域结合等。此外,还发现了164条富集的KEGG通路,按P-value 值从小到大排列,取前 20 条通路制作富集气泡图,见图4,这些通路主要涉及前列腺癌、IL-17信号通路、血管内皮生长因子(vascular endothelial growth factor, VEGF)信号通路等。
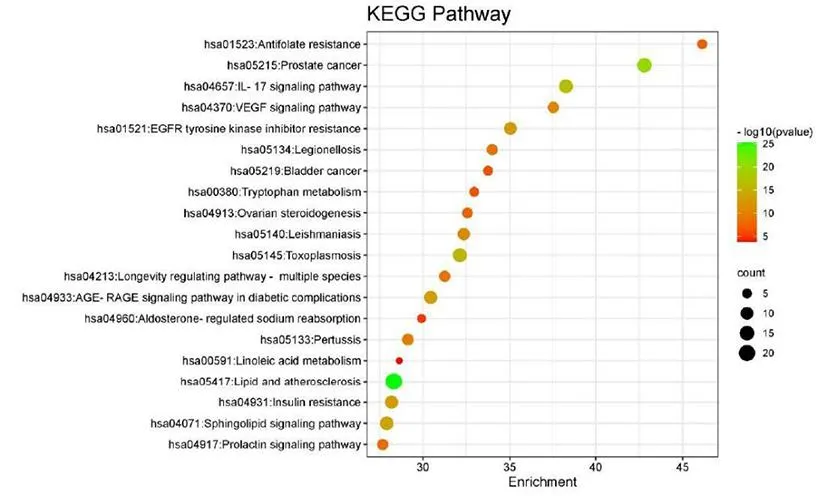
注:仅列出按P值(P<0.01)排序的前20个条目及相应的计数值;气泡的大小表示该条目上富集的目标数量,颜色表示P值
2.4 ICA-AS关键基因-通路网络分析
在164条KEGG富集通路中,富集指数平均值为16.998,取富集指数>16.988的前66条通路作进一步分析,发现其中共包含72个活性靶点。对该通路-靶点网络作进一步分析并使用Cytoscape 3.9.1作出药物-疾病-通路-靶点网络图,见图5。节点面积大小代表Degree值,面积越大,则表示该节点在网络中影响力越大。节点之间的连线表示ICA可能作用于AS的靶点与通路之间的关系,连线越紧密表示该靶点越有可能是药物干预疾病的有效靶点。由图可知在此网络中最重要的网络调控靶点是MAPK1、RELA、NFKB1、MAPK14、TNF、PRKCB等。
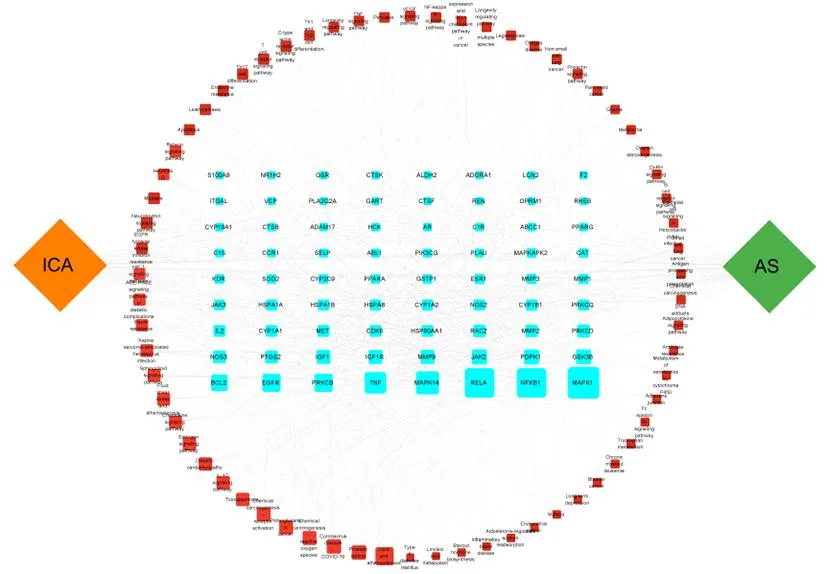
注:蓝色长方形文本框代表核心靶点,红色方形文本框表示富集通路,节点的面积表示Degree值的大小
2.5 分子对接验证
用最低结合能来表示来评价ICA与靶蛋白结合能力,当结合能<-4.25 kcal/mol时,可认为二者存在结合活性,结合能<-5.0 kcal/mol表明结合活性好[22],结合能<-7.0 kcal/mol表明结合活性高[23-24]。如表6所示,计算结果表明,20个基因中有18个满足亲和性<-7 kcal/mol的标准,结合模式见图6。分子对接数据的一致性进一步强调了网络药理学预测主要靶点的可靠性。
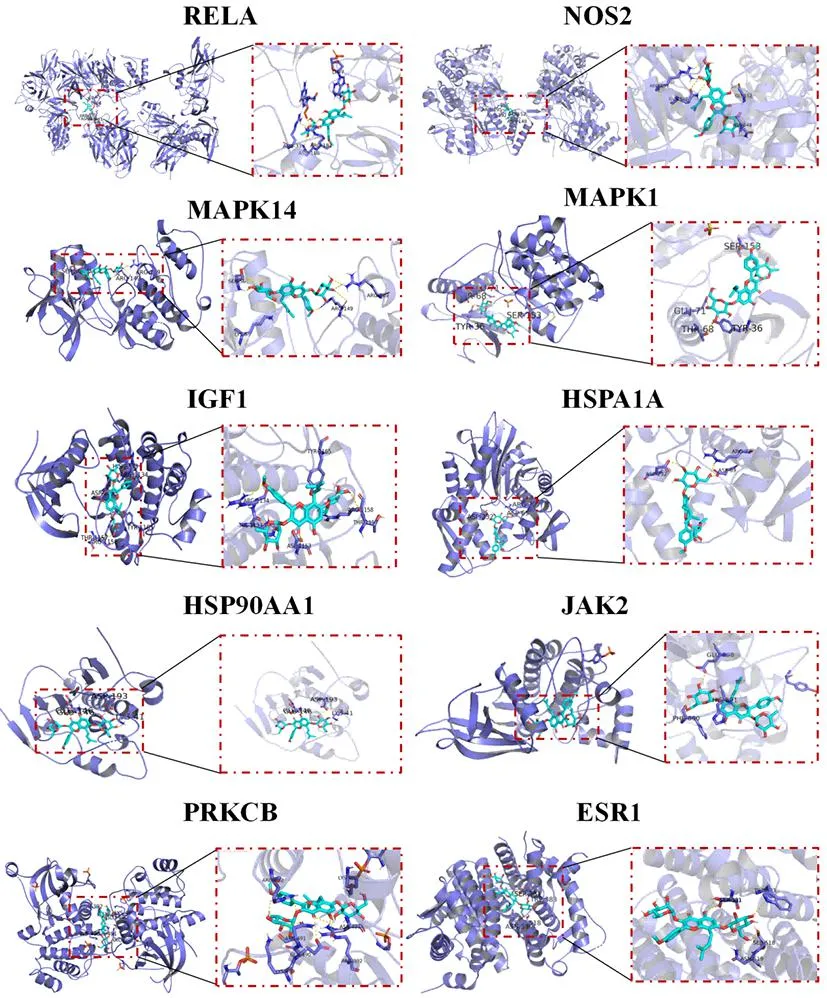
注:淫羊藿苷(ICA)是蓝色的棒状模型,蛋白质分子是紫色的模型,连接的氢键用黄色虚线表示,蓝色和红色的气泡表示金属离子
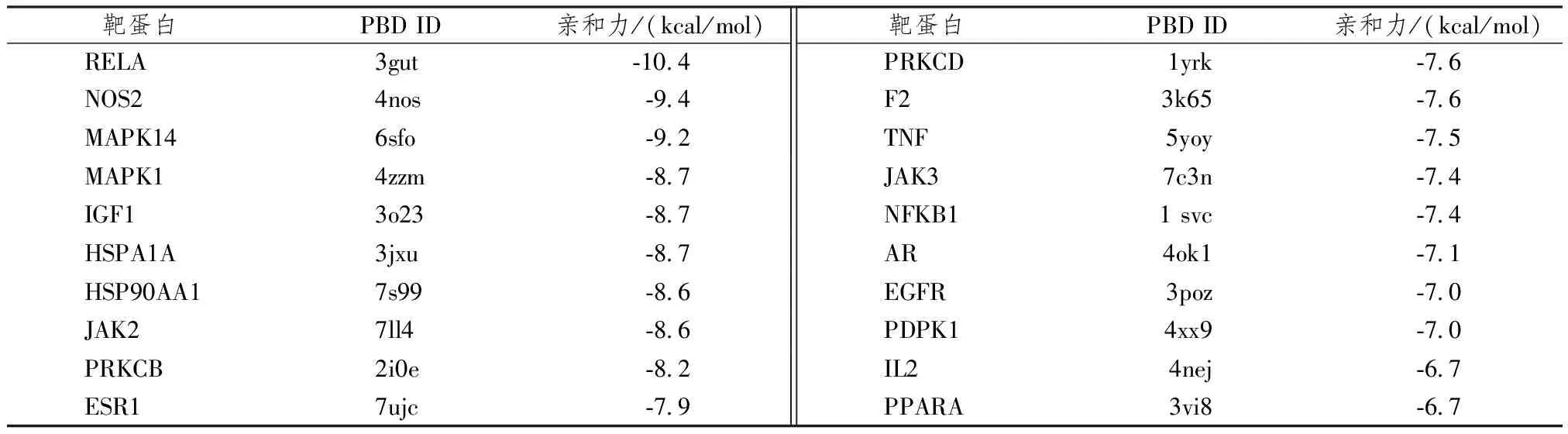
表6 淫羊藿苷与核心靶分子对接最低结合能
2.6 不同浓度ICA对AS-PBMC中JAK2/STAT3通路相关蛋白的影响
如图7所示,各组间比较,JAK2和STAT3水平差异均无统计学意义,与健康对照组比较,活动期AS患者pJAK2和pSTAT3水平明显升高(P<0.05),经ICA干预后,pJAK2和pSTAT3水平显著降低(P<0.05),提示随着ICA浓度的增加,ICA对JAK2和STAT3的磷酸化水平具有显著抑制作用。
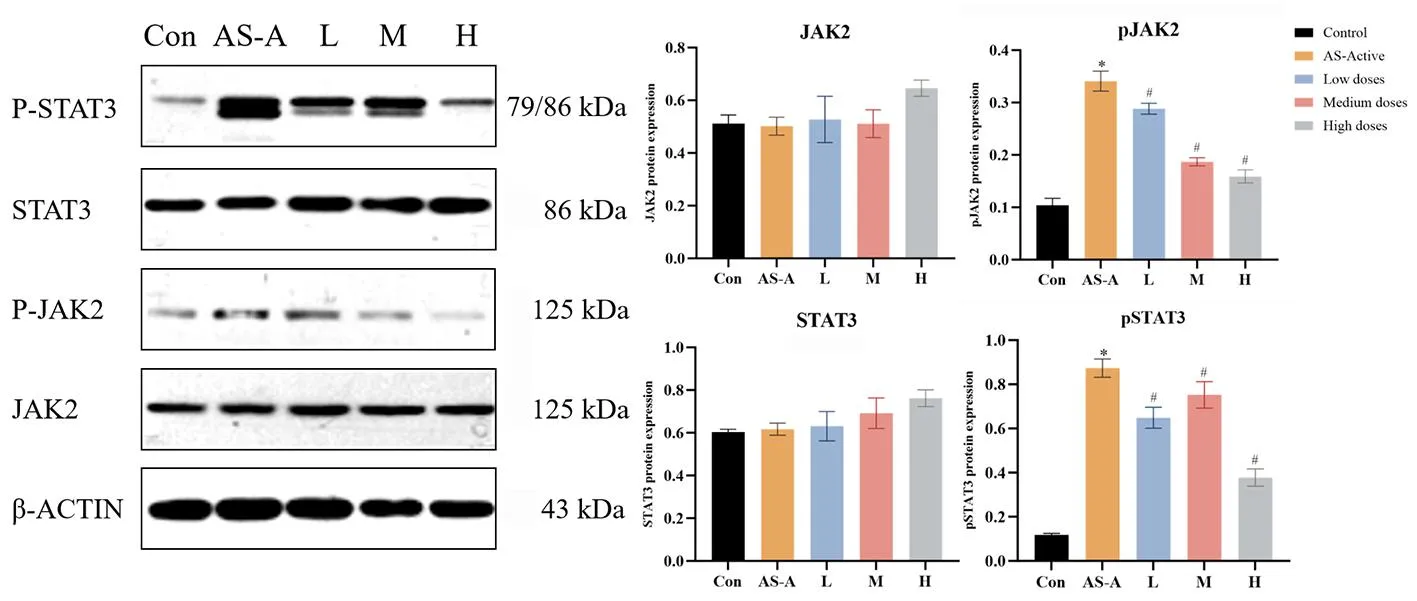
注:与Con组比较*P<0.05;与AS-A组比较#P<0.05;Con.健康对照组;AS-A.活动期AS组;L.ICA低剂量组;M.ICA中剂量组;H.ICA高剂量组;信号转导与转录激活子3(STAT3),磷酸化STAT3(pSTAT3),蛋白酪氨酸激酶2(JAK2),磷酸化JAK2(pJAK2)
2.7 不同浓度ICA对AS-PBMC中RORγt蛋白及RORc mRNA的影响
与健康对照组比较,活动期AS患者的PBMC中特异性转录因子RORc γt蛋白和RORc mRNA表达量显著增加(P<0.05),见图8。经ICA干预后,可以下调RORγt蛋白和RORc mRNA的表达(P<0.05)。
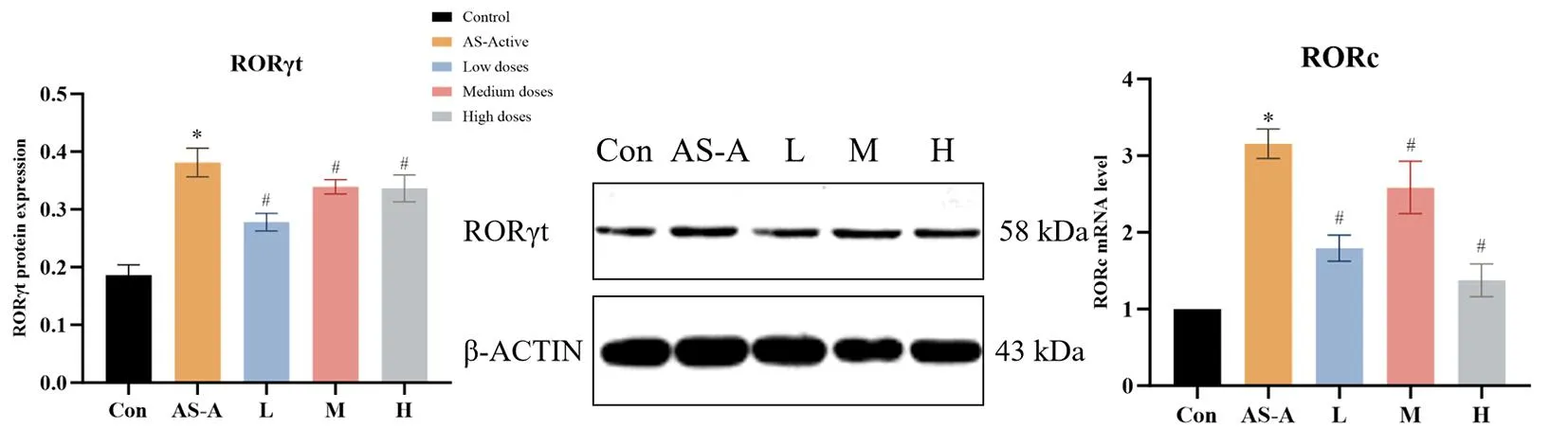
与Con组比较*P<0.05;与AS-A组比较#P<0.05;注:Con.健康对照组;AS-A.活动期AS组;L.ICA低剂量组;M.ICA中剂量组;H.ICA高剂量组;维甲酸相关孤儿核受体蛋白γt(RORγt),RORγt编码基因(RORc)
3 讨论
中医古籍中并无关于AS的病名记载,根据其临床表现一般将AS归属于“大偻”“脊痹”“肾痹”等病。正如《素问·脉要精微论篇》中形容“腰者,肾之府,转摇不能,肾将惫矣”。与AS下腰背部疼痛、晨僵、活动受限的临床表现极为相似,并指出AS病位在肾。肾为先天之本,藏精主骨生髓,肾中所藏之精为来自父母生殖之精的遗传物质,作为行使一切生命活动的基本物质,调控着其他脏腑的阴阳盛衰,具有与DNA相似的遗传特性。AS作为一种具有高度遗传特征的自身免疫病,先天携带的易感基因如人白细胞抗原 (human leukocyte antigen, HLA) B27、TNF-α等,在发病中起到了重要作用[25],而先天禀赋不足、肾精亏虚者由于生命遗传信息的异常传递易导致本病发生,因此肾藏象功能失常是AS发病的重要因素之一。30岁左右的青壮年男性本应筋强骨壮,肌肉隆盛,本病反而好发于这类人群,表明先天不足、后天调护不当损伤肾中精气是AS发病之本,治疗上多以补肾壮督为基本治法[26],淫羊藿作为补肾阳、强筋骨、祛风湿之要药,临床多用于AS的治疗中。
在目前针对骨质疏松和骨关节病的治疗中,研究发现淫羊藿苷不仅能促进软骨分化和成骨细胞的形成,并通过控制OPG与RANKL的表达比例,抑制破骨细胞的产生,从而达到减少骨质流失、促进软骨修复的作用[12]。然而,与类风湿关节炎、骨关节病不同的是,AS是一种以炎症、骨破坏和新骨形成为特征的自身免疫性疾病,在关节发生骨破坏的同时伴有异位成骨的现象,淫羊藿苷对于抑制AS炎症及异位骨化的作用机制尚不明确。临床研究已证明以淫羊藿为主要药物的中医药治疗AS方案具有较好的临床优势,进一步探索中药单体淫羊藿苷干预AS的机制对于新药开发具有重要意义。本研究采用网络药理学分析预测ICA治疗AS的潜在靶点,从多个数据库中获得了109个ICA 抗AS的潜在靶点基因,其中MAPK1、HSP90AA1、EGFR、RELA、JAK2、ESR1、MAPK14、PRKCD、TNF、PPARA、IGF1、PRKCB、F2、AR、HSPA1A、IL2、NFKB1、JAK3、NOS2、PDPK1可能是ICA调控AS的核心基因。核心靶点的GO和KEGG富集分析表明,这些基因可能参与了AS炎症的发生,ICA可能通过多靶点和途径调节AS的生物学过程。分子对接进一步确定了ICA与RELA、NOS2、MAPK14、MAPK1、IGF1、HSPA1A、HSP90AA1、JAK2、PRKCB等基因的结合能<-8 kcal/mol,证实了ICA与这些靶因子具有高结合潜力。
RELA属于转录因子核因子 (nuclear factor,NF) -κB家族复合体,在炎症和免疫反应中起着至关重要的作用。除了骶髂关节或脊柱损伤外,AS患者还经常报告肺功能受损,这与NF-κB信号通路、氧化标记物和炎症因子有关[27]。促丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路对于炎症细胞的激活至关重要,炎症细胞的激活是由丝裂原活化蛋白激酶激酶 (mitogen-activated protein kinase kinases, MKKs)、丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)和MAPK的连续磷酸化触发的[28]。在哺乳动物细胞中,有3种不同的MAPK通路,包括p38 MAPK (MAPK14)通路,在本研究发现的ICA-AS前9个关键基因中,MAPK1和MAPK14等与MAPK通路密切相关。胰岛素样生长因子(insulin-like growth factor , IGF)-1也在AS的发病中发挥了重要作用,成骨细胞在骨吸收过程中产生IGF-1并促进新骨形成[29],IGF-1与成骨细胞表面受体结合,刺激胶原合成,抑制破骨细胞胶原酶的产生,IGF-1使成骨细胞和骨基质酸化,从而促进骨矿化[30],同时IGF-1还抑制成骨细胞凋亡[31],进而调控了骨吸收和骨生长之间的平衡。热休克蛋白(heat shock protein, HSP) 90家族是一种高度保守的分子伴侣[32],由HSP90、HSP90、葡萄糖调节蛋白 (gloucose requlated protein , GRP) 94和肿瘤坏死因子受体相关蛋白(TNF receptor-associated protein , TRAP) 1亚型组成。它参与多种生物过程,包括病毒感染、免疫控制和信号转导[33]。HSP90是增强JAK和kappa B 抑制因子激酶(inhibitor of kappa B kinase, IKK)活性所必需的,这促进了STAT和NF-κB的激活和核易位,以发挥其在炎症发生中的作用[34]。
炎症是AS发生发展的初始和重要环节,炎症可诱导脊柱和骶髂关节发生骨破坏和新骨形成[35]。Harrington等人发现辅助性T细胞(T helper cell , Th) 17在AS的发病中发挥了重要作用,其分泌的IL-17是一种参与宿主防御并诱导中性粒细胞诱导和成熟的细胞因子[36]。IL-17的分泌是由JAK2/STAT3信号通路介导的[37]。JAK2和STAT3是JAK2/STAT3信号通路中的两个重要因子,其中STAT3不仅直接介导IL-17的分泌,还能促进人类Th17细胞特异性转录因子RORγt的表达,对Th17的分化具有重要意义[38]。有研究表明,在类风湿关节炎小鼠模型中,ICA可抑制STAT3激活介导的Th17细胞分泌IL-17细胞因子,抑制炎症和关节破坏[39],但尚无针对ICA抗AS炎症的相关研究,因此,影响IL-17分泌的重要途径JAK2/STAT3信号通路可能为探索ICA干预AS分子机制的切入点。JAK2和STAT3是该通路的关键因子,STAT3蛋白通过JAK2/STAT3信号通路被磷酸化[40],进而结合IL-17启动子区,促进IL-17分泌。同时,Th17分化关键转录因子RORc也受到STAT3的显著影响,STAT3可直接结合RORc启动子区域,促进Th17分化,间接促进IL-17的分泌[41-42]。STAT3的功能通过JAK2的磷酸化激活,磷酸化的JAK2可以磷酸化IL-23R的酪氨酸结合位点,从而形成STAT3的结合区,磷酸化的STAT3与结合区分离后,同源的STAT3被二聚化并转移到细胞核中发挥功能[43]。本研究结果表明,活动期AS患者的PBMCs具有较高的JAK2和STAT3磷酸化水平。经不同浓度ICA干预后,JAK2和STAT3的磷酸化水平及RORc mRNA表达均显著降低,且随着ICA剂量的增加,其对JAK2和STAT3磷酸化水平的抑制作用更为明显,表明ICA可能通过对JAK2/STAT3信号通路的抑制从而抑制转录因子RORγt对Th17分化的影响,发挥了抗AS炎症的作用。
综上,结合网络药理学、分子对接和体外实验,本研究发现ICA可通过RELA、NOS2、MAPK14、MAPK1、IGF1、HSPA1A、HSP90AA1、JAK2等关键靶点和JAK2/STAT3等IL17关键信号通路抑制AS炎症,其作用可能是通过核心靶点和通路的多重协同作用实现的。

