山茱萸多糖提取工艺优化及结构表征
肖付才 李颖奎 黄 斐 谷俊华
山茱萸(CornusofficinalisSieb.et Zucc.)被广泛种植于河南、浙江、山西、安徽、湖南和湖北等地[1]。先前的报道发现山茱萸果实中富含多酚、多糖、类黄酮、皂苷、各种维生素和矿物质等活性成分[2]。大量研究[3]表明,山茱萸多糖可抑制炎症因子的表达和肿瘤细胞的生长、清除过量自由基和调节免疫相关的因子等功效。因此,山茱萸多糖具有较好的应用和开发前景。高效获得山茱萸多糖是至关重要的。
目前,热水提取法(hot water extraction,HWE)是天然多糖提取的主要方式。HWE具有提取成本低和便于工业化生产等优点,但该方式存在提取效率低和耗时长等缺点,这限制其在天然多糖提取中的应用[4]。微波辅助提取(microwave assisted extraction,MAE)是依据微波特殊的加热方式使得提取液温度快速升高,微波辐射破裂植物细胞壁,提高目标成分得率[5-6]。孔媛芳等[7]采用MAE法提取地黄多糖。结果发现,与HWE法的多糖得率相比,MAE法获得多糖得率提高了5倍。Thirugnanasambandham等[8]通过MAE法提取桑叶中的多糖,并利用响应面优化提取工艺。结果表明,当样品重量、微波功率和提取时间分别为20 g、170 W和10 min时,多糖得率获得最大值(9.41%)。相较于HWE法,MAE法提取效率显著提升和提取时间显著缩短。汤慧民等[9]利用MAE法提取核桃壳多糖并评价其抗氧化活性。结果表明,MAE法获得的多糖得率(2.24%)显著高于HWE法(1.06%),且MAE法获得的多糖对自由基的清除能力也显著优于HWE法的。超声辅助提取(ultrasonic-assisted extraction,UAE)作为一种新颖的非热加工技术,是利用“空化效应”加速植物细胞壁的破裂,提高目标成分得率,但在提取过程中,超声的“空化效应”可能会破坏多糖中的糖苷键,进而降低多糖得率,这限制了UAE法在天然多糖提取领域中的应用[10]。酶法辅助提取(enzymatic assisted extraction,EAE)是利用酶的高效性和专一性水解植物细胞壁,加速植物细胞壁的降解和提高目标成分的得率[10-11]。目前,越来越多的学者利用EAE技术从天然资源中提取天然多糖。赵惠茹等[12]利用EAE法从刺玫果中提取多糖,优化多糖提取工艺并评价其抗氧化活性。结果表明,当酶添加量、酶处理时间和料液比分别为1.37%、71 min和1∶30 (g/mL)时,多糖得率最大(16.38%),其多糖对自由基清除有较好的效果。孔璐等[13]采用果胶酶辅助提取法从蓝莓中提取多糖并评价其抗氧化活性。结果表明,果胶酶辅助提取法所得的多糖得率(2.72%)显著高于HWE法的(1.35%),且MAE法获得的多糖的抗氧化活性显著优于HWE法的。刘军波等[14]采用EAE法从荷叶中提取多糖。结果表明,EAE法提取获得的多糖的得率(9.66 g/100 g)显著高于传统的HWE法(4.12 g/100 g)。但以上多糖的提取方式均采用单一的提取溶剂,所得粗多糖包含大量杂质,后续纯化过程繁琐和成本高。
近年来,双水相提取(aqueous two-phase extraction,ATPE)技术作为一种绿色高效的提取技术被广泛应用于多糖的提取。ATPE技术具有提取成本低、纯度高、便于连续化提取目标成分等优点[15]。目前,利用ATPE法从天然资源中提取活性成分的研究备受关注。Niphadkar等[16]通过ATPE法从马铃薯皮中提取多酚氧化酶,并采用响应面法优化其提取工艺。结果表明,最优的ATPE工艺为:聚乙二醇17.62%、磷酸钾缓冲液15.11%、NaCl浓度2.08 mmol/L和pH 7,在此条件下,多酚氧化酶最大分配系数、纯化因子和得率分别为3.7、4.5和77.8%。Gao等[17]利用ATPE法提取油茶多糖,并利用柱色谱技术进一步纯化多糖。结果表明,经ATPE法提取得到的油茶多糖纯度显著高于传统的HWE和UAE法,进一步证实ATPE法可一步完成提取和样品的初步纯化。Ji等[18]采用ATPE法从银耳中提取总黄酮,并通过响应面法优化其提取工艺。结果表明,ATPE银耳总黄酮的最优工艺参数为乙醇质量分数23%、NaH2PO4质量分数27.18%、萃取时间8.25 min。该条件下,总黄酮的最大提取率为0.158 mg/g。微波提取与双水相提取相结合形成一种新的提取方式,即微波辅助双水相提取法(microwave assisted aqueous two-phase extraction,MATPE),既能充分发挥微波快速、高效提取的优势,又可以获得高纯度的多糖,这可有效避免后续多糖除蛋白和色素的操作[19-20]。目前,关于利用MATPE技术从山茱萸中提取多糖的研究尚未见报道。此外,针对MATPE技术所得的山茱萸多糖粗提物的纯化也鲜见报道。
研究拟采用MATPE法提取山茱萸多糖,探究4个试验因素对山茱萸多糖得率的影响;通过柱层析法纯化山茱萸多糖粗提物,并鉴定纯化后的多糖馏分结构,以期为山茱萸的深度开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
山茱萸:市售;
DEAE-52纤维素和Sephadex G-100:上海浦予工业科技有限公司;
半乳糖、阿拉伯糖、木糖、甘露糖和葡萄糖:纯度≥99%,天津佰玛科技有限公司;
氯化钠、氢氧化钠、硫酸铵、苯酚和浓硫酸:分析纯,天津金东天正精细化学试剂有限公司。
1.2 仪器与设备
台式扫描电镜:SNE-3200M型,深圳市武训科技有限公司;
微波辅助提取仪:AL-IMC1型,北京一叶蓝天科技有限公司;
气相色谱:GC7600型,深圳埃科瑞仪器设备有限公司;
高效液相色谱仪:ROHS2.0型,苏州博讯仪器有限公司;
紫外分光光度计:HT-5873型,青岛海特尔环保科技有限公司;
真空冷冻干燥机:FXH-3100型,山东泰武机械设备有限公司;
高速离心机:AXTG16G型,无锡华卫德朗仪器有限公司;
傅里叶变换红外光谱仪:Hoffen-20型,天津市嘉鑫海机械设备有限公司;
植物粉碎机:DF-45A型,温岭市林大机械有限公司。
1.3 方法
1.3.1 样品前处理 将山茱萸果肉于50 ℃烘干至含水率<5%,粉碎,过40目筛子备用。
1.3.2 山茱萸多糖提取物制备 参照Li等[21]的方法。
1.3.3 山茱萸多糖得率测定 参照Ji等[22]的方法,按式(1)计算多糖得率。
(1)
式中:
Y——多糖得率,%;
m1——提取物质量,g;
m2——山茱萸粉末质量,g。
1.3.4 单因素试验 设定微波功率为100~500 W,间隔100 W;乙醇体积分数为35%~55%,间隔5%;硫酸铵质量分数为18%~26%,间隔2%;料液比为1∶10~1∶30 (g/mL),间隔1∶5 (g/mL)。
1.3.5 正交试验 通过单因素的结果,选取微波功率、乙醇体积分数和硫酸铵质量分数作为正交试验因素,以山茱萸多糖得率为指标,设计L9(33)设计正交试验。
1.3.6 山茱萸多糖的纯化 利用体积分数为80%的乙醇沉淀山茱萸粗多糖,收集沉淀,透析48 h,于-18 ℃预冻12 h,冻干回收样品,用去离子水复溶,8 000 r/min离心10 min,收集上清液。上清液以1.5 mL/min的流速加入DEAE-52纤维素柱(2.6 cm×70 cm)中,采用去离子水和不同浓度的NaCl(0.1,0.2,0.4,0.6,0.8 mol/L)溶液依次进行洗脱。分离后获得3个多糖馏分(COP-1、COP-2和COP-3),其中COP-2的多糖含量最高。通过Sephadex G-100层析柱(1.6 cm×50 cm)进一步纯化主要馏分COP-2。洗脱参数:加载质量浓度10 mg/mL,加载体积4 mL,流速0.4 mL/min。每管收集2 mL,冷冻干燥,获得均一的多糖馏分(COP-2-S)。
1.3.7 结构鉴定
(1) 紫外光谱:参照Li等[21]的方法。
(2) 单糖组成:参照Liang等[23]的方法。
(3) 分子量:将COP-2-S以1 mg/mL溶解至去离子水中,过0.45 μm滤膜,注入高效凝胶渗透色谱中,利用去离子水进行洗脱,随后测定其平均分子量(Mw)。
(4) 红外光谱:将COP-2-S与KBr按质量比1∶30混匀并压缩成切片进行红外光谱扫描,分析其红外吸收特性。
(5) 扫描电镜:参照Xue等[24]的方式。
1.3.8 数据处理 采用Origin 9.0软件作图;采用Statistics 8.0软件进行数据显著性分析。
2 结果与分析
2.1 单因素试验
由图1(a)可知,当微波功率为100~400 W时,微波功率与多糖得率呈正相关,主要是由于微波功率越大,温度升高越快,多糖溶解度越大。此外,高微波功率辐射易加速山茱萸细胞壁的破裂,降低多糖的扩散阻力,促进多糖扩散,进而提高多糖得率[25]。当微波功率>400 W时,过高的微波功率会破坏多糖中的糖苷键,降低多糖得率。这与Le等[26]采用MAE技术从海藻中提取多糖的结果一致。因此,选择微波功率范围为300~500 W。

字母不同表示差异显著(P<0.05)
由图1(b)可知,当乙醇体积分数<45%时,多糖得率随乙醇体积分数的增加而增加(P<0.05)。其原因是较高乙醇体积分数下,山茱萸细胞内多糖的扩散系数与溶解度较高,有助于多糖从细胞内扩散到溶剂中,进而使多糖得率升高[27]。当乙醇体积分数>45%时,多糖得率随乙醇体积分数的增加而降低,与Lin等[28]的结果一致。因此,选择乙醇体积分数范围为35%~45%。
由图1(c)可知,当硫酸铵质量分数<24%时,山茱萸多糖得率随硫酸铵质量分数增加而增加(P<0.05),当硫酸铵质量分数为24%时,山茱萸多糖得率达最大值(11.45±0.16)%。这是由于下相中硫酸铵质量分数越高,多糖溶解度越大,进而有助于提高多糖得率[21]。此外,在较高质量分数的硫酸铵溶液中,多糖具有较高的扩散系数,从而有利于多糖的提取。当硫酸铵质量分数为24%~26%时,多糖得率与硫酸铵质量分数呈负相关。其原因是下相中硫酸铵质量分数过高,会造成过多的杂质被溶解,降低多糖的溶解度[15]。这与Xue等[24]的结果一致。因此,选择硫酸铵质量分数范围为22%~26%。
由图1(d)可知,当料液比为1∶10~1∶20 (g/mL)时,山茱萸多糖得率随料液比的增加而增加(P<0.05);当料液比>1∶20 (g/mL)时,山茱萸多糖得率随料液比的增加无显著变化,与杨占群等[29]的结果一致。因此,选择料液比为1∶20 (g/mL)。
2.2 正交试验结果
山茱萸多糖经MATPE法提取的正交试验因素水平见表1,正交试验设计及结果见表2。由表2可知,各因素对山茱萸多糖得率影响的主次顺序为A>B>C,最优水平组合为A1B1C1,即微波功率300 W、乙醇体积分数35%和硫酸铵质量分数22%,在此条件下,测得山茱萸多糖得率为(12.04±0.17)%,进一步说明利用正交试验优化MATPE法提取山茱萸多糖工艺具有可行性,与任俊鹏等[30]的结果存在一定差异。其主要原因是由于试验利用MATPE法提取多糖,一些杂质(色素、寡糖和酯类)被提取到上相,而下相中得到纯度较高的多糖。因此,造成MATPE法提取所得多糖得率与超声辅助提取的存在一定差异,与Tan等[31]的结论相似。

表1 山茱萸多糖的L9(33)正交试验因素水平表

表2 山茱萸多糖的L9(33)正交试验设计及结果
2.3 山茱萸多糖纯化
由图2(a)可知,经硫酸—苯酚法测定COP-1、COP-2和COP-3得率分别为9.35%,13.68%,10.21%。由图2(b)可知,COP-2经Sephadex G-100柱层析法纯化后,获得单一的对称峰,命名为COP-2-S。

图2 DEAE-52纤维素柱层析纯化山茱萸多糖粗提物的洗脱曲线和Sephadex G-100柱层析纯化COP-2的洗脱曲线
2.4 单糖组成和分子量分析
由图3(a)可知,COP-2-S为单一对称峰,说明COP-2-S属于均一的多糖馏分。以平均分子量的对数为纵坐标,保留时间为横坐标,绘制回归方程为logMw=10.05-0.257TR,R2=0.999 6。

图3 COP-2-S分子量分布和单糖组成
COP-2-S的保留时间为8.6 min,依据回归方程计算COP-2-S的平均分子量为17 450 Da,低于Ji等[22]的结果。这种现象可能与山茱萸产地、品种、提取和纯化方式有关。由图3(b)可知,COP-2-S由阿拉伯糖、葡萄糖、半乳糖和未知单糖组成。由于试验条件限制,试验未对未知的单糖进行分析说明。阿拉伯糖、葡萄糖、半乳糖的物质的量比为 12.85∶30.71∶18.09,表明COP-2-S属于一种具有不同化学成分的杂多糖,其中葡萄糖为主要单糖。
2.5 紫外光谱和红外光谱分析

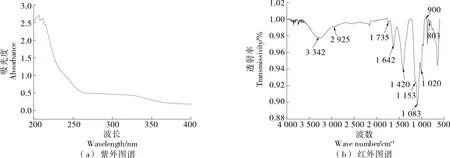
图4 COP-2-S紫外图谱和红外图谱
2.6 COP-2-S微观结构分析
由图5(a)可知,COP-2-S在200×下呈无规则的片状结构,1 000×下出现大小不均的孔和棒状结构,表面相对致密,说明COP-2-S经提取纯化后,多糖分子发生了相互聚集,使得结构更加致密。其主要原因是由于多糖作为极性分子,微波体加热使得多糖分子快速吸收微波能,加速分子聚集,进而使得多糖结构更致密[24]。

图5 COP-2-S的微观结构
3 结论
试验表明,微波辅助双水相提取山茱萸多糖的工艺为:微波功率300 W、乙醇体积分数35%、硫酸铵质量分数22%和料液比1∶20 (g/mL),此时山茱萸多糖得率为(12.04±0.17)%。此外,通过柱色谱技术纯化山茱萸粗多糖最终获得均一的多糖馏分(COP-2-S),分子量为17 450 Da。COP-2-S具有无规则的片状结构。后续需进一步深入研究COP-2-S结构及其生物活性,并阐明其构效关系。

