胰腺囊性肿瘤患者行胰体尾切除术后新发糖尿病预后因素的初步探讨*
李 源 张 利 李竟麟 修典荣 王行雁
(北京大学第三医院普通外科,北京 100191)
随着腹部CT和MR检查的普及,越来越多的胰腺囊性肿瘤得到诊断,这些囊性肿瘤主要包括导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)、黏液性囊腺瘤(mucinous cystic neoplasm,MCN)、浆液性囊腺瘤(serous cystic neoplasm,SCN)和实性假乳头状肿瘤(solid pseudopapillary tumor,SPT),腹腔镜胰体尾切除是治疗胰腺体尾囊性肿瘤的标准手术方式。一方面,由于这些囊性肿瘤多为良性或低度恶性,观察术后长期预后更重要;另一方面,囊性肿瘤如IPMN的手术指征需要综合考虑肿瘤学因素和术后胰腺功能,在决定手术时机时要把长期预后作为重要的考量因素。
胰腺手术后新发糖尿病(new-onset diabetes mellitus,NODM)指术前无糖尿病患者术后出现糖尿病,是胰体尾切除术后重要的远期不良预后。胰体尾切除患者术后NODM的发病风险尚不明确,不同研究报道的NODM发病风险差异较大,4%~73%,同时胰腺术后NODM的预后因素也不明确[1,2]。既往研究中胰腺术后NODM发病风险变异较大,主要与研究纳入的疾病种类、手术方式、生存或随访时间有关,特别是未能对慢性胰腺炎、胰腺癌和胰腺良性或低度恶性肿瘤进行独立研究。慢性胰腺炎患者胰腺切除术后发生糖尿病的比例高达70%以上,对正常胰腺行胰腺局部切除术后NOMD发病风险明显降低;胰腺癌引起的胰管梗阻和局部炎症对糖代谢也有影响,同时术后生存期较短,这些都对胰腺术后NODM的发生有重要影响。既往研究未能对胰体尾切除和胰十二指肠切除术切除加以区分,胰十二指肠切除术中进行胃大部切除并消化道重建,这些手术操作对术后糖代谢的变化有重要影响。本研究选择腹腔镜胰体尾切除的胰腺囊性肿瘤患者作为研究对象,对胰体尾切除术后NODM的发生情况进行探索性研究,旨在为此类疾病的治疗决策、术式选择和术后糖代谢随访策略提供参考。
1 对象与方法
1.1 对象
本研究获得北京大学第三医院医学科学研究伦理委员会批准(批文号:医伦审393-02号),并获得伦理委员会批准豁免知情同意的申请。入选标准:①因胰腺囊性肿瘤行腹腔镜胰体尾切除或胰体尾脾切除;②术前无糖尿病;③术后病理为MCN、SCN、IPMN和SPT;④术后规律接受随访。排除标准:①手术方式为胰腺局部切除或剜除;②临床病理数据或随访数据缺失。2010年1月~2019年12月10年我院共92例胰腺囊性肿瘤行腹腔镜胰体尾或胰体尾脾切除,其中16例术前患有糖尿病,2例失访,共入组74例。男19例,女55例。年龄(44.5±14.0)岁。肿瘤均为单发,肿瘤直径中位数4.0(1.0~12.0)cm;MCN 25例,SCN 9例,IPMN 15例,SPT 25例。术前空腹血糖(5.18±0.57)mmol/L,甘油三酯中位数1.16(0.39~5.54)mmol/L。ASA分级35例Ⅰ级,38例Ⅱ级,1例Ⅳ级。21例有糖尿病家族史。10例合并原发性高血压。根据术后随访期间是否发生NODM,分为NODM组(n=26)和糖代谢正常组(n=48)。
1.2 方法
1.2.1 手术方法 所有手术操作及围术期处理均由同一医师组完成。全麻,平卧分腿位。脐部穿刺建立气腹并作为观察孔,气腹压力12 mm Hg。上腹部剑突下、左上腹分别置入5、13 mm trocar。以超声刀或能量平台离断胃结肠韧带,游离横结肠系膜,显露胰腺。根据肿瘤和脾血管的关系决定是否保留脾脏,如保留脾脏行Kimura手术。使用腔镜下切割闭合器离断胰腺,胰腺离断部位由肿瘤的位置决定,一般距离肿瘤边缘1~2 cm,或在胰腺颈部离断。术中常规放置胰腺断端引流管,可吸收线缝合后腹膜组织予以固定引流管。术后均使用生长抑素类似物静脉泵入,根据引流情况决定拔管时机。
1.2.2 BMI测量 应用身高体重计(型号:ZF-120,无锡衡器厂)测量身高、体重,所用设备每12个月进行校准1次。身高测量方法为脱鞋直立,取头顶最高点的测量值;体重测量方法为晨起空腹,穿统一住院服。术前连续3 d测量,取平均值记录身高体重,并计算BMI。
1.2.3 NODM诊断标准 NODM指术前无糖尿病患者术后出现的糖尿病,关于NODM的时效性缺少标准[3]。糖尿病诊断标准采用《中国2型糖尿病防治指南(2020年版)》推荐标准[4],在典型高血糖症状患者中,随机血糖≥11.1 mmol/L诊断糖尿病;在没有明确高血糖症状的患者中,需要至少2次以下结果确诊:空腹血糖≥7.0 mmol/L;或口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L;或糖化血红蛋白≥6.5%。胰源性糖尿病指纤维钙化性胰腺病、胰腺炎、创伤/胰腺切除术、胰腺肿瘤、囊性纤维化、血色病等导致的糖尿病[4]。
1.2.4 糖尿病家族史 一级亲属(父母及直系兄弟姐妹)中至少有1名糖尿病患者。入院后详细询问患者一级亲属糖尿病患病情况并记录。
1.3 随访
对74例进行规律随访,随访方式为门诊复查。术后第1年每3个月随访1次,第2~5年每6个月随访1次,第5年后每年随访1次,至少随访36个月。患者门诊随访内容:有无糖尿病典型症状,包括多尿、多饮、体重下降等;进行空腹血糖和糖化血红蛋白检查;对于空腹糖耐量受损患者,进行口服葡萄糖耐量试验。对于随访间隔期间诊断糖尿病的患者,记录其诊断糖尿病时间。受疫情影响,未能按时门诊复查者,采取电话随访,随访内容为包括有无糖尿病典型症状,包括多尿、多饮、体重下降等,嘱其在当地就诊,并记录空腹血糖和糖化血红蛋白结果;对于血糖异常患者,内分泌科就诊完善口服葡萄糖耐量试验,并记录结果。
1.4 统计学处理
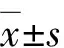
2 结果
19例接受胰体尾切除,55例接受胰体尾脾切除。手术时间(358.5±93.0)min,出血量中位数200(10~1450)ml。术后26例NODM(35.1%),确诊NODM中位时间为9个月(3~56个月)。2组年龄、性别、术前空腹血糖、术前甘油三酯、合并原发性高血压、ASA分级、手术方式、手术时间、术中出血量、肿瘤直径、肿瘤病理类型差异无显著性(P>0.05),BMI、糖尿病家族史、胰腺离断部位差异有显著性(P<0.05),见表1。根据胰腺离断部位分为颈部(颈部离断指在肠系膜上静脉前方离断胰腺,n=38)和体部(体部离断指在肠系膜上静脉左侧、肿瘤右侧离断胰腺,n=36),颈部离断胰腺22例术后发生NODM(57.9%,22/38),体部离断胰腺4例(11.1%,4/36),颈部离断胰腺患者NODM发生风险显著高于体部离断胰腺患者(OR=11.000,P=0.000)。单因素分析显示颈部胰腺离断颈部(OR=11.000,P=0.000)、有糖尿病家族史(OR=5.000,P=0.004)和BMI≥25.0(OR=4.333,P=0.007)是术后NODM的预后因素,见表2。

表1 NODM组与糖代谢正常组比较
3 讨论
胰腺术后糖代谢的改变是复杂而渐变的过程,受到多种因素影响,可以表现为术后NODM、糖尿病改善或糖尿病加重等,其中术后NODM是最值得关注的临床问题。胰腺手术切除部分胰腺,减少相应的胰岛数目,对胰腺的内分泌功能会造成一定影响,《中国2型糖尿病防治指南(2020年版)》[4]将手术切除胰腺导致的糖尿病归入特殊类型糖尿病中的胰源性糖尿病,这是一类具有特殊病因的糖尿病。胰腺全切术后的内分泌功能缺失会导致脆性糖尿病,但胰体尾切除和胰十二指肠切除对糖代谢的影响目前尚不明确。由于胰腺癌术后生存期较短,既往研究对于胰腺癌术后NODM这一长期不良预后未进行深入研究[5]。随着腹部CT和MR在临床中应用的普及,越来越多的胰腺囊性肿瘤得到诊断和治疗,如MCN、SPT、IPMN[6]。囊性肿瘤以胰体尾多见,患者接受胰体尾切除或胰体尾脾切除能够长期存活,术后NODM是临床上亟待研究的长期不良预后,对于评估手术指征、决定手术方式具有重要意义。
不同国家和种族正常人群中糖尿病发病情况不同,2015~2017年中华医学会内分泌学分会在全国31个省进行糖尿病流行病学调查,共调查75 880名成人,显示我国18岁及以上人群糖尿病患病率为11.2%(加权患病人数8385,95%置信区间10.5%~11.9%)[7]。本研究中35.1%(26/74)的患者术后NODM,胰腺术后NODM中位诊断时间为9个月(3~56个月),文献[2]报道胰体尾切除术后NODM中位诊断时间为6个月(0~60个月)。关于术后NODM的诊断时间目前缺少相关研究和时效性的定义[3],一般认为胰腺全切患者术后会即刻罹患NODM,胰十二指肠切除术和胰体尾切除术后新发NODM的时效性还缺少相关数据。胰腺术后NODM可能是残余胰腺功能不足和糖尿病的其他致病因素共同作用引起的,我们推测术后早期(6个月内)出现的NODM可能更多与残余胰腺功能不足有关,术后较晚出现的NODM其他致病因素(如遗传因素、肥胖等)可能发挥更多的作用。在2013年全国18岁及以上成人糖尿病调查中,通过口服葡萄糖耐量试验对人群进行糖尿病筛查,未诊断糖尿病患者占糖尿病患者总数63%(11 749/18 561),提示对于糖尿病的诊断不够及时,存在大量未诊治的糖尿病患者[8],因此,我们有必要针对胰腺术后患者采取更加严密的糖代谢随访策略。随着对胰腺术后NODM研究的深入和数据的积累,需要对NODM的时效性做出更准确的定义,并进一步区分胰腺残余功能不足导致的NODM和其他致病因素导致的NODM。
胰腺术后NODM的预后因素是目前研究的重点,既往研究[9~12]报道低残余胰腺体积、高BMI、术前高糖化血红蛋白水平、糖耐量受损、慢性胰腺炎和放射治疗是NODM的预后因素。本研究显示BMI≥25.0是NODM的预后因素(OR=4.333,P=0.007),肥胖或超重在一般人群和胰腺手术人群的糖尿病发生中可能发挥重要作用。肥胖和超重人群中糖尿病患病率显著增加,其中BMI<25.0者糖尿病患病率为7.8%,25.0≤BMI<30.0者患病率为15.4%,BMI≥30.0者患病率为21.2%[4]。这一点在胰腺术后NODM中同样可以观察到,肥胖或超重患者术后NODM的发病风险明显升高。肥胖或超重是糖尿病的高危因素,胰腺切除可能进一步加速这部分患者糖尿病的发病。
一级亲属患有2型糖尿病是中国成人2型糖尿病的独立危险因素[4],本研究显示有糖尿病家族史是NODM的预后因素(OR=5.000,P=0.004),有糖尿病家族史患者术后NODM的发病风险明显升高,胰腺切除可能促进糖尿病的发病。
术中保留更多胰腺的胰腺组织,维持更好的内分泌功能,可能对于减少术后NODM的发生有重要意义。本研究采用胰腺离断部位(颈部和体部)来评估胰腺切除范围对术后NOMD的影响,颈部离断胰腺组57.9%(22/38)的患者术后发生NODM,显著高于体部组11.1%(4/36),颈部离断胰腺是术后NODM的预后因素(OR=11.000,P=0.000)。术中胰腺离断部位的选择,主要和肿瘤位置和手术操作有关。胰腺颈部背侧是肠系膜上静脉,此处组织间隙疏松便于解剖游离。同时此处胰腺较扁平,便于闭合器离断,能减少术后胰漏的发生。但是颈部离断损失更多的胰腺组织,增加患者术后罹患糖尿病的风险。因此,在保证肿瘤学切缘和手术安全的基础上,我们应尽量避免选择在颈部离断胰腺。采用胰腺离断部位评估胰腺切除范围更加方便易行,在术前即可预测患者术后NODM的发病风险,更具有指导意义,同时对于术中手术策略的抉择也有参考价值。
本研究的主要缺陷在于样本量较小,无法满足多因素logistic 回归分析的最低样本量15~20倍变量的要求,只能单因素分析初步探讨。但本研究对于胰腺囊性肿瘤行胰体尾切除术后NODM这一重要问题仍具有探索价值。OR(odds ratio)即“比值比”,也称“优势比”,反映的是某种暴露与结局的关联强度,是指病例组中暴露于该因素者与未暴露者之间的比值,为对照组中该项比值的倍数。OR=1,表示该因素对疾病的发生不起作用;OR>1,表示该因素是患病的危险因素,有这个因素的人患病的风险很高;OR<1,表示该因素是患病的保护因素,有这个因素的人患病的风险低。OR值越远离1,则越有价值。OR值是病例对照研究中常用的统计学指标,是最常用的分类指标的效应量。通常认为随机对照研究和队列研究中RR大于3才有意义,而回顾性的病例对照研究由于可能受到多种偏倚的影响,OR值至少应大于4[13]。本研究单因素分析中P<0.05的3个因素为胰腺离断颈部(OR=11.000)、有糖尿病家族史(OR=5.000)和BMI≥25.0(OR=4.333),OR值均>4,因此,本研究所阐明的颈部离断胰腺、有糖尿病家族史和BMI≥25.0有一定的潜在临床意义,有待今后工作中积累更多的病例验证和进一步研究工作中证实。NODM是胰腺囊性肿瘤行胰体尾或胰体尾脾切除术后的重要不良预后,有糖尿病家族史、BMI≥25.0和颈部离断胰腺可能是NODM的预后因素。我们在对胰腺囊性肿瘤进行临床决策时,应根据肿瘤生物学行为并充分考虑患者的长期生活质量综合进行判断,术中尽可能更多的保留胰腺组织,对这部分患者加强糖尿病宣教和进行更严密的糖代谢随访。

