冷指结晶法去除LiCl熔盐中的碱土金属Sr、Ba
林钦 王玉娇 程明 孙波 付海英 窦强 周金豪周再春 刘秋华
1(理论有机化学与功能分子教育部重点实验室和化学化工学院 湖南科技大学 湘潭 411201)
2(中国科学院上海应用物理研究所 上海 201800)
3(东方电气成都氢燃料电池科技有限公司 成都 610000)
4(中国科学院大学 北京 100049)
5(上海科技大学 上海 201200)
核能作为一种清洁、高效的能源,在化石燃料短缺的今天成为能源发展的重要方向。21世纪初第四代国际核能论坛(Gen IV)提出金属快堆是第四代先进核能系统的6种反应堆型之一[1],拟采用闭式燃料循环,可在常压、高温条件下运行,能有效地提高铀、钍资源利用率,极大提高燃料的可持续性,也可以用来焚烧现有轻水堆乏燃料中的长寿命次锕系元素。后处理对锕系元素的分离和利用决定了快堆核能系统的优势发挥,因此后处理是先进快堆燃料循环的关键环节[2]。快堆乏燃料具有燃耗高、超铀含量高、放射性强等特点,基于溶剂萃取的传统水法后处理方式难以处理。近年来,以熔盐电化学为代表的干法处理技术用于处理快堆燃料正受到广泛的关注[3-4],干法工艺采用无机盐为介质,具有较高的辐照稳定性,适合处理高燃耗的快堆乏燃料,尤其是金属乏燃料。其中,最具代表性的有俄罗斯核反应堆研究所开发的氧化物电解沉积和美国阿贡实验室开发的氧化物电解还原和金属电解精炼技术[5]。
电解还原流程中以LiCl-Li2O熔盐体系为电解介质,在高温下将处于阴极的氧化物乏燃料还原为金属乏燃料,碱金属、碱土金属、部分稀土元素及腐蚀产物则溶解至熔盐中[6]。随着电解的进行,裂变元素逐步累积,影响电解过程及电流效率[7],因此,需要定期更换部分熔盐。而排出的废熔盐成分复杂,地质处置前需进一步处理。目前传统的处理方式将废盐与沸石或玻璃材料混合变为稳定的陶瓷或玻璃,进行固化处理[8],这产生了大量废盐固化物。为减少废物量和回收废熔盐,各国开发了多种熔盐净化手段,如沸石离子交换法[9]、沉淀法[10-11]、熔盐蒸馏法[12-14]等。然而,纯LiCl熔盐的熔点温度为610 ℃,沸石在此温度下结构易被破坏,稳定性不高[15];沉淀法中Sr、Ba等碱土金属难以与沉淀剂发生反应[16]。蒸馏法可以回收大部分的载体盐且盐的纯净度高,但熔盐蒸馏条件苛刻,既需要真空环境,又要求温度达1 000 ℃左右;而且碱土金属SrCl2、BaCl2与LiCl存在共蒸发现象,导致收集盐中锶、钡的去除率较低[17]。熔融结晶法因其无须发生化学反应,不引入新杂质,近年来逐渐受到关注[18-21]。Lee等[18]先开发了Czochralski法,采用旋转的金属棒以提拉的方式,将LiCl熔盐在金属棒表面结晶,从而将LiCl与CsCl和SrCl2分离。Choi等[19]开发了层析结晶工艺,LiCl先在加热器中熔融,再将冷却板浸入熔盐中,使LiCl在冷却板表面生长,从而分离SrCl2、CsCl和BaCl2,该方法对熔融结晶的过程进行了演示,但未对工艺参数进行进一步探究。Shim等[20]采用区域精炼熔融/结晶的方法,通过从LiCl-CsCl-SrCl2盐混合物中生长纯LiCl盐锭中分析Sr和Cs的浓度,发现盐锭初始区域的Sr和Cs浓度较低,在盐锭的最终冻结区域达到峰值。另外,Versey等[21]提出了一种冷指分离CsCl和LiCl-CsCl熔盐的技术。在不同的CsCl浓度、冷却气体流量和分离时间等参数下开展实验,获得了较好的效果,表明冷指分离实验的可行性。冷指结晶法是一种周期短、操作简单的熔盐净化方法,但目前尚未有更多的报道。
本文提出冷指结晶法分离LiCl熔盐中碱土金属Sr、Ba元素的工艺方法。通过建立Fluent模型,计算熔盐的结晶析出与不同气体流速、晶体生长时间及本体熔盐温度等参数之间的关系,探索不同条件下LiCl熔盐的析出规律。同时开展含有碱土金属SrCl2、BaCl2的LiCl熔盐的结晶分离实验,探索析出熔盐各部位纯度的变化规律,为LiCl的纯化与重复利用提供依据。
1 实验装置及方法
1.1 试剂与仪器
试剂:LiCl(纯度99.9%),sigma-Aldrich;SrCl2、BaCl2(纯度99.9%),国药集团化学试剂有限公司;氩气,纯度99.999%,上海祥堃气体有限公司。
仪器:电感耦合等离子体发射光谱仪(Inductively Coupled Plasma Optical Emission Spectrometer,ICP-OES):Optima 8000,美国PerkinElmer公司。
1.2 实验装置
冷指结晶实验采用自主研发的小型冷指结晶装置,如图1所示,包括进气管、冷指、电阻炉、镍坩埚、法兰盖、出气管、热电偶等主要部件。电阻炉可分段控温,最高温度800 ℃。所有实验实际温度均进行温度校正,误差±1 ℃。实验装置安装在惰性气氛的手套箱内,手套箱保持氩气气氛(99.99%),H2O和O2含量均低于1.0×10-5g·mL-1。

图1 实验装置示意图Fig.1 Diagram of experimental setup
1.3 实验方法
1.3.1 LiCl盐及混合盐的熔融
选择半径r为3 cm的镍坩埚,熔融状态下纯LiCl的密度ρ为1.502 g·cm-3,预计熔融盐高度h为4 cm,计算所需盐的质量为169.87 g。在氩气气氛的手套箱内称量所需的LiCl,将LiCl置于纯镍坩埚中,以10 ℃·min-1的速度升温至500 ℃,保温5 h,除去原料中的水氧,以此LiCl开展后续实验。
1.3.2 纯LiCl盐实验
镍坩埚内加入一定质量的熔盐,安装在电阻炉炉膛中。设定电阻炉升温程序,使盐充分融熔。开启升降机,调节冷指高度和位置,保持在液面以上约1 cm。加热冷指,约20 min冷指温度保持稳定。继而往冷指中通入压缩空气,压缩气体流量调节范围0~30 L·min-1。进一步降低冷指高度,使冷指浸入熔盐液面以下。生长时间结束后,提升冷指使之脱离液面。待冷指冷却至室温,收集结晶盐,进行后续的分析。
1.3.3 含有SrCl2/BaCl2-LiCl分离
将含有一定质量的SrCl2/BaCl2与LiCl熔盐混合,参照§1.3.2开展实验。待混合盐完全熔融后,用镍棒搅拌熔盐,并蘸取少量作为实验前熔盐。实验结束后,收集结晶盐质量,取不同部位样品,手套箱内研磨,取约0.1 g溶解于2%的HNO3中,进行ICPOES分析。相同条件的实验均重复三次,每次实验取3个平行样品,且每个样品平行测定3次,相对误差在5%以下,Sr/Ba含量取测试结果的平均值。
1.3.4 数值模拟计算模型
为建立一个有效、实用的冷指熔盐结晶温度场及固液情况分布模型,基于计算流体力学(Computational Fluid Dynamics,CFD)软件进行数值模拟。通过参数设置模拟实验条件,获得的计算结果用于实验结果的预测。
物理模型:基于Fluent软件建立相应模型,如图2所示。其中冷指直径为20 mm,釜体直径60 mm,模型釜体高度60 mm,冷指浸入深度10 mm。模型侧面以及底部为釜体传热界面,顶部凹陷部分为冷指浸入部分的传热界面,模型网格孔径2 mm。
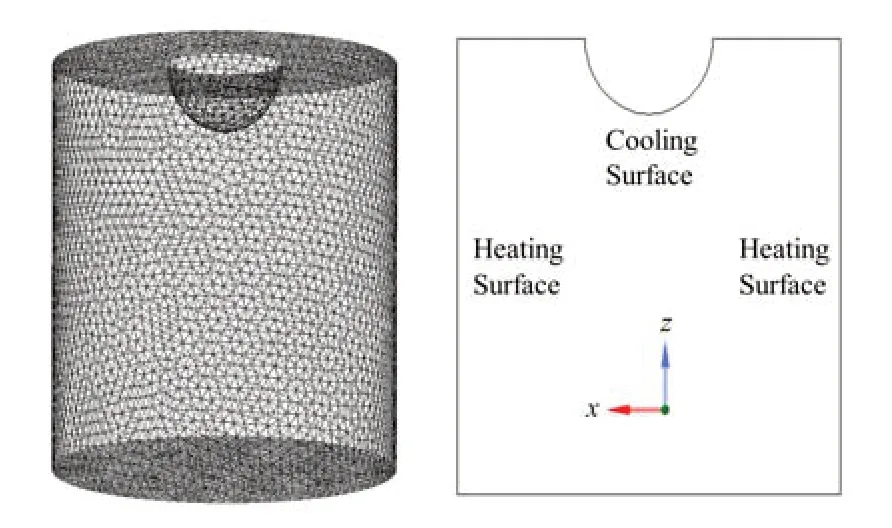
图2 Fluent模型的建立Fig.2 Schematic of the modeling in Fluent
数学模型:参考文献[22-23]获得控制方程,其中连续性方程如下:
式中:ρ熔盐密度(kg·m-3);u、v分别为x、y轴速度(m·s-1)。x、y轴方向的动量方程分别如式(2)和式(3):
式中:τ为时间(s);μ为熔盐动力黏度(kg·m-1·s-1);P为压力(Pa);β为热膨胀系数(K-1);Tm为熔盐熔点(K);Sx和Sy为动量消耗项(m)。
式中:Am为糊状区常数,为2.5×106;fL为熔盐液相体积分数,主要由熔盐温度决定。
式中:Ts和T1分别为熔盐固相温度和熔盐液相温度。
能量方程如式(9):
式中:k为熔盐的导热系数(W·m-1·K-1);H为熔盐的焓(kJ·kg-1)。参照文献[24-25]确定LiCl熔盐的相关物性参数,用于模型计算。
参数设置:选择3D(压力基)瞬态求解器,采用Soildification&Melting模型(凝固-熔化模型),釜底及釜壁为加热面,根据加热器的恒温加热模式设置加热面为恒温边界条件。熔盐与冷指接触的界面为换热冷却界面,冷却空气与冷指内壁(材质316L)间的对流换热系数设定为16.3 W·m-2·k-1,空气入口温度设定为常温25 ℃。在求解器控制参数的设置面板中设定压力和速度的耦合采用Coupled。
2 结果与讨论
2.1 纯LiCl熔盐结晶条件及模拟
2.1.1 生长时间的影响
为探究生长时间对冷指上结晶盐质量的影响,设定熔盐本体温度640 ℃,压缩空气气体流速为10 L·min-1,冷却气体温度为室温。改变冷指浸入熔盐时间分别为5 min、10 min、15 min、20 min,比较冷指上结晶盐的质量。同时通过Fluent模型模拟计算,得到冷凝周围温度场分布如图3。可以认为温度低于610 ℃时,LiCl由熔融态转化为固态,对应于图3中蓝色区域。随着生长时间的增加,蓝色凝固部分逐渐增加,说明熔盐凝固的体积逐渐增大。通过测量模拟结果中蓝色部分的尺寸,计算其最大尺寸的圆柱体体积,将多余部分近似为三角锥形,减去冷指部分体积与三角锥形得到结晶盐体积近似值。该值与LiCl密度相乘得到凝固熔盐的质量,与实验中获得的冷凝盐质量对比,如表1和图4。可以看出:在熔盐初始温度、冷却气体流量恒定时,结晶盐的质量随生长时间的增加而增加,结晶盐的生长速率在15 min时开始减小。模拟与实验结果对比发现,在生长时间较短时,结晶盐的质量小,计算值与实际值的偏差较大;当生长时间在15~20 min时,结晶盐质量较大,计算值能够较为合理地预测实验结果,因此后续实验的生长时间选择在15~20 min范围内。

表1 晶体生长时间对晶体质量的影响(气体流速10 L·min-1,初始温度640 ℃)Table 1 Effect of crystal growth time on crystal mass (airflow intensity 10 L·min-1, initial temperature 640 ℃)
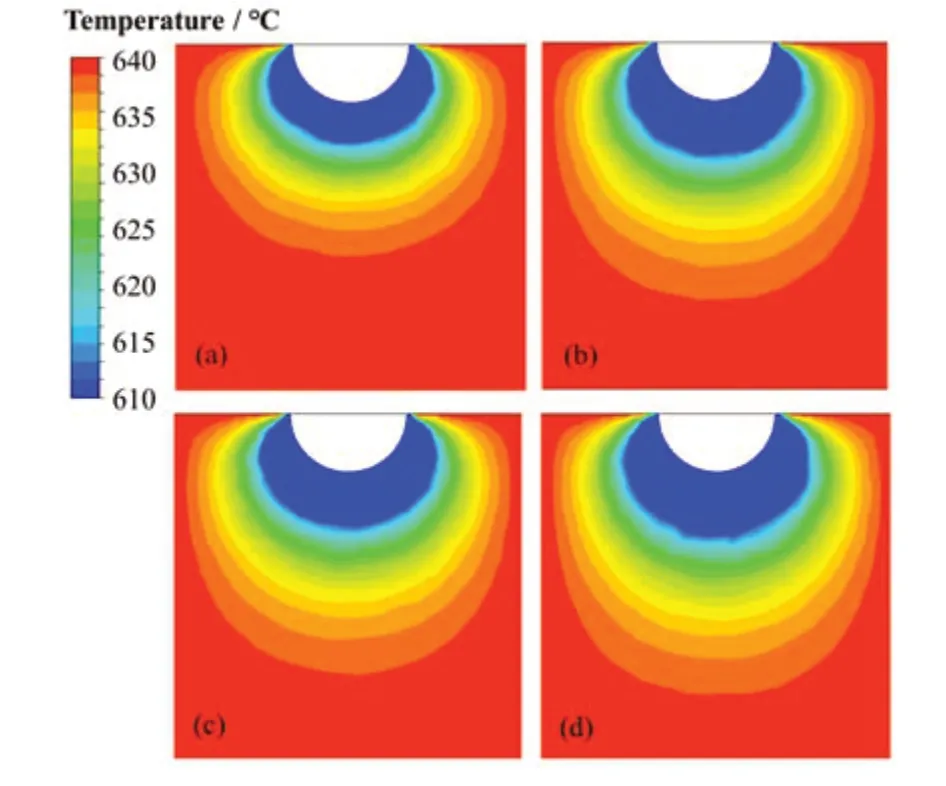
图3 Fluent模拟不同生长时间的温度场分布图(彩图见网络版)(a) 5 min,(b) 10 min,(c) 15 min,(d) 20 minFig.3 Temperature field distribution using Fluent simulation under different crystal growth times (color online)(a) 5 min, (b) 10 min, (c) 15 min, (d) 20 min

图4 晶体生长时间与盐结晶质量的关联图Fig.4 Correlation diagram of crystal growth time and crystal mass
2.1.2 熔盐初始温度的影响
熔盐温度是影响冷指上结晶盐质量的主要因素之一。在压缩空气气体流速为10 L·min-1,通气20 min条件下,改变熔盐的初始温度分别为640 ℃、650 ℃、660 ℃、670 ℃时,比较冷指上冷凝结晶盐的质量。同时Fluent模型得到冷凝周围温度场分布如图5,随着熔盐温度的升高,图5中蓝色部分的面积逐渐减小,说明冷指上结晶盐体积逐渐减小。计算模拟结果中蓝色部分的面积,估算熔盐凝固部分的质量,并与实验中获得的熔盐晶体质量对比,如表2和图5。

表2 初始温度对晶体质量的影响(气体流速10 L·min-1,生长时间20min)Table 2 Effect of initial temperature on crystal mass (airflow intensity 10 L·min-1,growth time 20 min)
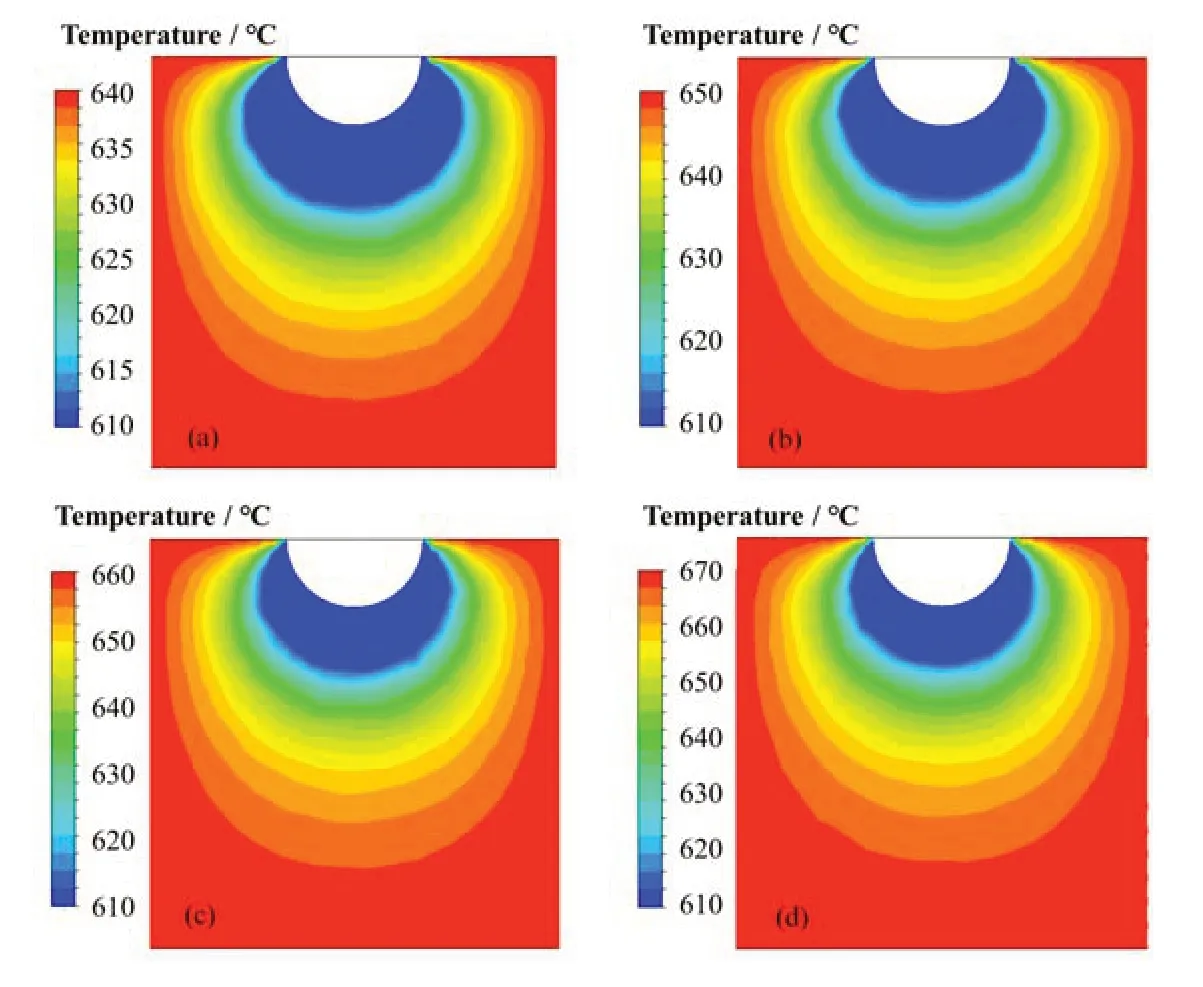
图5 Fluent模拟不同初始温度-温度场分布图(彩图见网络版) (a) 640 ℃,(b) 650 ℃,(c) 660 ℃,(d) 670 ℃Fig.5 Cold finger temperature field distributions using Fluent simulation under different initial temperatures (color online)(a) 640 ℃, (b) 650 ℃, (c) 660 ℃, (d) 670 ℃
640 ℃时,冷凝盐质量计算值19.83 g,实验值15.61 g,相差4.22 g。温度升高至670 ℃时,理论值与实验值相差0.82 g,同时盐的生长速率也明显降低。当热的LiCl盐与冷的冷指壁面的接触时,同时存在凝固和熔融两个过程。理论模拟认为生长时间20 min时,盐的凝固和熔融达到平衡,实际实验中因熔盐温度不同,凝固和熔融的平衡所需时间不同,导致结晶盐的质量可能高于或低于理论值,但总体差值低于20%。
2.2 LiCl中SrCl2的分离
2.2.1 生长时间的影响
探究生长时间对LiCl盐中SrCl2的分离的影响,在初始温度640 ℃、10 L·min-1的条件下进行不同生长时间的冷指分离实验。采用1%(w/w) SrCl2-LiCl盐进行实验。
结晶盐样品如图7所示,呈现半透明的晶体。生长时间10 min时,冷凝结晶盐底部呈半圆弧形,不光滑。继续延长生长时间,结晶盐表面呈现光滑。手套箱内研磨收集到的结晶盐,取样分析计算Sr的去除率,结果如表3。

表3 生长时间对SrCl2去除率的影响(温度640 ℃)Table 3 Effect of growth time on SrCl2 removal ratio(temperature 640 ℃)

图7 气体流速10 L·min-1、结晶温度640 ℃时不同晶体生长时间的结晶盐 (a) 10 min,(b) 15 min,(c) 20 minFig.7 Crystalline salt at flow rate of 10 L·min-1 and crystallization temperature of 640 ℃ under varying growth time(a) 10 min, (b) 15 min, (c) 20 min
依据分析数据可知,在初始温度640 ℃、10 L·min-1气体流速下,结晶盐中SrCl2去除率均可以达到60%以上,晶体生长时间对结晶盐中SrCl2的含量无明显影响。
2.2.2 熔盐初始温度的影响
探究不同初始温度对结晶盐中SrCl2含量的影响,在气体流速8 L·min-1,生长时间20 min的条件下,进行不同初始温度的冷指分离实验。采用1%(w/w)SrCl2-LiCl盐进行实验。
表4数据可以看出在不同初始温度其余参数不变的情况下,结晶盐中SrCl2的去除率随保温温度的升高而降低,10 ℃的温差能造成较大的SrCl2去除率差异,由此可以看出,熔盐温度是影响结晶盐中SrCl2含量的重要因素。

表4 不同熔盐温度时结晶盐中SrCl2去除率Table 4 Removal ratios of SrCl2 in crystalline salt at varying initial crystallization temperatures
2.2.3 不同初始浓度SrCl2的影响
初始温度660 ℃、气体流速10 L·min-1、生长时间20 min条件下,探索初始盐中不同含量的SrCl2(0.05%、0.55%、1.22%、3.44% SrCl2(w/w))对冷指结晶法去除SrCl2的影响。
实验结果如表5,根据数据可看出在气体流速10 L·min-1、660 ℃时,冷指结晶法对LiCl-SrCl2的净化效果在SrCl2含量低时较好。SrCl2含量低于0.55%(w/w)时,去除率达到80%以上,继续升高SrCl2含量,净化效果下降。LiCl-SrCl2熔融盐中存在SrCl2-4形式[26]。且Sr2+的离子半径0.066 nm,与Li+的离子半径0.076 nm接近,故推测当SrCl2浓度升高至一定范围时,熔盐中形成了Li2SrCl4配合物。SrCl2含量升高,越容易形成配合物。冷却过程中,Li2SrCl4配合物发生冷凝,导致结晶盐中SrCl2的含量较高,锶的去除率降低。故实验条件下,本体盐中不同SrCl2含量影响结晶盐的净化效果。
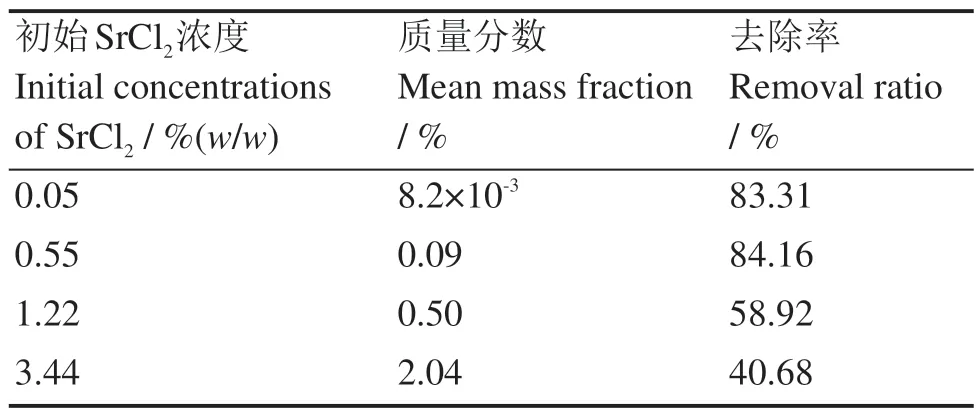
表5 不同SrCl2初始浓度结晶盐中的SrCl2的去除率Table 5 Removal ratios at varying initial concentrations of SrCl2
2.2.4 结晶盐不同部位的SrCl2去除率
实验中发现结晶盐全部研磨后,取3个平行样分析时,SrCl2去除率存在较大差异,说明冷指上不同部位冷凝结晶盐的纯度有差异,同时也观察到熔盐底部出现不透明白色部分的冷凝盐。为避免将结晶盐全部粉碎,存在样品不均匀现象,参照Versey等[20]分析LiCl-CsCl体系中盐锭各部分的Cs浓度的分析方法,结合冷指结构,认为本工作中冷凝结晶盐的形状如图8(a)。此半球状的不同部位作分别标识,如顶部、中部、底部三段;外、中、内三层。
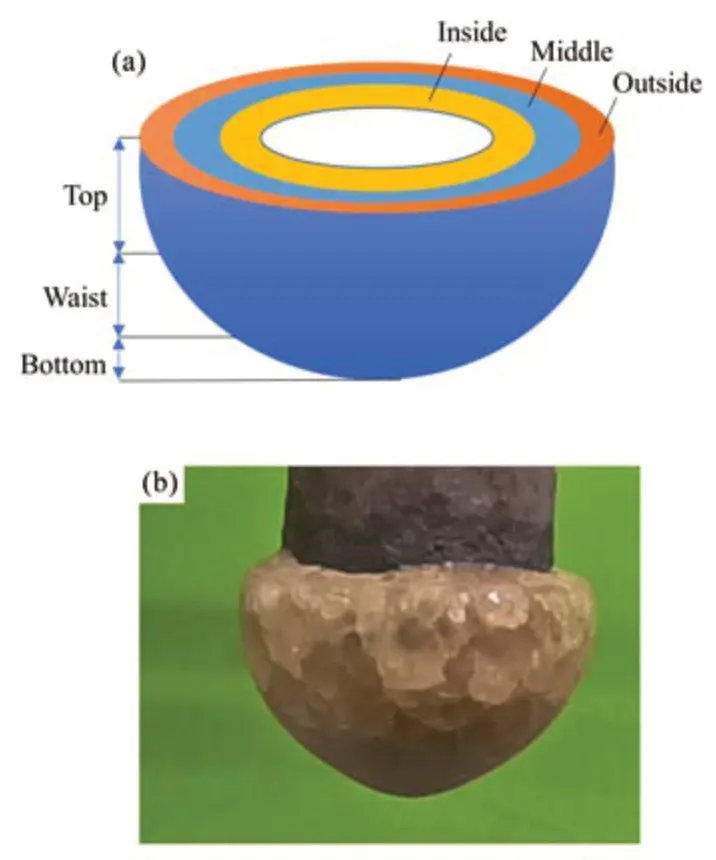
图8 结晶盐示意图(a)和结晶盐照片(b)Fig.8 Diagram of different regions of crystalline salt (a), and the photograph of crystalline salt (b)
为探究结晶盐不同部位SrCl2去除率的规律及影响因素,初始温度670 ℃、控制结晶盐质量为(9.5±0.5) g时,结晶盐的照片如图8(b),在670 ℃保温温度下的结晶盐整体呈半球状,盐样品颜色较深,推测为原料盐放置时间较长,导致盐的变质导致熔融后盐锭的颜色变化。盐锭底部有水滴状突起,为重力影响下的滴状晶体。
结晶盐不同部位取样ICP-OES分析结果如表6,三次实验的重现性较好。顶部盐的去除率达93.30%,中部为88.94%,底部去除率稍低为86.07%。三次重复实验,结晶盐平均去除率为89.10%。

表6 控制结晶盐质量(9.5±0.5) g,初始温度670 ℃,SrCl2含量1%(w/w)的去除率Table 6 Removal ratios of 1%(w/w) SrCl2 in LiCl with crystalline salt mass of (9.5±0.5) g at 670 ℃
底部的滴状晶体SrCl2浓度较整体部分高,底部因为重力因素和最后离开熔盐液面,导致底部的SrCl2含量较高,顶部由于熔盐的爬升,SrCl2含量最低,净化效果最好,达到90%以上。670 ℃进行冷指结晶可以得到SrCl2去除率90%左右的晶体。
2.3 LiCl中BaCl2的分离
2.3.1 温度对不同部位的BaCl2去除率的影响
在SrCl2实验中,探究了结晶盐不同部位的去除率。为进一步探究冷指结晶法对结晶盐不同部位对碱土金属去除率的影响,且探索出净化效果好的工艺方案,设计1%(w/w) BaCl2-LiCl熔盐开展通气20 min、气体流速10 L·min-1,不同初始温度下不同部位的去除率实验。
ICP-OES分析结果如表7,结果表明,不同参数条件下,结晶盐顶部的去除率最高,底部的去除率最低;外层最高,内层最低。在初始温度为650 ℃、660 ℃时,除660 ℃结晶盐内层部分,其余部分去除率均达到90%以上。当初始温度为640 ℃时,结晶盐顶部的去除效率达到96.19%,而内层出现了去除率大幅度降低的现象,仅有34.91%。由于结晶盐生长在冷指表面,在冷指与熔盐接触的瞬间,熔盐内部的LiCl与BaCl2共同结晶。在此情况下,将LiCl与BaCl2共同冷却,未能分离,当温度较低时此现象更加明显。底部受重力因素影响,导致去除率降低为58.49%。随初始温度升高,晶体生长速率降低,LiCl与BaCl2重新分布逐渐完全,底部BaCl2富集部分逐渐减小,底部去除率降低现象明显改善。由此可见,相同条件下,结晶盐不同部分BaCl2含量不同,顶部外层的结晶盐去除率最高,内层盐和底层盐的去除率低,尤其初始盐温度较低时,内层和底层盐去除率降低明显。
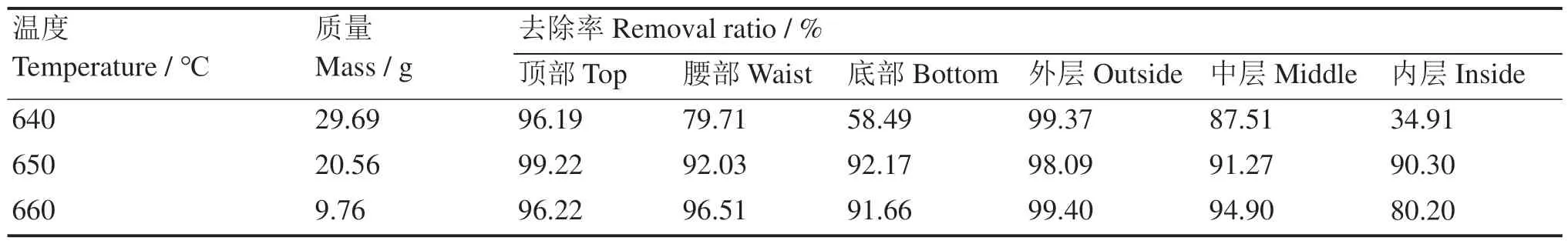
表7 不同初始温度1%(w/w)BaCl2结晶盐各部位的去除率Table 7 Removal ratios of 1%(w/w) BaCl2 in LiCl at different regions and initial temperatures
2.3.2 不同初始浓度BaCl2的影响
在LiCl中以初始浓度0.5%(w/w)、1%(w/w)、2%(w/w)和4%(w/w)的BaCl2进行实验,在670 ℃下对不同BaCl2初始浓度的熔盐进行生长时间20 min、气体流速10 L·min-1,探究初始BaCl2浓度对冷指上结晶盐杂质去除率的影响。观察到结晶盐,与前述实验一样均呈半圆状。收集结晶盐,取样进行ICP-OES分析。结果如表8所示,实验条件下BaCl2的去除率均达到88%以上,随BaCl2初始浓度逐渐增大,去除率变化趋势波动较小,可见Ba元素初始浓度对冷指分离法净化效果影响较小。

表8 不同BaCl2初始浓度的结晶盐去除率Table 8 Comparison of removal ratios with different initial concentrations of BaCl2
2.3.3 SrCl2、BaCl2共存时的去除率
当BaCl2、SrCl2同时存在于LiCl盐,BaCl2与SrCl2含量相同,总含量为1%(w/w)时,熔盐温度670 ℃,气体流速10 L·min-1,收集冷指上结晶盐,研磨均匀后,取3个平行样品,进行ICP-OES分析。结晶盐质量分别为10.27 g和5.77 g时,Sr/Ba去除率比较如表9。实验条件下Sr元素的去除率为91%~95%、Ba元素的去除率为95%~98%。可见Sr、Ba共存时,冷指结晶法对LiCl仍保持较好的净化效果。

表9 670 ℃杂质为BaCl2与SrCl2结晶盐的去除率Table 9 Removal ratios of BaCl2 and SrCl2 in LiCl at 670 ℃
4 结语
本工作利用自行研制的冷指结晶装置,以LiCl体系为研究对象,开展了碱土金属元素Sr、Ba及Sr、Ba共存时分离探索实验。考察了生长时间、Sr/Ba元素初始浓度、熔盐本体温度在冷指分离法中对碱土金属元素去除效果的影响。实验发现生长时间为10~20 min时,SrCl2去除率为63%左右。SrCl2浓度低于0.55%时,其去除率达到83%以上;BaCl2在初始浓度在0.54%~4.43%时,去除率达90%左右。进一步将结晶盐分区域进行分析,发现顶部与外层部分去除率稍高,底部和内层部分去除率较低。同时验证了熔盐温度670 ℃,Sr、Ba共存时,二者的去除率均高于90%。同时采用Fluent软件建立数值模拟模型,模拟了熔盐在不同条件时的温度场和固液相分布情况,并与实验值比较,显示理论模型能较为准确地反映熔盐结晶的影响因素及规律。本工作证实了冷指结晶法在LiCl体系中进行Sr、Ba除杂的可行性,为实现LiCl熔盐的重复利用提供实验和理论支持。
作者贡献声明林钦负责实验数据,理论模拟,文章的撰写;王玉娇负责文献收集和整理;程明负责数据分析;孙波负责理论模拟及文章各个版本的修订;付海英负责方案设计,文章修订;窦强负责实验指导及项目的管理;周金豪负责概念及模拟指导;周再春负责文章修订;刘秋华负责文章的整体规划和设计。

