光谱法研究天然牛磺酸与肝硬化门静脉高压大鼠的肝组织蛋白相互作用*
玉 叶,廖 娟,文 彬,邓 鑫
(1.桂林市中医医院,广西 桂林 541000;2.广西中医药大学附属瑞康医院;3.广西中医药大学基础医学院)
门脉高压症是肝硬化的主要并发症,后期易并发腹水、食管静脉曲张、肝性脑病和肝肾综合征等,导致疾病预后不佳,治疗上主要针对病因和并发症治疗[1]。有效降低门静脉压力可降低肝硬化患者并发症的发生率,并可能提高其生存率。前期研究表明,天然牛磺酸具有改善肝功能及抗肝纤维化作用[2-3]。此外,Wen等[4]首次发现天然牛磺酸能显著降低肝硬化大鼠门静脉压力,提高门静脉顺应性,有效减缓门脉高压,其作用机制可能与改善门静脉力学作用相关[5]。配体-蛋白质相互作用亲和力的信息对于评估具有重要药理意义化合物的治疗效果是非常有价值的。因此,本研究运用荧光光谱法探讨天然牛磺酸与肝硬化门静脉高压大鼠肝组织蛋白间的分子作用。
1 材料和方法
1.1实验动物 120只SPF级雄性Wistar大鼠,体质量(200.0±10.0) g,长沙市天勤生物技术有限公司购买,动物许可证号:SCXK(湘)2014-2011,动物合格证号:43006700016127,遵循3R原则,在恒温(23±2 ℃)、恒湿(50.0%±10.0%)、昼夜循环(12 h∶12 h)条件下饲养。
1.2材料 天然牛磺酸(从珍珠贝中提取,经蒸煮后,浓缩汤汁,加乙醇沉淀,取上清液,然后对上清液进行脱色处理,结晶得到天然牛磺酸),盐酸普萘洛尔片(别名心得安,规格为10 mg/片,由亚邦爱普森药业有限公司生产,国药准字:H32020133,含量97.0%~103.0%);橄榄油(阿拉丁工业公司);甲醛(10.0%福尔马林);人血清白蛋白[(Human serum albumin,以下简称HSA,厂家为Solarbio(索莱宝),纯度96%~99%,分子量为66478,Tirs-Hcl缓冲液(Phygene飞净,PH 7.4)];PBS缓冲液(飞净);蛋白裂解液(biosharp);PMSF(苯甲基磺酰氯,biosharp);BCA蛋白浓度测定试剂盒(biosharp)等。
1.3方法
1.3.1动物模型的建立 将120只大鼠按随机数字法分成正常组、模型组、心得安组、天然牛磺酸组四组,每组30只,除正常组外,其余三组用四氯化碳(carbon tetrachloride,CCL4)制备肝硬化门脉高压大鼠模型,造模同时给药,疗程10周。
1.3.2样本收集 动物模型制备成功后取材:麻醉,固定,沿大鼠腹中线逐层剪开腹壁并游离肝门静脉主干,连接电磁流量计以测定门静脉血流量(portal vein flow,PVF)、门静脉压力(portal vein pressure,PVP)、右颈动脉插管用于测定平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR);测量结束后,分离肝脏组织,置于生理盐水中迅速漂洗3遍以清洁残留血液,冻存并标注。将所取下组织分成两部分:①置于10.0%甲醛溶液中固定过夜,4℃保存,观察病理学改变并拍照记录;②另一部分肝组织提取蛋白,并配制BCA工作液、蛋白标准品,采用全波长多功能酶标仪,于562 nm处测定吸光值。
1.3.3紫外可见吸收光谱 将天然牛磺酸用超纯水制备成浓度与组织蛋白相似的溶液,浓度为1 mg/mL,使用紫外分光光度计测量并记录200~500 nm处相应的天然牛磺酸紫外吸收光谱。
1.3.4荧光光谱 根据提取的上清液所测蛋白浓度相似度配制所需浓度,正常组、模型组、天然牛磺酸组浓度相似,加入pH =7.4 Tirs-Hcl缓冲液制成1 mg/mL的溶液,置于4 ℃低温保存备用。天然牛磺酸分为两组不同浓度梯度(一组:0、2、4、6、8、10、12 μL;二组:0、8、16、24、32、40、48、56 μL)。准确移取浓度为2.5×10-3g/L的天然牛磺酸于5 mL离心管中,并用移液管向每个离心管中移入2 mL的1 mg/mL的各组大鼠蛋白溶液,置于漩涡混合器10 s,使混合液充分混合。在291、301、311 K(K:开尔文T,物理中常用T=t+273.15 K,所以t=0 ℃时,T=273.15 K;291K ≈17.85 ℃、301K ≈27.85 ℃、311K ≈37.85 ℃)不同水浴温度下30 min后测量并记录相应的荧光值。
荧光光谱扫描参数设置:发射光波长(Em)范围为295-500 nm,荧光激发光波长(Ex)设定为280 nm,狭缝宽度为5.0 nm,扫描速度为6 000 nm/min,数据间隔为1.0 nm,灵敏度设为Auto。
1.3.5荧光猝灭 荧光测量采用日本岛津RF7600荧光分光光度计,激发波长280 nm,发射波长为295~500 nm。研究天然牛磺酸诱导人血清白蛋白(human serum albumins,HSA)荧光猝灭的机理,用Stern-Volmer方程计算了HSA在不同温度下的荧光猝灭[6]:
F0是未加入猝灭剂时的荧光强度;F是加入猝灭剂后的荧光强度;Kq是双分子猝灭过程速率常数;Ksv是Stern-Volmer动态猝灭常数;[Q]是猝灭剂的浓度;τ0是未加入猝灭剂时荧光分子的平均寿命,生物大分子的平均荧光寿命约为10-8s。
1.3.6结合常数的计算 对于蛋白质的荧光猝灭为静态猝灭过程,当药物分子独立地与大分子上的一组等效位点结合时,根据lg(F0-F)/F与lg[Q]相比绘制双对数曲线,可以通过截距和斜率分别得到结合位点数n和结合常数Ka。结合常数(Ka)和结合位点数(n)可以由下式确定[7-8]:
式中,F0表示未加入猝灭剂时荧光体的荧光强度;F表示加入猝灭剂时荧光体的荧光强度,Ka是猝灭剂与HSA的表观结合常数;n是结合位点数;[Q]为猝灭剂的浓度。
1.3.7热力学参数的测定 热力学参数可根据van't Hoff方程[9-11]来估算:
其中Kb类似于相应温度下的缔合结合常数即Ka,R为气体常数。焓变(△H)由范特霍夫关系式的斜率计算得出。然后,根据以下关系[9-11]估计自由能变化(△G):
△G=△H-T△S
(4)
1.3.8能量转移的计算R0可以根据施主发射光谱和受主吸收光谱使用Forster公式来计算[12-13]。

(6)
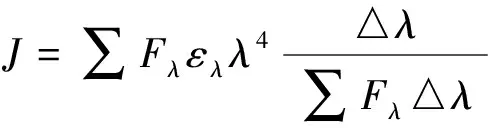
(7)

(8)
其中能量传递效率E由上式(5)定义。r是受体和施主之间的距离,R0是Forster临界距离,在该临界距离下,50%的激发能量转移到受体;K2是表示供体相对于受体分子的相对取向的因子;N是介质的折射率;Ø是在没有受体或供体的情况下量子产率;J是供体的荧光发射光谱和受体的吸收光谱的重叠积分;Fλ是在波长λ处没有受体的情况下给体的荧光强度;ελ是受体在λ处的紫外摩尔吸收系数。已有文献报道K2=2/3,N=1.336,Ø=0.118[14]。J是重叠区域,从而计算出J、E、R0和r。
2 结果
2.1天然牛磺酸治疗后门静脉压力相关指标的对比 与正常组比较,模型组、天然牛磺酸组、心得安组门静脉压力(PVP)、门静脉流量(PVF)升高;平均动脉压(MAP)降低(均P<0.05);与模型组比较,天然牛磺酸组、心得安组PVP、PVF下降(P<0.05),MAP升高(P<0.05);与心得安组比较,天然牛磺酸组PVP、PVF下降(P<0.05),MAP升高(P<0.05)。在HR(心率)方面,组间两两比较差异无统计学意义(P>0.05)。见表1。

表1 大鼠门脉压力相关指标
2.2天然牛磺酸与蛋白相互作用 在微孔板中加入BCA工作液后,混合溶液出现显色反应,颜色随着时间反应不断加深。以不含BSA的样品的光吸收值作为空白对照,绘制标准曲线图(图1)。根据BSA标准曲线图计算出待测样品浓度。见表2。

图1 BSA标准曲线
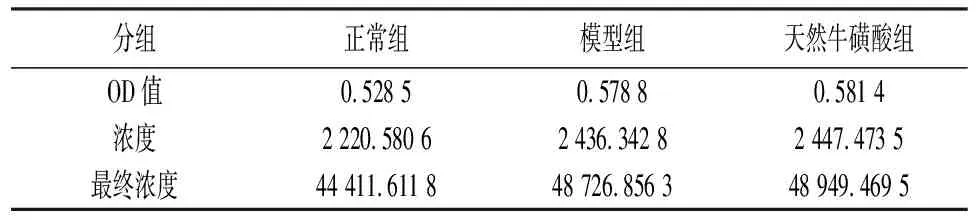
表2 各组肝硬化大鼠肝脏组织蛋白浓度(mg/mL)
2.2.1天然牛磺酸与肝硬化门静脉高压大鼠蛋白荧光光谱 温度在291 K、301 K、311 K时,HSA浓度固定,逐渐增加天然牛磺酸浓度测出的荧光发射光谱图见图2、3。随着天然牛磺酸浓度的增加,不同温度下HSA荧光强度从0到14出现明显而规律的下降,即说明HSA的荧光发生了猝灭。此外,17.8 ℃、27.8 ℃、37.8 ℃时均在331 nm附近出现荧光的最大峰,不同温度下的最大发射波长均出现轻微蓝移,蓝移可达4.3 nm(327.3~331.6 nm),蓝移表明色氨酸残基的极性较弱(或疏水性较强)。该现象表明天然牛磺酸中药物小分子可能与 HSA 相互作用生成复合物,其空间构象可能在一定程度上发生变化。
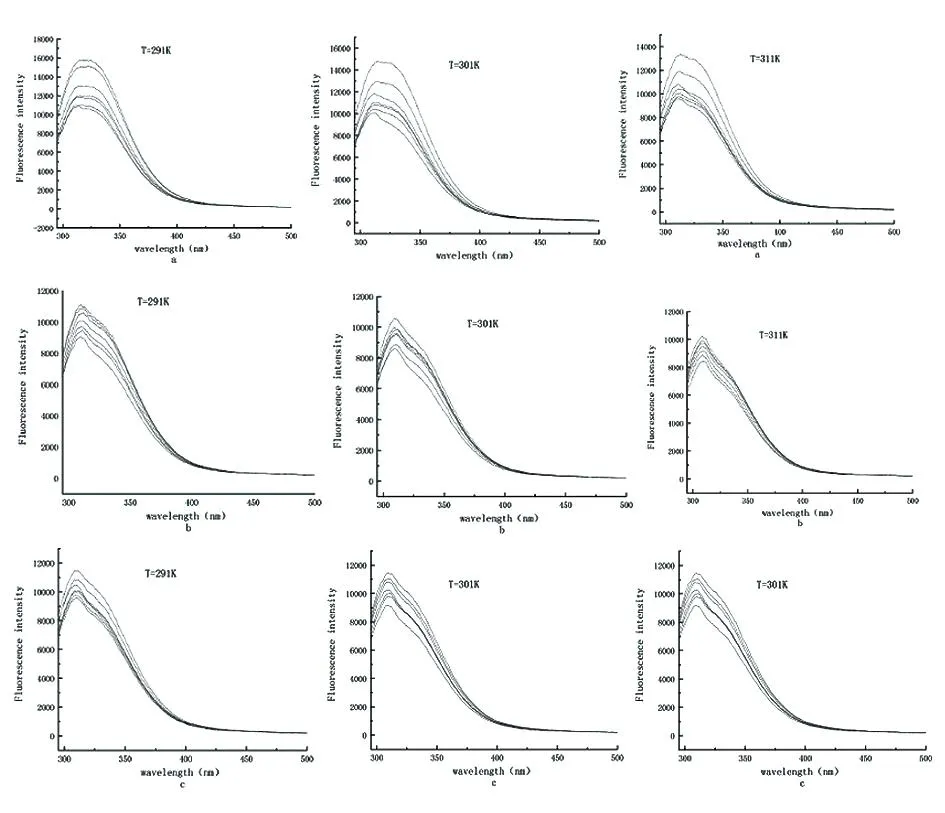
图2 不同温度下天然牛磺酸与大鼠肝脏组织蛋白荧光发射光谱(一组)

图3 不同温度下天然牛磺酸与大鼠肝脏组织蛋白荧光发射光谱图(二组)
2.3荧光猝灭 根据图2、3,运用方程(1)绘制了在不同温度下天然牛磺酸与大鼠蛋白的Stern-Volmer图(图4)。
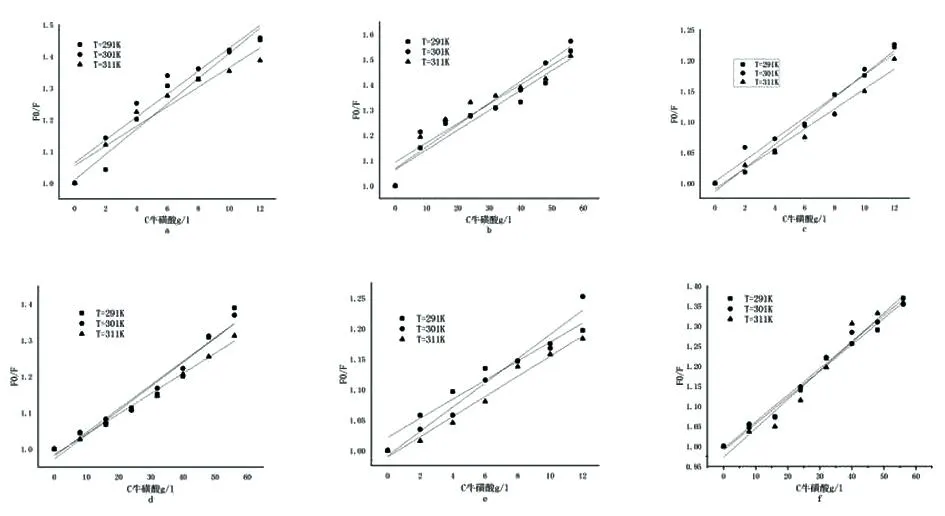
图4 大鼠肝脏组织蛋白与天然牛磺酸体系的两组荧光猝灭SV曲线
基于图2、3中的图形,运用方程(1)绘制了图4的SV曲线图,根据图线的斜率和截距,计算出相应的天然牛磺酸与大鼠蛋白相互作用的动态猝灭常数及猝灭速率,结果见表3。
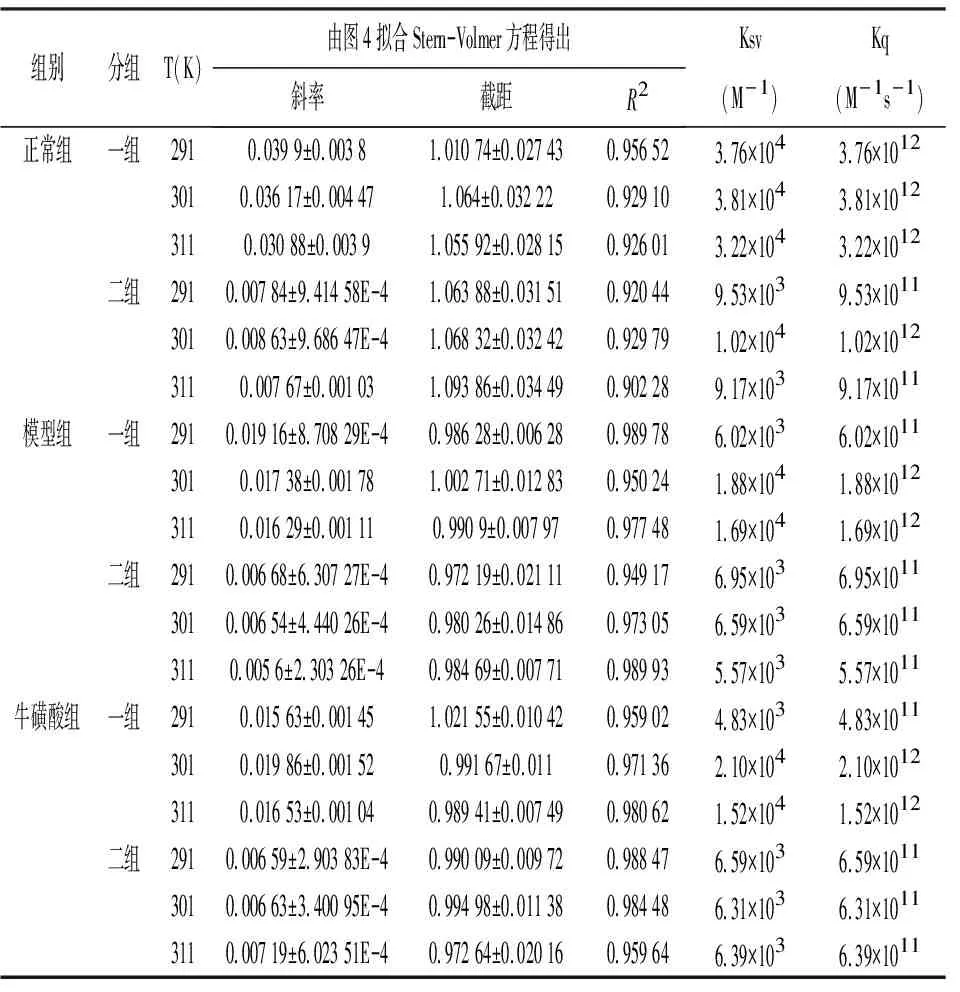
表3 大鼠肝脏组织蛋白与天然牛磺酸反应的两组Stern-Volmer常数
2.4结合常数和结合位点 结合图4、Stern-Volmer 方程求出Ksv、Kq。由表3可知当温度为291 K、301 K时Kq均大于最大动态猝灭速率2.0×10100L/(mol·s),实验结果表明,天然牛磺酸对HSA的荧光猝灭是天然牛磺酸-HSA复合物形成的结果,荧光猝灭是静态猝灭的可能性较大,对于静态淬火过程,根据方程(2)对淬火数据进行了分析,得出对数曲线(图5),显示了HSA-天然牛磺酸结合的线性依赖关系;线性回归分析(表4)列出了不同温度与大鼠蛋白相关的天然牛磺酸的结合常数Ka和结合位点n。
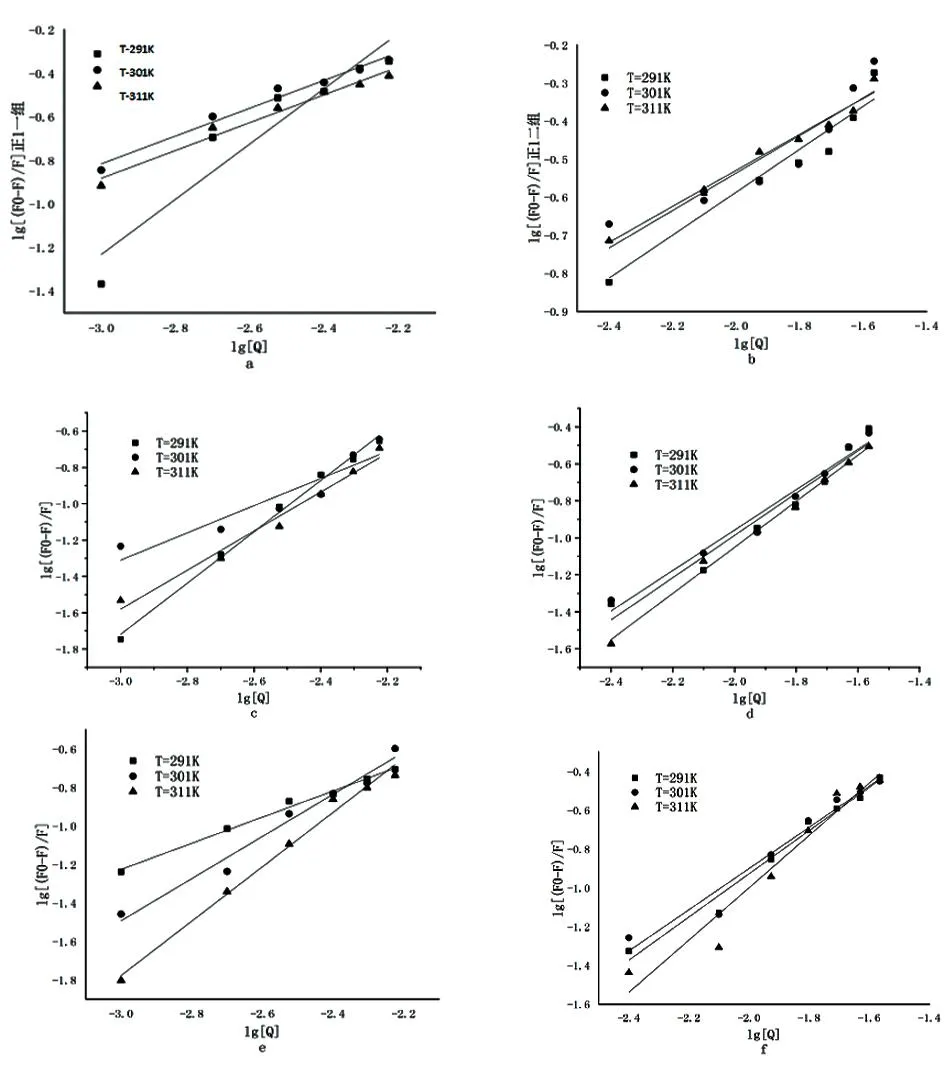
图5 肝脏组织蛋白与牛磺酸体系的两组双对数曲线
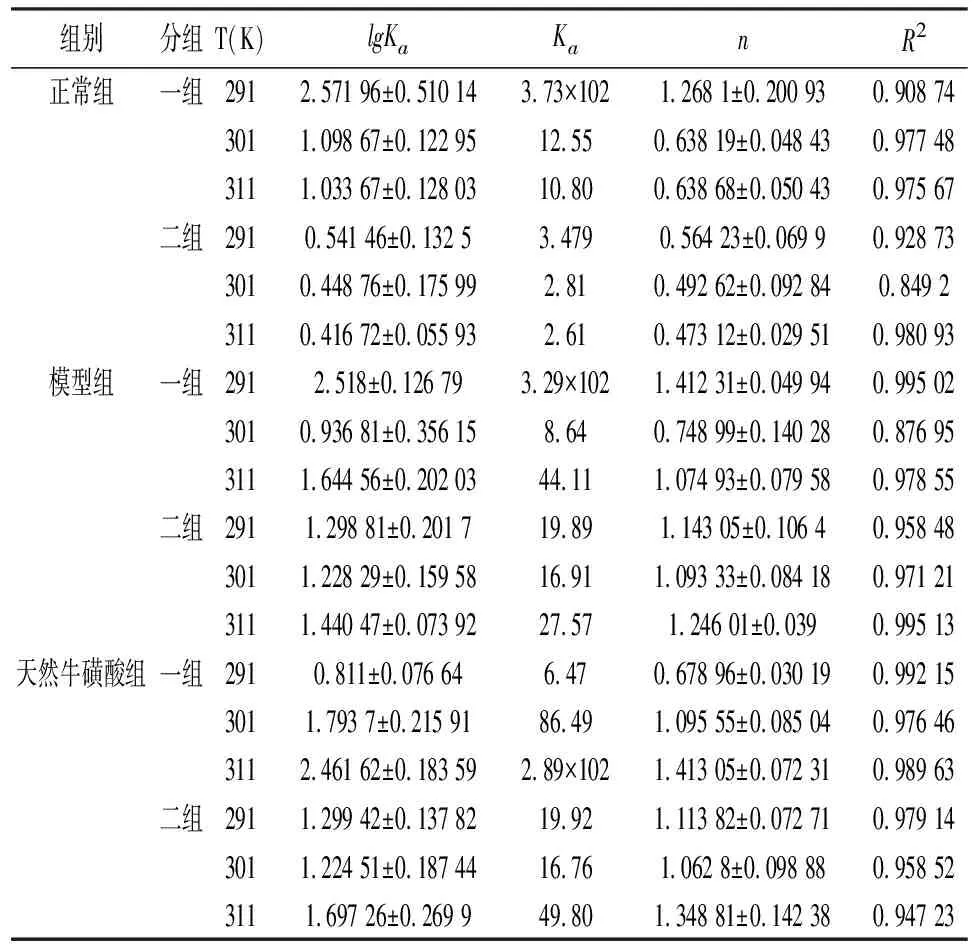
表4 天然牛磺酸与大鼠肝脏组织蛋白反应的两组结合常数及结合位点数
2.5热力学参数和结合力的性质 为了解释天然牛磺酸与大鼠蛋白相互作用的能量变化,用van't Hoff图计算了热力学参数。在△H近似恒定的假设下,给出了天然牛磺酸与大鼠蛋白结合的van't Hoff关系(图6),显示了从拟合线原点处的斜率和纵坐标获得的结合位点的△H和△S的值,根据公式(4)计算出△G(表5)。
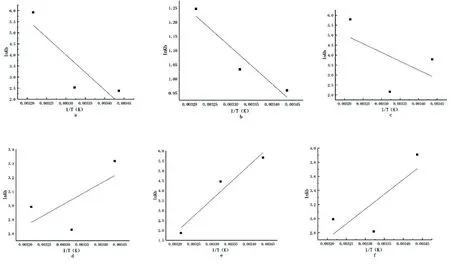
图6 天然牛磺酸与大鼠肝脏组织蛋白的两组van't Hoff曲线
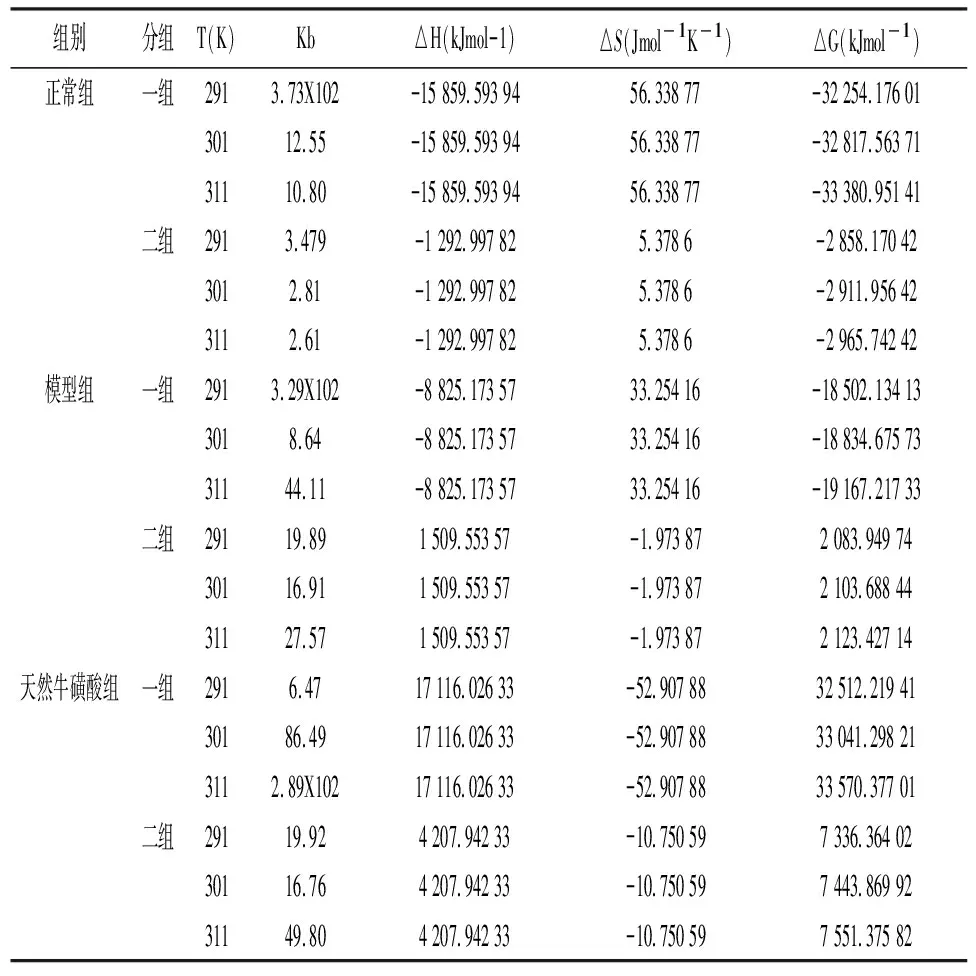
表5 天然牛磺酸与大鼠蛋白体系的SV对数方程结合常数Ka值及相关热力学参数
2.6Foster能量转移 将天然牛磺酸的UV光谱与大鼠蛋白荧光光谱绘制光谱重叠图如图7所示,在各组组织蛋白的荧光发射光谱和天然牛磺酸的吸收UV光谱之间有光谱重叠。根据Forster理论,能量传递效率E定义为上述公式(5)-(8)。其中r是从配体到蛋白质色氨酸残基的距离,R0是Forster临界距离,在该距离下50%的激发能量转移到受体。它可以用Forster公式从施主发射光谱和受主吸收光谱中计算出来,即可以计算天然牛磺酸-HSA系统的结合距离,结果见表6。

图7 大鼠蛋白荧光光谱和天然牛磺酸的紫外光谱重叠图
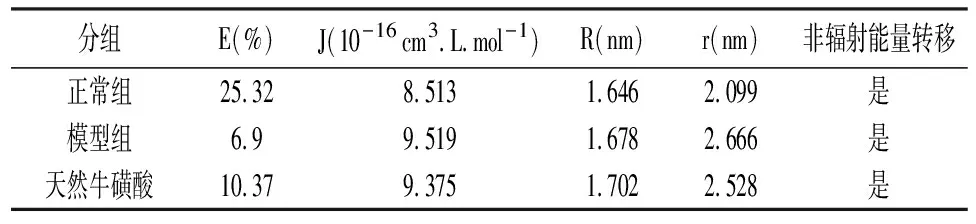
表6 各组非放射性能量转移相关参数
3 讨论
天然牛磺酸在各种器官和组织成分中起着重要的生理和病理作用,这些作用包括渗透调节、膜稳定、调节钙水平、抗氧化、抗凋亡、抗炎和抗脂质活性,其中抗氧化作用能影响细胞增殖、炎症和胶原组织[15]。天然牛磺酸含量降低与组织生理稳态失衡可能会导致骨骼肌,心脏,肝脏和脂肪组织的能量代谢失衡[16]。由表1及图1实验结果再次证实天然牛磺酸具有抗肝纤维化及抑制肝硬化门脉高压作用。
荧光猝灭是由猝灭剂与荧光团之间的碰撞或形成络合物而引起样品荧光强度降低的过程,包括激发态反应、分子重排、能量转移、基态复合物的形成和碰撞猝灭[17],通常分为动态猝灭和静态猝灭[14]。动态猝灭过程是荧光团和猝灭剂分子在介质中扩散的结果,只影响荧光团的激发态,不改变吸收光谱。静态猝灭是由于荧光团和猝灭剂分子之间形成暗色络合物,经常导致吸收光谱的变化。图2、3得出正常组、模型组、天然牛磺酸组大鼠蛋白在不同温度下,随着天然牛磺酸浓度逐渐增加,一组,二组均出现明显而规律地下降,说明各组大鼠蛋白与天然牛磺酸体系的荧光发生了相互作用。由于静态猝灭时配合物的稳定性降低,猝灭速率常数随温度的升高而减小。相反,动态猝灭速率常数会随着温度的升高而增加,因为温度越高,猝灭剂的扩散就越快,因此碰撞猝灭的量就越大[18]。由表3可知不同温度天然牛磺酸的Kq均大于最大动态猝灭速率2.0×1010L/( mol·s),可以判定天然牛磺酸对各组大鼠蛋白的荧光猝灭机制均为静态猝灭。此外,各组在不同温度时均在331~309 nm附近出现荧光的最大峰,而且最大发射波长均出现轻微蓝移,蓝移可达1~2 nm(308~331 nm),蓝移表明色氨酸残基的极性较弱(或疏水性较强)。该现象说明天然牛磺酸可能与组织蛋白相互作用从而使其空间构象在一定程度上发生变化生成复合物。
由表4可以观察出不同温度天然牛磺酸与正常组蛋白反应的结合位点数近0.5,说明天然牛磺酸与正常组蛋白结合比例约为0.5∶1。推测正常组的结合过程属于静态猝灭,因为表观结合常数Ka随着温度的升高值减小,证明了随着温度升高天然牛磺酸与正常组蛋白结合产生的复合物的稳定性下降。而模型组,天然牛磺酸组蛋白与天然牛磺酸的结合位点数均近1,说明天然牛磺酸与两组蛋白结合比例约为1∶1。模型组表观结合常数Ka随着温度的升高无明显规律,猝灭机制是动态猝灭或静态猝灭待进一步验证。天然牛磺酸组表观结合常数Ka随着温度的升高而升高,随着温度升高两者之间结合作用增强,结合产生的复合物的稳定性上升。
药物和生物分子之间的相互作用力可能包括静电相互作用、多个氢键、范德华相互作用、抗体结合位点内的疏水和空间接触等[12]。蛋白质反应的热力学参数的显著性和大小可以解释对蛋白质稳定性有贡献的主要作用力。从热力学角度看,△H>0和△S>0表示疏水相互作用,△H<0和△S<0表示范德华力或氢键形成,△H<0和△S>0表示静电作用力。表5显示了从拟合线原点处的斜率和截距获得的结合位点的△H和△S值。从表5看出正常组蛋白两组△G均为负值,表明正常组蛋白结合过程是自发。两者相互作用的△H和△S值表明,结合主要是熵驱动的,焓对其不利,是静电作用力在反应中起主要作用。模型组蛋白一组△G均为负值,但二组△G均为正值,可能受天然牛磺酸浓度影响,低浓度结合过程符合自发。天然牛磺酸组两组△G均为正值,表明两者相互作用过程不是自发。两者相互作用的△H和△S值表明△G值的主要来源是△H项的较大贡献,而△S因子的贡献很小。因此,天然牛磺酸组与天然牛磺酸之间的相互作用可能是氢键和范德华作用。
荧光共振能量转移(FRET)是研究蛋白质-配体相互作用和评估蛋白质的色氨酸残基与配体之间距离的可靠方法。表6中结果显示各组供体到受体的距离r<7 nm,表明能量从蛋白到天然牛磺酸的能量转移发生可能性很大,这也符合FRET的条件,表明天然牛磺酸与组织蛋白之间存在静态猝灭作用。
药物与蛋白质大分子的相互作用是药物发生药理效应的重要途径,它可以影响生物活性和毒性,结合参数有助于药代动力学研究和剂型设计。通过光谱法观察药物与大分子相互作用前后的光谱对比,与传统的亲和层析、尺寸排斥层析、平衡透析、超滤等方法相比,光谱法具有灵敏度高、分析时间较短等优点。实验结果表明,天然牛磺酸可能通过改变CCL4诱导的肝硬化门脉高压大鼠的肝脏组织蛋白结构而达到改善肝组织损伤及血流状态的作用。

