miR-10b 通过激活 KLF4/Notch-1/STAT3 信号途径加速腹主动脉瘤的进展
郭 畅,刘 欣,李妍洁,张明明
(1.华北理工大学临床医学院,河北 唐山 063210;2.河北省人民医院临床医学研究中心,河北 石家庄 050057;3.河北医科大学研究生学院,河北 石家庄 050011)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是病变血管形成的永久性异常扩张或膨出,其血管直径超过正常直径的50%,多由于动脉壁先天性结构异常或后天性病理改变,引起血管壁局部薄弱、张力减退,在血流的不断冲击下形成该种异常结构[1]。研究表明,血管壁慢性炎症、平滑肌细胞的异常增殖、凋亡、基质金属蛋白酶(MMP)表达水平升高、细胞外基质的降解等均促进AAA 病程,这些病理过程之间相互作用,共同加速AAA 的发展[2]。当前对动脉瘤的主要治疗手段局限于外科手术,对于AAA 的具体发病机制尚不明确,因此探究AAA 发病机理以寻找临床潜在治疗靶点,对预防AAA 破裂、降低致死率具有重要意义[3]。
微小RNA(microRNA,miRNA)作为一类内源性、小分子非编码RNA 在基因表达的转录后调节中起到重要作用[4]。近年来,多项研究发现miRNA已成为动脉粥样硬化、腹主动脉瘤等心血管疾病的新的生物学标志物,与疾病的发生、发展密切相关[5]。miR-10b 在多种类型的恶性肿瘤中的作用机制被广泛研究[6,7],但其对AAA 的影响与致病机理鲜少研究,Wågsäter 等[8]发现miR-10b 在AAA 患者血浆内表达明显升高,进而在动脉瘤模型小鼠中发现miR-10b 促进血管壁弹性蛋白降解和中性粒细胞募集进而增加主动脉破裂的风险。目前尚缺乏对miR-10b 促进AAA 恶化的分子机制的深入研究,本文通过动物及细胞模型实验,探讨miR-10b 在AAA病理过程中的分子机制,以期为AAA 的靶向治疗提供可靠依据。
1 材料与方法
1.1 主要试剂与仪器
水合氯醛(ST1002,华北制药厂);Thermo turbofect 转染试剂(R0531)、双荧光素酶检测试剂盒(16161)、胎 牛 血 清(16140071)、1640 培 养 基(11875176)购自赛默飞世尔公司;双荧光素酶载体psi-CHECK-2 由河北省人民医院实验室提供。血管 紧 张 素Ang Ⅱ(A9290)、Masson 染 色 试 剂 盒(G1340)、BCA 试剂盒(PC0020)、SDS-PAGE 凝胶试剂(P1200)、ECL 化学发光液(PE0010)购自美国索莱宝公司;佛波酯PMA(524400)购自美国Sigma公司;miR-10b mimics 及其阴性Nc 对照(杭州启晨生物公司);巨噬细胞CD68 多克隆抗体(BA3638)、a-SMA 抗体(BM002)以及SABC 免疫组化试剂盒(SA1055)、DAB 显色试剂盒(AR1000)购自武汉博士德生物工程有限公司;抗体Notch1(ab52627)、MMP-2 (ab92536) 、MMP-9 (76003) 、KLF4(ab215036)、p-STAT3(ab267373)购 自Abcam 公司 ;DAPI(G1012-100 毫 升) 、BSA 试 剂(GC305006-100g)购自武汉塞维尔生物公司;KLF4抑制剂(HY12302,杭州昊鑫生物);Notch-1 抑制剂(M04536-RVN,北京百奥莱博科技公司);STAT3抑制剂(52926ES10,翌圣生物科技公司);光学显微镜(CX21)、荧光倒置显微镜(型号IX71)购自日本Olympus 公司;慢病毒载体构建相关化学物质购自上海汉恒生物公司;凝胶成像系统(884-S 型,美国Bio-rad 公司)。
1.2 双荧光素酶实验
1.2.1 miR-10b 靶基因预测 利用生物学信息预测软 件targetscan(http://www.Targetscan.org)分 析结果显示KLF4为miR-10b 的靶基因之一,miR-10b与KLF4-3′UTR 有靶向结合位点(图1)。
1.2.2 构建野生型及突变型双荧光素酶载体 从基因库中获取KLF4的基因序列,设计并化学合成KLF4-3′UTR 结合位点的野生型与突变型基因序列的正反链,并行PCR 扩增。纯化PCR 产物后,用限制性内切酶Xh0I.和NotI.酶切37 ℃过夜,再将双酶切后的片段用连接酶连接到psi CHECK-2 载体特异位点,野生型标记为psi CHECK-2-KLF4-3′UTR-wt,突 变 型 标 记 为psi CHECK-2-KLF4-3′UTR-mut。
1.2.3 细胞转染与双荧光素酶活性检测 自上海细胞库购入人单核THP-1 细胞培养于10%胎牛血清+1640 培养基中,细胞培养箱环境为37 ℃、5%CO2。向对数期生长的THP-1 单核细胞内加入PMA 24 小时将其诱导为人THP-1 巨噬细胞,继续培养于配置的1640 完全细胞培养基中。根据Thermo turbofect 转染试剂操作说明将双荧光素酶载体与miR-10b mimic、miRNA-Nc 共同转染至THP-1 巨 噬 细 胞,细 胞 分 组 为:(1)psi CHECK-2-KLF4-3′UTR-wt+miR-10b Nc;(2)psi CHECK-2-KLF4-3′UTR-wt+miR-10b mimic;(3)psi CHECK-2-KLF4 -3′UTR-mut+miR-10b Nc;(4)psi CHECK -2-KLF4-3′UTR-mut+miR-10b mimic。转染完成后继续培养于37 ℃、5%CO2环境,48 h 后收集细胞并裂解、离心,按照双荧光素酶检测试剂盒操作说明规范进行,最后测定相对荧光活性。
1.3 体内实验
1.3.1 AAA 动物模型构建 采用经典血管紧张素Ⅱ(Ang Ⅱ)[9]灌注法造模:20 只apoE-/-小鼠随机分为miR-10b 组:Ang Ⅱ(1 000 ng/kg/min)皮下缓慢泵入+含miR-10b 过表达慢病毒(1×108TU)基因尾静脉注射,和模型组:Ang Ⅱ(1 000 ng/kg/min)皮下缓慢泵入,Ang Ⅱ持续皮下泵入28 d,另取10只同品系假手术小鼠同等剂量生理盐水皮下泵入作空白对照。所有小鼠均从河北伊维沃生物科技有限公司购买,品系为apoE-/-雄鼠(生产许可证号为SCXK(冀)2020-002),平均重量(23±1)g,8~10 周龄,给予同等饲养条件(光照/黑暗时间每日各连续12 h,相对温度19~25 ℃,相对湿度40%~60%,自由饮水和进食),饲养地点为河北省人民医院临床研究中心SPF 级实验动物中心。本实验已通过河北省人民医院医学伦理委员会审查,编号:(2020)科研伦审第(291)号。
1.3.2 病理学染色 所有小鼠在3%水合氯醛腹腔注射麻醉状态下实施解剖,打开胸腔及腹腔,暴露心脏及其相连血管,将4 ℃生理盐水匀速灌注左心室,剥离血管周围脂肪组织及结缔组织,分离出肾下腹主动脉,然后将瘤体组织及正常腹主动脉组织用4%多聚甲醛固定、梯度酒精脱水、二甲苯透明、石蜡包埋后制作成5 μm 厚病理切片,分别行Mssson 染色、CD68+与α-SMA 免疫组化染色、MMP-2与MMP-9 荧光双染,镜下观察病理学形态并拍照记录。
1.3.3 Western-blot 检测 将3 组小鼠的血管组织研磨成组织匀浆,离心提取蛋白,SDS-PAGE 凝胶电泳分离蛋白然后转膜至聚偏二氟乙烯膜上,依次进行5% 脱脂奶粉2 h 封闭、滴加一抗4 ℃过夜、TBST 洗涤、滴加酶标二抗37 ℃孕育2 h,最后经电化学发光凝胶成像系统扫描显影,显示小鼠血管组织 中 蛋 白KLF4、Notch-1、p-STAT3、MMP-2、MMP-9 的表达量。
1.4 体外实验
1.4.1 细胞培养、诱导分化与转染[10]THP-1 细胞培养与诱导分化步骤同1.2.3。利用慢病毒转染miR-10b mimic 及其阴性Nc 对照,分别为miR-10b过表达、miR-10b 正常表达的THP-1 巨噬细胞,并用100 μmol/L 的Ang Ⅱ与转染后的THP-1 巨噬细胞作用1 h,以备药物分组实验。
1.4.2 THP-1 巨噬细胞分组 应用KLF4 抑制剂、Notch-1 抑制剂、STAT3 抑制剂将细胞随机分为:(1)Nc 组;(2)miR-10b mimic 组;(3)Nc+ KLF4 抑制组;(4)miR-10b mimic+ KLF4 抑制组;(5)Nc+Notch-1 抑制组;(6)miR-10b mimic+ Notch-1 抑制组;(7)Nc+STAT3 抑 制 组;(8)miR-10b mimic+STAT3 抑制组。
1.4.3 各组细胞相关蛋白量检测 弃去细胞培养液并用PBS 溶液冲洗两次,用细胞裂解液将上述8组细胞充分裂解,用刮刀及移液枪迅速将细胞碎片和裂解液移至1.5 mL 离心管,离心后留取上清液-20℃保存,而后提取蛋白等步骤同1.2.3,比较各组蛋白表达水平的差异。
1.5 统计学处理
2 结果
2.1 双荧光素酶活性
两组携带KLF4 野生型(wt)3′UTR 载体的相对荧光活性,转染miR-10b mimic 组的显著低于miR-10b Nc 组(P<0.05);而两组携带KLF4 突变型(mut)3′UTR 载体的相对荧光活性无明显差异(P>0.05);同样共转染miR-10b mimic,转染KLF4 突变型(mut)3′UTR 载体组细胞的相对荧光素酶活性明显高于转染KLF4 野生型(wt)3′UTR 载体组(图2)。以上结果说明miR-10b 可靶向作用于基因KLF4。
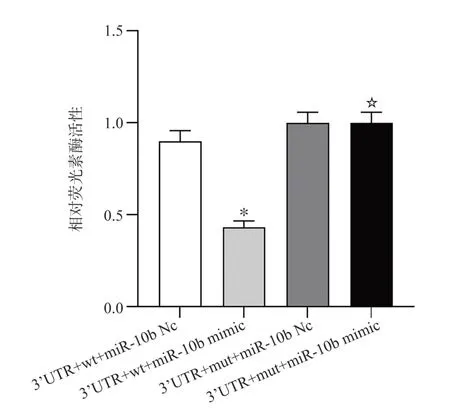
图2 双荧光素酶相对活性分析Fig 2 Analysis of relative activities of dual luciferase enzymes
2.2 体内实验结果
2.2.1 病理学染色结果 Masson 染色发现,3 组小鼠间血管或瘤体直径差异显著(P<0.05),其中miR-10b 组最宽,模型组次之,血管外壁胶原沉积量也呈上升趋势,主动脉纤维化加重。见图3A。

图3 小鼠血管组织病理学染色Fig 3 Histopathologic staining of mouse blood vessels
免疫组化实验可见,CD68+巨噬细胞数量在正常主动脉壁中较少,而动脉瘤血管壁有大量炎症细胞积聚并浸润,与模型组相比,miR-10b 组的这种现象加强了。见表1,图3B。血管平滑肌细胞是组成动脉血管的重要成分,分为收缩型和增殖型两种表型,正常血管以收缩型为主,维持血管的弹性与顺应性,在动脉瘤的发生、发展过程中,会发生两种表型的相互转化,导致以α-SMA 为标志物的收缩表型平滑肌细胞数量大幅减少,继而增加瘤体破裂的风险[11]。本研究发现α-SMA 染色阳性在假手术组最高,miR-10b 组明显减少甚至部分区域为零表达,模型组虽较miR-10b 组表达显著性增多,但仍远少于假手术对照组,可见miR-10b 会促进血管平滑肌细胞的凋亡。见表1、图3C。
表1 3 组小鼠血管组织中物质表达水平比较(±s)Tab 1 Comparison of substance expression levels in vascular tissues of three groups of mice(±s)

表1 3 组小鼠血管组织中物质表达水平比较(±s)Tab 1 Comparison of substance expression levels in vascular tissues of three groups of mice(±s)
注:与假手术组比,aP<0.001;与模型组比,bP<0.001。
组别MMP-2 相对荧光强度MMP-9 相对荧光强度巨噬细胞阳性面积(μM2) 平滑肌细胞阳性面积(μM2)假手术组0.21±0.040.16±0.04模型组28 667±18 031 99 001±17 652a 176 000±13 446 86 999±9 818 a 0.62±0.03 a 0.69±0.04 a miR-10b 组176 333±15 782b 32 667±10 820 b 1.22±0.04 b 1.32±0.05 b FP 184.8 398.4 2 007 1 613<0.001<0.001<0.001<0.001
双荧光染色中,MMP-2 与MMP-9 分别显示绿色荧光和红色荧光,荧光强度在假手术组血管中最弱,在动脉瘤组织中明显增强,miR-10b 组最强。见表1、图3D、3E。
2.2.2 血管组中相关蛋白表达水平 蛋白KLF4 在假手术组、模型组、miR-10b 组表达逐渐减少,蛋白Notch-1、p-STAT3、MMP-2、MMP-9 在3 组中呈升高趋势,且各组间变化显著(P<0.001)。见图4。
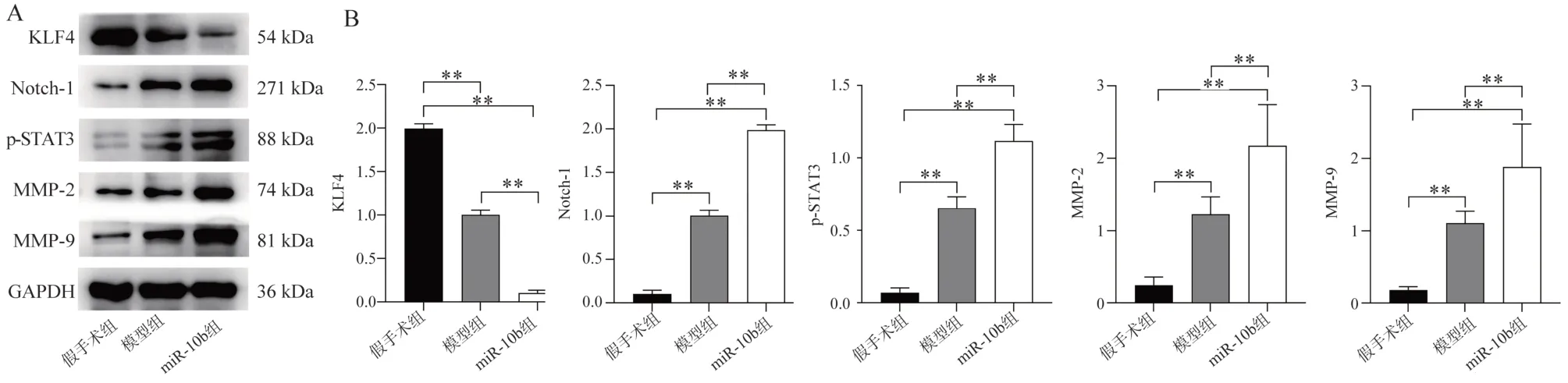
图4 小鼠血管组织中蛋白表达水平比较Fig 4 Comparison of protein expression levels in vascular tissues of mice
2.3 各组THP-1 巨噬细胞中相关蛋白表达水平
(1)、(2)两组细胞间,后者KLF4 表达较少、而Notch-1、p-STAT3、MMP-2、MMP-9 表 达 显 著 偏多,两组间差异有统计学意义(P<0.001),这与2.2.2 的结果相符,说明miR-10b 对动脉瘤组织中相关蛋白表达有影响。见图5。
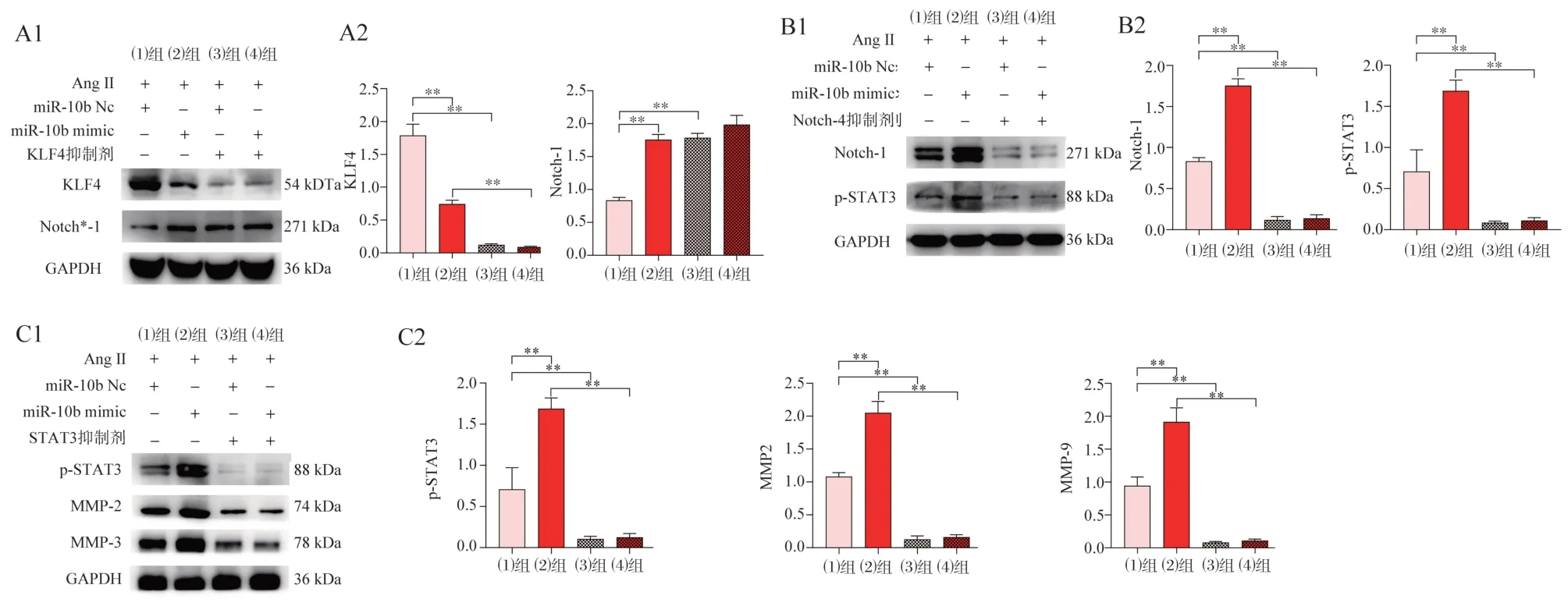
图5 各组THP-1 巨噬细胞中蛋白表达水平比较Fig 5 Comparison of protein expression levels in THP-1 macrophages in each group
(3)(4)组细胞与(1)(2)组细胞相比,KLF4 抑制剂抑制KLF4 表达,而Notch-1 显著增多,间接说明KLF4 靶向下调Notch-1 的功能。见图5A1、A2;(5)(6)组细胞与(1)(2)组细胞相比,Notch-1 被抑制而减少表达,p-STAT3 也随之降低表达,证明Notch-1 可靶向上调p-STAT3 表达。见图5B、B2;(7)(8)组细胞与(1)(2)组细胞相比,p-STAT3 被抑制表达,MMP-2 与MMP-9 表达量也明显降低,可知p-STAT3 直接促进蛋白MMP-2、MMP-9 的表 达。见图5C1,C2。
3 讨论
腹主动脉进行性局部扩张超过3 cm 容易导致腹主动脉破裂,当前主要治疗手段为手术修复,尚缺乏有效治疗的药物。虽然修复技术愈来愈成熟,但由于AAA 破裂的突发性和严重性,常导致抢救无效而死亡[12,13]。为此,本文旨在研究动脉瘤发病的分子机制,寻找预防高风险人群发病、延缓动脉瘤进展的药物靶点。
AAA 发病的分子机制尚不完全清楚,炎症被认为是 AAA 发展的核心因素,贯穿AAA 的整个病程[14]。以巨噬细胞为主的多种炎症细胞浸润至主动脉壁,通过细胞直接接触或分泌细胞因子及蛋白酶,使细胞外基质降解、血管平滑肌细胞凋亡减少,进而发生病理性血管重塑,启动或促进AAA 的扩增[15]。miRNA 是一类高度保守的组织特异性小分子非蛋白质编码RNA,广泛存在于人体各器官与组织中,参与氧化应激和细胞自噬、增殖、凋亡等病理、生理过程[16]。相关研究表明[17],miRNA 参与了调控AAA 的病理过程,通过靶向调节下游基因,激活内皮和血管平滑肌细胞中的信号传导,从而促进炎症,影响动脉瘤形成。有研究人员发现miR-10b对动脉瘤病情发展有促进作用,本文通过生物学信息预测软件发现miR-10b 与KLF4-3′UTR 有靶向结合位点,双荧光素酶实验进一步确定KLF4是miR-10b 的靶基因。本研究结果显示,患有动脉瘤的小鼠动脉组织中KLF4较正常小鼠显著减少,且随着miR-10b 的高表达,KLF4表达下降,血管CD68+巨噬细胞浸润增多及病变程度加重,侧面说明缺乏KLF4 可能为动脉瘤恶化的危险因素。本文使用Ang Ⅱ诱导建立动物模型,Ang Ⅱ能募集并刺激巨噬细胞活化,从而引发炎症反应、促进MMP 表达,引起巨噬细胞的趋化反应,最终导致腹主动脉瘤形成[18]。KLF4在调节巨噬细胞极化方面起着关键作用,巨噬细胞KLF4 会增加其向促炎M1 样表型极化,加重炎症反应和组织损伤,KLF4 对动脉瘤患者有正向保护功能[19]。
Notch-1 信号通路可通过影响血管平滑肌细胞凋亡增加收缩分化,介导巨噬细胞炎症反应参与AAA 疾病进程[20,21]。此外,有研究发现IL-6 可上调STAT3 活性以影响蛋白水解活性巨噬细胞的积累以及MMPs 的表达,STAT3 转录因子的信号传导可 诱 发 动 脉 基 质 蛋 白 水 解[22]。另 外,p-STAT3 是STAT3 的活化形式,在组织和细胞内多以此种形式发挥生物学功能[23]。KLF4、Notch-1、STAT3 之间存在信号传导通路的交汇[24,25]。
MMP-2 和MMP-9 作为MMPs 家族中的重要成员,具有水解细胞外基质、破坏血管壁结构完整性的能力,能导致血管顺应度减退、弹性降低,最终在血流冲击下血管壁局部膨出、动脉瘤形成[26]。大动脉中膜主要由弹性膜、平滑肌和弹性纤维构成,外膜主要是由疏松结缔组织构成,包含丰富的细胞外基质,其中主要成分是弹性纤维和胶原蛋白,免疫荧光双染发现MMP-2 蛋白主要聚集于血管中膜,MMP-9 蛋白主要在血管外膜累积,二者降解血管壁重要支撑成分,造成主动脉壁逐渐变薄和过度基质重塑,是形成病理性血管扩张的必要条件。本实验发现经Ang Ⅱ灌注后的腹主动脉瘤小鼠动脉组织内MMP-2 和MMP-9 蛋白显著增多,转染miR-10b 过表达后,表达水平较模型组更高,同样,用Ang Ⅱ刺激作用后miR-10b 组THP-1 巨噬细胞,较未转染Nc 组的MMP-2 和MMP-9 表达量也显著偏高,Notch-1、p-STAT3 蛋白在各组小鼠和巨噬细胞的表达趋势与MMP-2、MMP-9 相一致,但KLF4表达趋势则与之相反,本文研究亦证实miR-10b 对KLF4 基因具有靶向抑制作用,说明miR-10b 可能通过下调KLF4 继而上调下游分子Notch-1、p-STAT3、MMP-2、MMP-9 的表达,促进动脉瘤的恶化。
但上述分子在AAA 组织中的上下游作用关系尚不明确,故本研究增加体外抑制实验结果发现,抑制KLF4 表达后,Notch-1 表达量显著上升;抑制Notch-1 表达后,p-STAT3 表达随之显著减少;抑制p-STAT3 的 表 达,MMP-2 与MMP-9 表 达 水 平 也 明显减少,提示信号通路可能为KLF4/ Notch-1/STAT3,其 中KLF4 对Notch-1 靶 向 抑 制,Notch-1对STAT3 是正向促进作用,STAT3 对下游靶蛋白MMP-2 和MMP-9 亦为正向调节。动脉瘤发病机制复杂,除本文信号途径传导两种MMPs 表达外,ERK1/2 也是其上游信号分子[27],同时,氧化应激也被认为是动脉瘤的发生机制之一[28],并可作为辅助AAA 管理的新的生物学标志物[29]。
综上所述,miR-10b 通过影响KLF4/Notch-1/STAT3 信号通路,引起动脉瘤组织中MMP-2、MMP-9 表达增加,从而加速AAA 的进程。
作者贡献度说明:
郭畅:调研整理文献,设计研究方案及论文框架,起草论文;刘欣、李妍洁:参与研究,实施研究过程,采集整理数据,统计分析;张明明:提出研究选题,获取技术或材料支持,指导性支持。
所有作者声明不存在利益冲突关系。

