埃索美拉唑联合EGFR 抑制剂AG1478 对胃癌细胞增殖、凋亡和自噬的影响
孙满满,赵 涵,巴 楠,袁 源,李 文,李飞艳,张自森
(1.郑州大学第五附属医院放射治疗科,河南 郑州 450052;2.郑州大学第二附属医院重症医学科,河南 郑州 450052;3.郑州大学第五附属医院肿瘤内科,河南 郑州 450052)
胃癌是常见的癌症之一,在全球范围内发病率居第五位,死亡率居第四位[1]。化疗是晚期胃癌的主要手段,然而,胃癌化疗进展有限,难以在提高生存方面取得进一步突破[2]。胃癌靶向治疗近年来取得积极进展,曲妥珠单抗联合化疗成为HER-2 阳性胃癌标准用药方案[3]。由于曲妥珠单抗在应用中的耐药性,以及大多数胃癌为HER-2 阴性表达,胃癌个体化治疗迫切需要探索新的策略。
EGFR 表达与胃癌发生及预后密切相关,EGFR 过表达胃癌的个体化治疗已开始受到临床关注和探索[4]。EGFR 介导的细胞凋亡与自噬是潜在的抗癌靶点[5],共靶向EGFR 和自噬可抑制卵巢癌细胞生长[6]。AG1478 是一种具有抗癌活性的EGFR酪氨酸激酶抑制剂,联合多种药物均显示出协同效应[7,8]。埃索美拉唑在多种恶性肿瘤细胞中呈现细胞毒性,影响细胞增殖、迁移、凋亡、自噬、药物敏感性和逆转耐药[9]。本课题组近期研究发现,埃索美拉唑通过PI3K/AKT/FOXO3a 信号通路下调EGFR 表达抑制胃癌细胞增殖、侵袭、迁移,诱导细胞自噬与凋亡[10]。这表明EGFR 是埃索美拉唑调控靶点之一,这也为探索EGFR 高表达胃癌个体化治疗策略提供了基础和有益方向。
本研究发现埃索美拉唑和EGFR 抑制剂AG1478 抑制了胃癌细胞增殖、迁移,诱导了凋亡及自噬,两者联合具有协同作用,这可能与下调EGFR表达和抑制AKT 信号机制有关。埃索美拉唑和EGFR 抑制剂联合可能代表了EGFR 高表达胃癌个体化应用的潜在策略。
1 材料与方法
1.1 细胞与主要试剂设备
人胃癌AGS 和SGC-7901 细胞株均购自中科院上海细胞库。抗EGFR(ab52894)抗体购自英国abcam 公司、抗P-AKT(T40068)抗体购自上海艾比玛特有限公司,抗AKT(#4685)、LC3B(#3868)、PI3K(#3011)抗体购自美国Cell Signaling Technology 公 司, cleaved-PARP(13371-1-AP)、P53(10442-1-AP) 抗 体 和 羊 抗 兔 HRP 抗 体(SA00001-2)购自武汉三鹰技术有限公司。埃索美拉唑(esomeprazole,ESO)购自阿斯利康制药有限公司,AG1478 购自美国MedChemExpress 公司。
1.2 实验方法
1.2.1 细胞培养 AGS 细胞采用F12K 完全培养基培养,SGC-7901 细胞采用1640 完全培养基培养,将细胞置于37℃、5%CO2的培养箱中进行培养,1 d~2 d 换液,当细胞密度长至80%~90%时进行传代。
1.2.2 细胞活力检测 将细胞以5 000 个/孔的密度接种于96 孔板中,用不同浓度的ESO 和AG1478处理,分别培养细胞6、12、24、48 h 后,加入CCK-8试剂,继续培养2 h 后,用酶标仪检测细胞在450 nm波长处的吸光度(OD)值。
1.2.3 EdU 法检测细胞增殖 取对数生长期细胞(5×104个/mL)接种于35 mm 培养皿中,分别用ESO、AG1478、埃索美拉唑与AG1478 联合处理细胞24 h 后,固定、洗涤、促透和染色,在共聚焦显微镜下拍照。
1.2.4 细胞免疫荧光法 用ESO 和AG1478 分别及联合处理在35 mm 培养皿中生长的细胞24 h。脱 水 固 定30 min,PBS 清 洗3 次,BSA 室 温 封 闭60 min 后,加入一抗置于4 ℃冰箱过夜,PBS 洗涤,加入二抗孵育1 h。加入DAPI,室温避光孵育10 min,PBS 浸洗2 次后置于共聚焦显微镜下观察。
1.2.5 细胞迁移实验 将细胞以每孔4×104个细胞接种于Transwell 小室的上室,加入不含胎牛血清、含不同药物的200 μL 培养液,在下室中加入600 μL完全培养液,置于培养箱中继续培养24 h,多聚甲醛室温固定20 min,结晶紫染色15 min,于倒置显微镜下拍照,计算每个视野的细胞数。
1.2.6 细胞凋亡实验 将5 ×104个细胞接种于60 mm 培养皿中,细胞贴壁后,用ESO 和AG1478 分别及联合作用于胃癌细胞,24 h 后将各组细胞收集于离心管中,在每管中加入400 μL Binding Buffer、5 μL AnnexinV-FITC,常温避光孵育15 min。上机检测前5 min,避光加入5 μL PI,用流式细胞仪检测并记录。
1.2.7 细胞划痕实验 将细胞以5×104/mL 的浓度接种于六孔板中,置于培养箱中过夜。用10 μL 灭菌枪头沿直尺标记每个孔的中心,并在显微镜下拍摄划痕处多个点的照片,记录面积S1。用ESO 和AG1478 分别及联合处理细胞24 h 后,取与0 h 相同的固定点,再次拍照,记录面积S2。划痕宽度用image pro Plus6.0 软件测量,划痕愈合率=(S1-S2)/S1×100%。
1.2.8 Western blot 法检测目的蛋白 在根据实验条件用不同药物处理细胞24 h 后,提取各组细胞蛋白。制备SDS-PAGE 凝胶,加入蛋白样品,进行电泳和转膜。将转好的PVDF 膜封闭1 h 后,用一抗在4 ℃冰箱中孵育过夜,二抗在室温下孵育1 h,最后用ECL 化学发光试剂盒显影整张膜,用Chemi Capture 软件导出实验条带图像,用ImageJ 软件分析目标条带的灰度值。
1.3 统计学方法
所有实验重复3 次,结果用SPSS21.0 统计软件进行数据分析,计量资料用均数±标准差(±s)表示,两种细胞24 h 和48 h 的IC50对比采用两独立样本t检验;两种细胞4 组的迁移率、划痕愈合率、增殖率、凋亡率、自噬情况及各组蛋白表达水平均采用2×2 析因设计的方差分析。检验水准α=0.05。
2 结果
2.1 ESO 和AG1478 对胃癌细胞活力及AG1478对EGFR 蛋白表达的影响
结果见图1、2 及表1。ESO 和AG1478 以浓度和时间依赖的方式抑制胃癌细胞AGS 和SGC-7901细胞的活力(图1A、B 及图2A)。Western blotting结果(图2B)显示,随着AG1478 浓度的升高,AGS和SGC-7901 细胞的EGFR 蛋白表达均降低,表明AG1478 能 够 降 低EGFR 表 达。
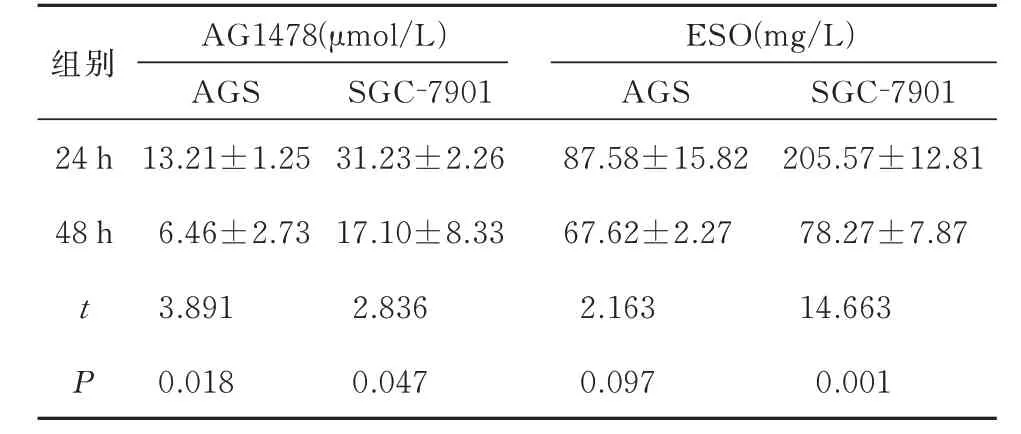
表1 AG1478和ESO作用于细胞24 h与48 hIC50的比较(n=3)Tab 1 Comparison of 24 h versus 48 h IC50 of AG1478 and ESO action on cells(n=3)
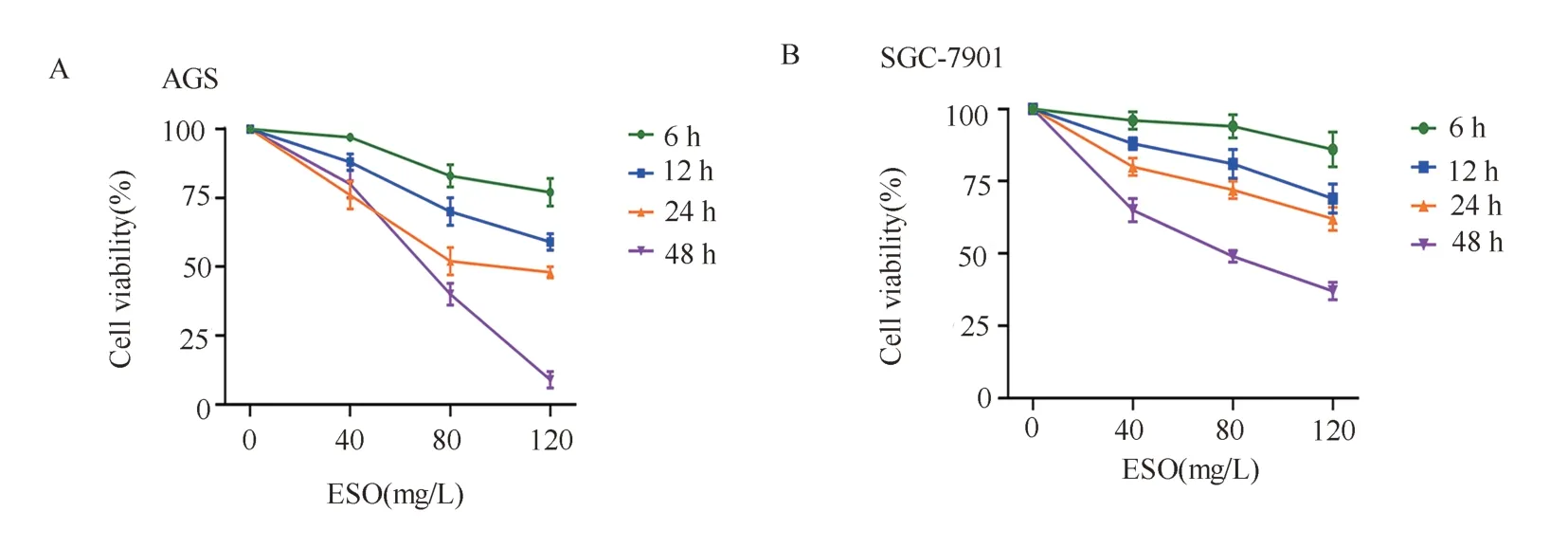
图1 ESO 对胃癌细胞活力的影响Fig 1 Effect of ESO on the viability of gastric cancer cells
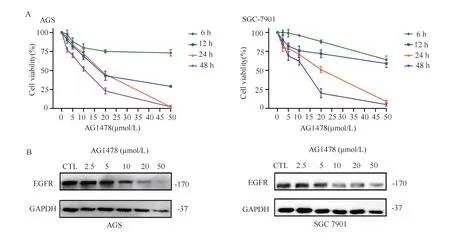
图2 AG1478 对胃癌细胞活力和EGFR 蛋白表达的影响Fig 2 Effect of AG1478 on cell viability and EGFR protein expression in gastric cancer cells
2.2 ESO 联合AG1478 对胃癌细胞增殖的影响
根据表1 可知AG1478 和ESO 单独作用胃癌细胞24 h 和48 h 后的IC50值,分别采用浓度为10 μmol/L(AGS 细胞)和20 μmol/L(SGC-7901 细胞)的AG1478 与80 mg/L 的ESO 单独及联合处理胃癌细胞24 h(后续实验也采用此药物浓度)。ESO和AG1478 均能降低胃癌AGS 和SGC-7091 细胞的增殖率,且两者联合具有协同作用(P<0.05),见表2;ESO 及AG1478 均能降低AGS 细胞和SGC-7901细胞中C-myc 和EGFR 蛋白的表达,且两者联合对下调C-myc 蛋白的表达具有协同作用(P<0.05),见图3、表3。
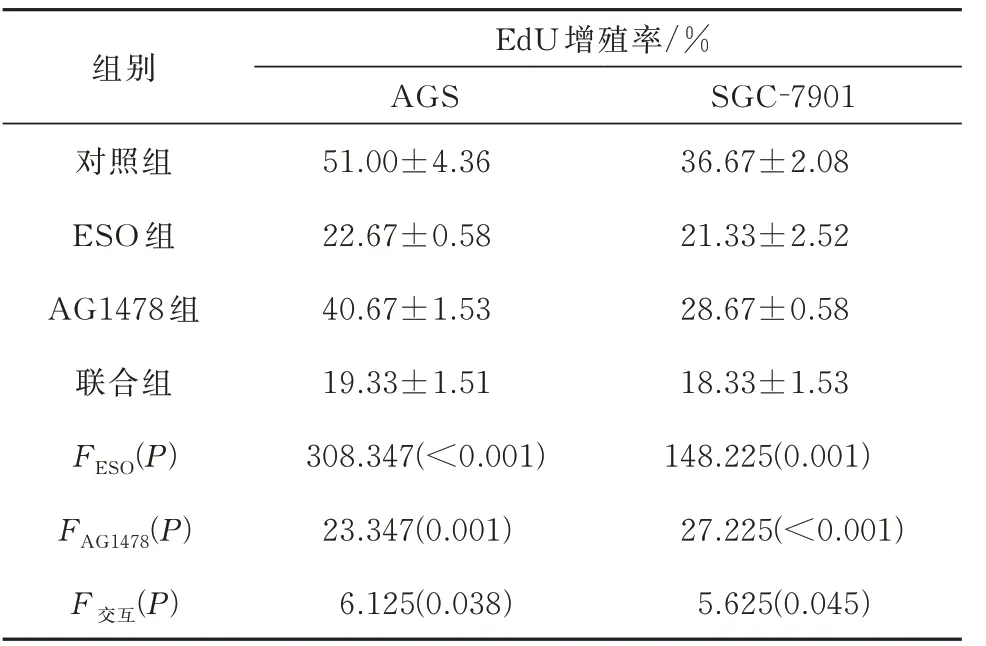
表2 各组细胞增殖率的比较(n=3)Tab 2 Comparison of cell proliferation rate in each group(n=3)
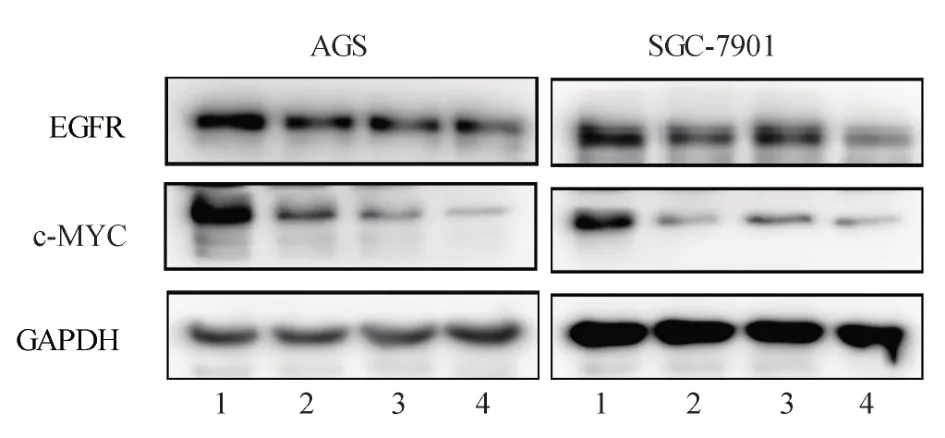
图3 不同组别两种细胞中EGFR 和C-myc 蛋白的表达Fig 3 Expression of EGFR and C-myc proteins in different groups of both cells
2.3 ESO 联合AG1478 对胃癌细胞迁移的影响
结果见图4 及表4。不难发现ESO 和AG1478能够抑制胃癌AGS 和SGC-7901 细胞的迁移,两者联合效果具有协同作用(P<0.05)。
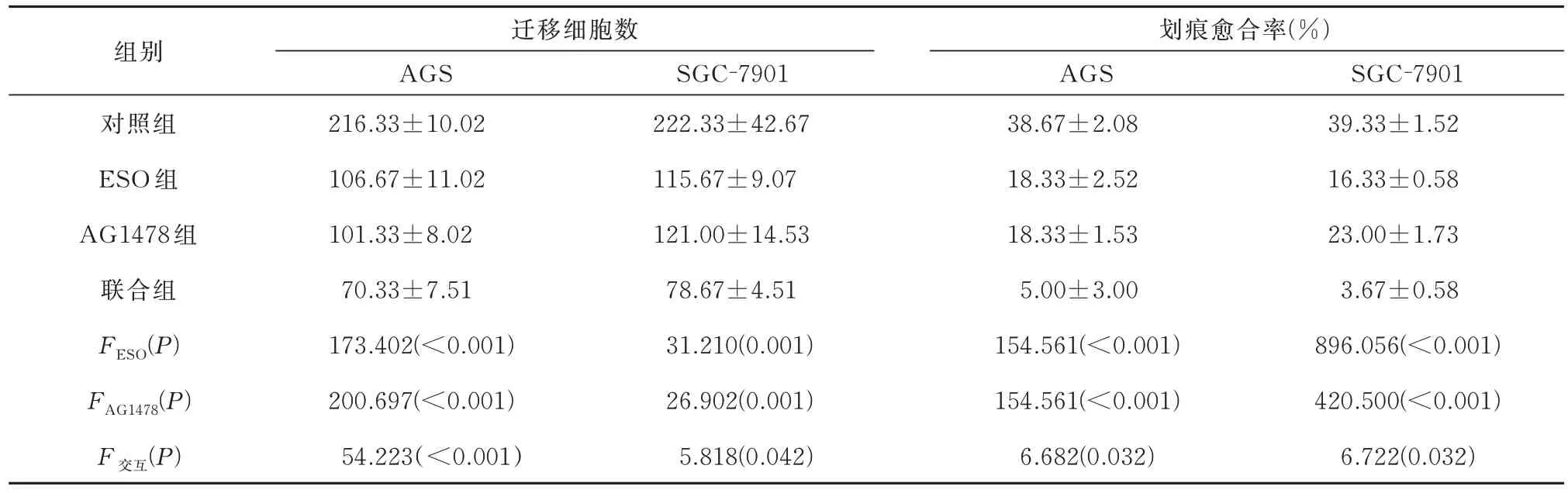
表4 各组细胞迁移细胞数及划痕愈合率的比较(n=3)Tab 4 Comparison of the number of migrating cells and the rate of scratch healing in each group(n=3)
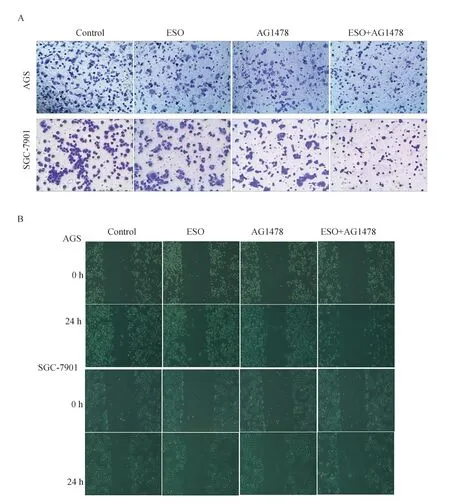
图4 ESO 联合AG1478 对胃癌细胞迁移的影响Fig 4 Effect of ESO combined with AG1478 on migration of gastric cancer cells
2.4 ESO 联合AG1478 对胃癌细胞凋亡的影响
ESO 和AG1478 都 能 促 进AGS 和SGC-7901细胞的凋亡,两者联合对胃癌细胞凋亡具有协同作用(P<0.05),见图5 及表5。同时Western blot 结果显示(表6),ESO 和AG1478 能 够促进凋亡蛋白cleaved-PARP 和P53 的 表 达。

表5 各组细胞流式细胞仪检测凋亡率的比较(n=3)Tab 5 Comparison of apoptosis rate detected by flow cytometry in each group of cells(n=3)
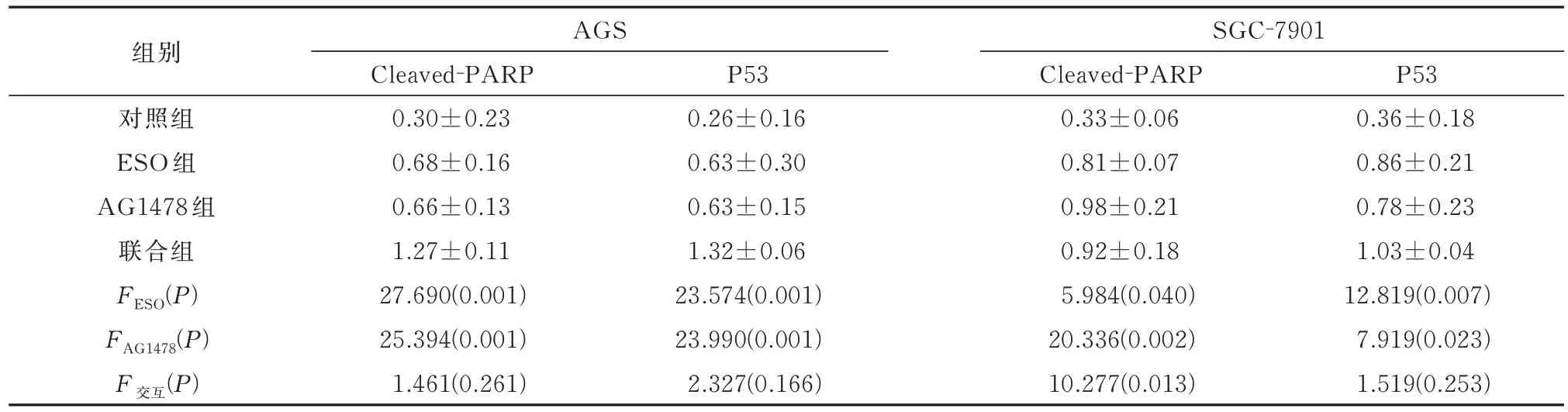
表6 两种细胞各组cleaved-PARP 和P53 蛋白表达的比较(n=3)Tab 6 Comparison of cleaved-PARP and P53 protein expression in each group of the two cell types(n=3)
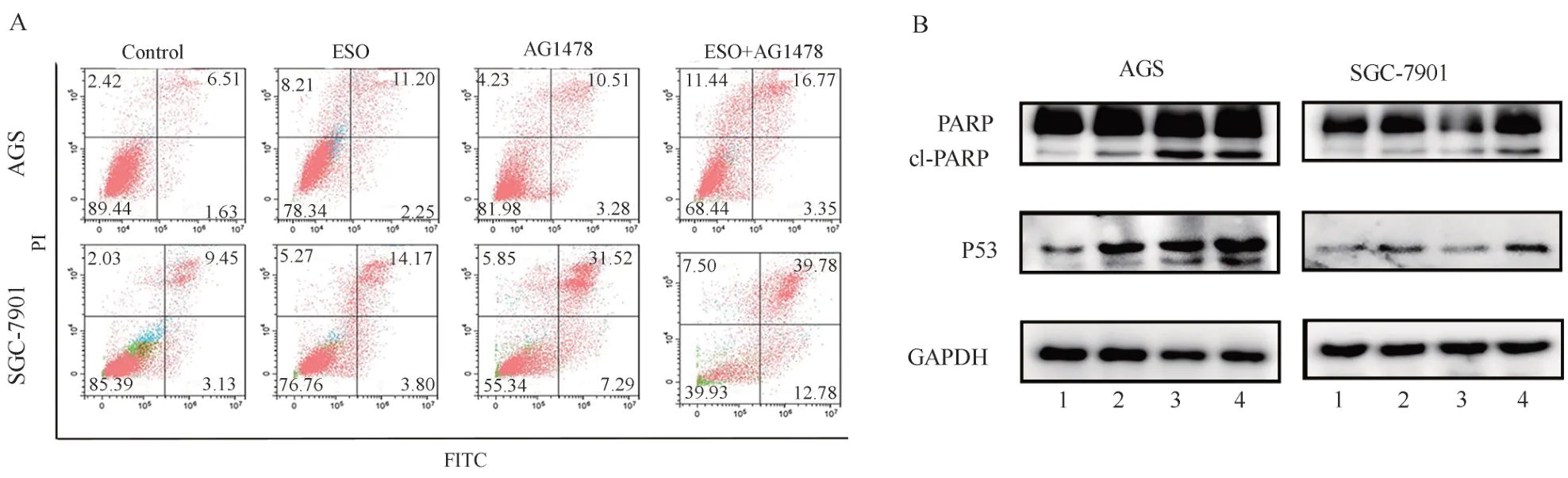
图5 ESO 联合AG1478 对胃癌细胞凋亡的影响Fig 5 Effect of ESO combined with AG1478 on apoptosis of gastric cancer cells
2.5 ESO 联合AG1478 对胃癌细胞自噬的影响
结果见图6 及表7。ESO 和AG1478 均能诱导胃癌AGS 和SGC-7901 细胞自噬,且在AGS 细胞中两者联合对LC3B 蛋白表达下调具有协同作用(P<0.05)。
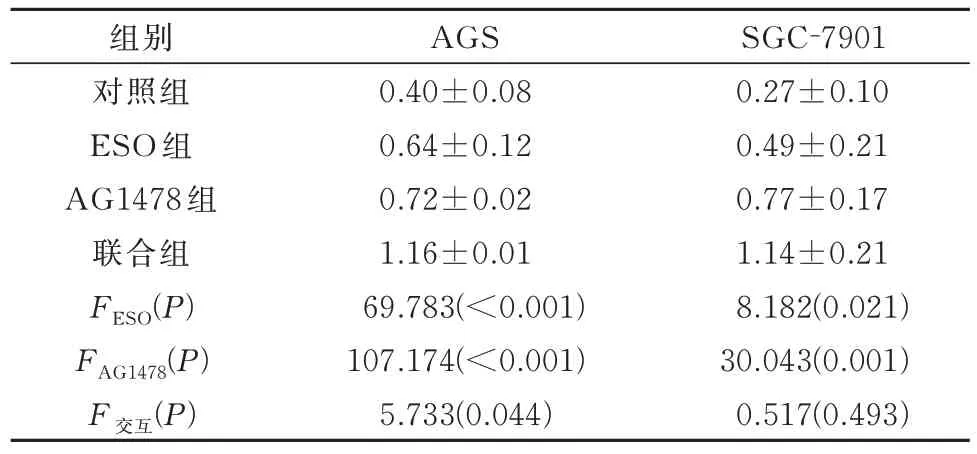
表7 各组细胞LC3B 蛋白表达量的比较(n=3)Tab 7 Comparison of LC3B protein expression in cells of each group(n=3)
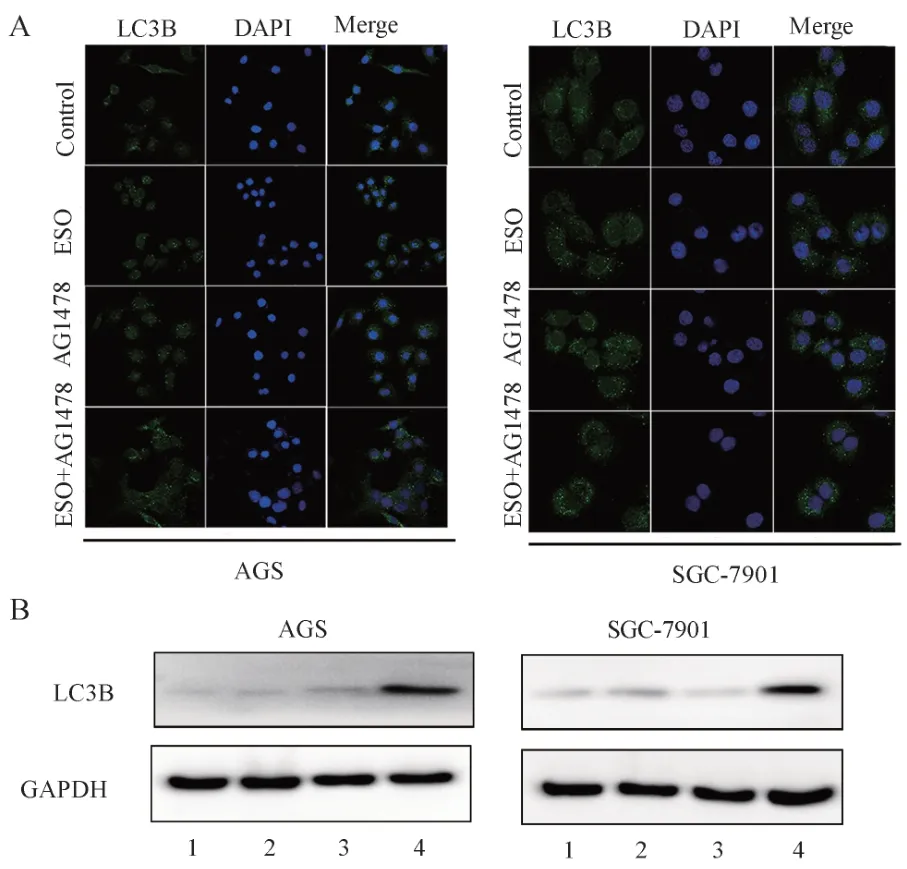
图6 ESO 联合AG1478 对胃癌细胞自噬的影响Fig 6 Effect of ESO combined with AG1478 on autophagy in gastric cancer cells
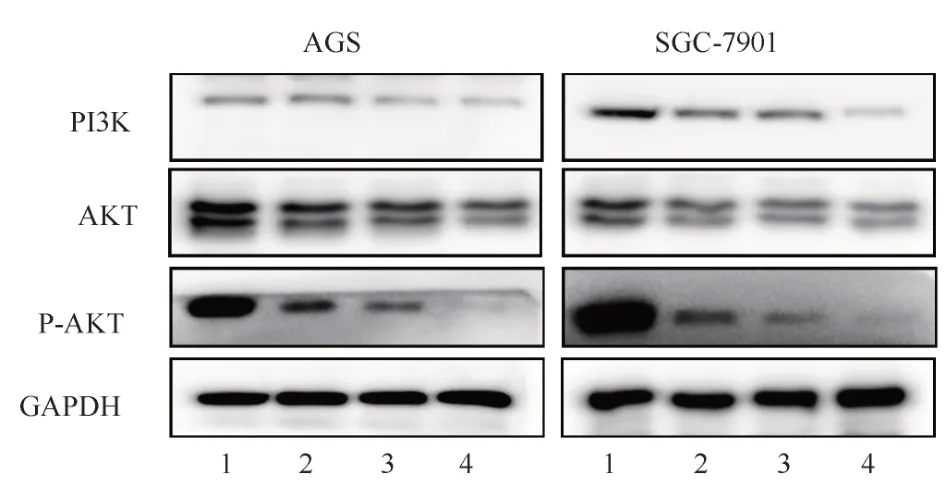
图7 不同组别两种细胞中PI3K、AKT和P-AKT蛋白的表达Fig 7 Expression of PI3K、AKT and P-AKT proteins in different groups of both cells
2.6 ESO 联 合AG1478 对PI3K/AKT 信号通路蛋白表达的影响
ESO 和AG1478 分别及联合处理后,两组细胞中PI3K、AKT 及P-AKT 蛋白表达量均下降,且两者联合对促进P-AKT 蛋白表达下降具有协同作用(P<0.05)结果见表8、9。
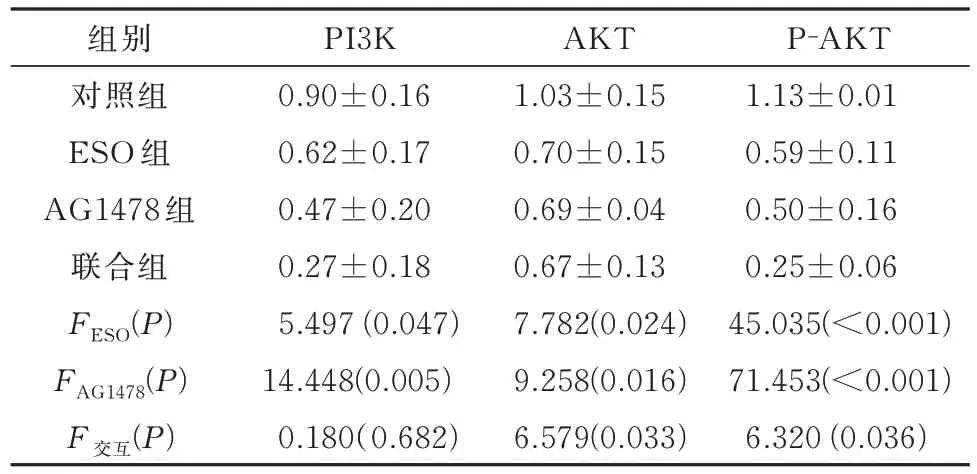
表8 AGS细胞中各组PI3K、AKT和P-AKT蛋白表达量的比较(n=3)Tab 8 Comparison of PI3K、AKT and P-AKT protein expression in each group in AGS cells(n=3)
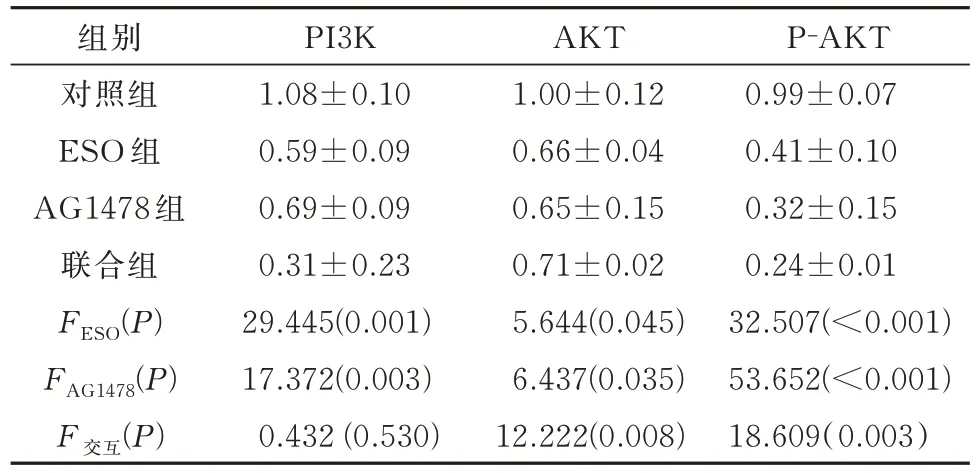
表9 SGC-7901 细胞中各组PI3K、AKT 和P-AKT 蛋白表达量的比较(n=3)Tab 9 Comparison of PI3K、AKT and P-AKT protein expression in each group in SGC-7901 cells(n=3)
3 讨论
过去认为,质子泵抑制剂通过作用于H+/K+-ATP 酶改变微环境酸性发挥抗肿瘤作用[11]。近年来研究发现,PPIs 的抗癌机制具有多样性,更像一种新型化学制剂[12]。埃索美拉唑在预防癌症转移、增强化疗药物抗癌效应方面均显示了重要作用[13,14]。本研究也再次表明,埃索美拉唑抑制胃癌细胞增殖、迁移,诱导其自噬及凋亡,其机制可能与抑制PI3K/AKT 信号通路和EGFR 表达有关,与前期研究一致[10]。
EGFR 酪氨酸激酶抑制剂在EGFR 突变的肺癌治疗中取得巨大成功,然而,却不能带来胃癌患者获益。有研究通过对不同胃食管腺癌患者队列的分析发现,EGFR 扩增导致攻击性行为和不良预后,EGFR 抑制剂在EGFR 拷贝数增加的患者中是有活性的,联合其他药物可提升敏感性[15]。既往研究显示,AG1478 可增强不同细胞毒性药物的敏感性[16,17]。本研究中,AG1478 作用后,胃癌细胞的活力下降呈浓度依赖性, EGFR 蛋白的表达也随AG1478 浓度增加而降低,并且,AG1478 联合埃索美拉唑协同抑制胃癌细胞增殖并诱导细胞凋亡,与AG1478 在其他肿瘤细胞中的凋亡诱导作用一致[18]。
EGFR 介导的细胞自噬在肿瘤形成和治疗耐药中的重要机制,是抗肿瘤治疗的潜在靶点[5,19]。本研究发现埃索美拉唑与AG1478 单独作用于胃癌细胞时,LC3B 的表达均增加,两者联合协同诱导胃癌细胞自噬,这与两者协同诱导凋亡的现象一致。自噬与凋亡存在交叉对话,机制复杂[20],本研究中这种自噬和凋亡水平同时上调的机制和联系尚需探索。
PI3K/AKT 信号通路是EGFR 激活细胞内下游信号级联反应的重要途径,在介导抗肿瘤药物调节自噬和凋亡中发挥关键作用[21]。本研究中观察到,AG1478 联合埃索美拉唑作用时,两种细胞内P-AKT 蛋白的表达相较于单独使用AG1478 和埃索美拉唑时下降的更为明显。因此推测埃索美拉唑联合EGFR 抑制剂AG1478,可能通过协同下调EGFR 表达继而抑制PI3K/AKT 信号通路发挥抗肿瘤效应。
综上所述,埃索美拉唑通过抑制AKT 信号增强EGFR 抑制剂AG1478 对胃癌细胞的增殖、迁移的作用,并诱导胃癌细胞凋亡、自噬,两药联合具有协同作用,可能是一种抗胃癌新策略。
作者贡献度说明:
孙满满、赵涵:主要负责实验操作、数据分析及论文撰写;巴楠、张自森:实验设计指导与论文修改;袁源、李文、李飞艳:协助实验操作。
所有作者声明不存在利益冲突关系。

