大肠杆菌中转录-翻译耦合的机制*
沈崇杰 莫日根
(内蒙古大学生命科学学院,省部共建草原家畜生殖调控与繁育国家重点实验室,呼和浩特 010020)
基因表达通过转录和翻译两个步骤读取存储在DNA 中的遗传信息。这两个步骤分别由两个大分子装置执行:RNA 聚合酶(RNA polymerase,RNAP) 和核糖体[1]。两者都沿着各自的模板(DNA或mRNA)移动,以给出反映模板序列信息的聚合产物(mRNA 或蛋白质)。在原核生物中,由于缺乏将染色体DNA 与细胞溶质物理分隔的核膜,转录和翻译发生在同一个细胞区室(细胞质)中[2],因此,mRNA 可以在转录时进行翻译。转录和翻译在时空上互相协调的现象称作转录-翻译耦合(transcription-translation coupling)。
大约六十年前,有关“原核生物中转录和翻译是耦合的”的观点被首次提出[3]。E. coli核质的电子显微图片显示,RNAP和核糖体之间的联系非常密切:第一个与延伸中的mRNA 链结合的核糖体通常紧邻DNA,有时看起来是与RNAP 直接接触[4],这表明细菌中RNAP 的转录和尾随核糖体(第一个结合到转录本并执行翻译的核糖体,又称先导核糖体)的翻译可能是同时进行的。通过测量转录和翻译的延伸速率,研究者获得了RNAP和尾随核糖体功能上耦合的直接证据[5-7]。最近,以单粒子冷冻电子显微技术(cryo-electronmicroscopy,cryo-EM)为代表的结构生物学技术被用于阐明耦合的细菌RNAP和核糖体复合体(“表达体”)的结构细节,其主要揭示了转录因子NusG 和/或NusA将RNAP与核糖体物理连接的作用[8-9]。
虽然翻译和转录速率在不同的生长条件下有所不同,但这两者间始终保持协调[5-7],说明平衡的转录-翻译耦合机制对于细胞的正常功能不可或缺。耦合的解除所导致的多种冲突,将对基因表达和细胞活力产生负面影响。结合本实验室的最新研究结果,本文重点综述了E. coli中转录-翻译耦合的表现形式、结构细节、机制及意义,并对耦合的研究内容、方法及其在抗生素治疗领域的应用前景进行展望。
1 转录-翻译耦合的表现形式
1.1 转录极性
在E. coli中,大约20%的稳态转录终止事件由转录终止因子Rho介导[10]。Rho介导的转录终止需要一段称为Rho利用(Rho utilization,rut)位点的非结构化且富含胞嘧啶的序列[11]。通过紧跟在RNAP之后,mRNA上的尾随核糖体掩盖了基因内的rut位点,因此抑制了Rho 的结合,从而阻碍转录终止。当转录极性发生时,过早的翻译终止导致核糖体从新生的mRNA 上解离,从而允许转录终止因子Rho 沿着新生的RNA 一直前进到RNAP;在RNAP处,Rho诱导转录终止,停止下游基因在操纵子上的转录;同样地,翻译速率的降低导致的RNAP 和尾随核糖体之间的距离增加有利于Rho与rut位点的结合和Rho 介导的过早转录终止(premature transcription termination, PTT) 发生[12]。特别地,反义转录本由于缺乏与翻译的耦合而使它们成为Rho的目标,进而降低了其对正义链转录单位表达水平的干扰[13]。因此,极性不仅是一种响应压力的资源控制方式,而且是一种有利于基因表达准确性和稳定性的调控机制。
1.2 转录衰减
一些E. coli操纵子在转录单元的起始位置附近包含一个称为“前导肽”的短开放阅读框,其翻译被细胞用作传感器来指示下游基因是否应该被转录或过早终止(“衰减”)[14]。转录衰减最典型的例子是细胞利用色氨酸浓度调节trp操纵子的表达。用于色氨酸生物合成的E. coli操纵子的前导肽包含两个连续的色氨酸密码子;色氨酸饥饿将导致翻译操纵子前导序列的第一个核糖体停滞在连续的色氨酸密码子处,从而促进了抗终止子结构的形成,继而允许RNAP 继续转录trp操纵子上的下游基因;当细胞内色氨酸充足时,核糖体能够穿过连续的色氨酸密码子并导致转录终止发夹结构的形成,因而关闭了下游结构基因的表达[15-16]。因此,转录衰减可以通过使转录与翻译相互关联来使基因的表达受到精密且机动的调控。
1.3 转录与翻译速率的同步
Vogel等[6]通过测量转录和翻译延伸速率表明,转录和翻译速率总是保持一致,并且随着生长速度的降低而以同等比例降低。Proshkin等[7]同样表明,在不同的生长条件下,转录速率和翻译速率完美匹配;翻译速率的增加或降低导致转录速率发生相同的变化。lyer等[5]在引起转录速率降低的碳饥饿条件下也观察到翻译速率相同程度的降低。总之,转录和翻译速率的耦合总是非常紧密,可能存在某种机制介导两者之间的动态协调。
一个转录-翻译物理(接触)耦合的模型被用来解释不同生长条件下的转录与翻译的相关性[7,17]。根据该模型,尾随核糖体的翻译延伸速率决定转录延伸速率。抗生素或突变引起的翻译减慢会使得RNAP与核糖体之间的距离增大,从而使RNAP停滞或回溯;回溯时,RNAP在新生RNA和DNA模板链上向后滑动,压缩上游新生RNA和模板DNA,同时将新生RNA 的3'端挤出核苷三磷酸(nucleoside triphosphate,NTP)进入位点;由于具有能量辅助因子EF-G,尾随核糖体能够活跃地向前易位并通过物理推动的方式将回溯的RNAP重新激活,从而使RNA链继续延伸[7,17]。另一项最新的研究深化了这个模型:RNAP 在其DNA 模板上自发回溯的抑制是通过NusG将尾随核糖体束缚在RNAP 上来实现的,并且NusA 参与了束缚的协作[18]。停滞的RNAP 被尾随核糖体重新激活并运行,RNAP 的速度与核糖体的速度因而相互匹配,即转录速率与翻译速率同步。值得一提的是,这种协调模式并不一定意味着RNAP·核糖体稳定复合物的形成[17]。核糖体对RNAP激活的同时可能会降低其转录精确度[19]。因此,核糖体对RNAP的推动可能是一个短暂的非持续性过程,即RNAP一旦从回溯状态恢复,尾随核糖体就不再与其紧密接触。
四磷酸鸟苷和五磷酸鸟苷统称为(p)ppGpp,是细菌中保守的第二信使。作为一种警报素,(p)ppGpp 的合成通常由营养缺乏引发,以允许细菌在各种不利条件下减缓自身生长[20]。(p)ppGpp与转录调控有关,主要是通过直接与RNAP上的两个特定位点(一个位于ω亚基和β'亚基之间的界面,另一个位于转录因子DksA与β'次级通道边缘螺旋间的界面)相互作用,破坏在某些基因(如rRNA和tRNA基因)启动子处形成的短暂开放复合体的稳定性,从而直接抑制转录启动[21-22]。最近的研究发现,用夫西地酸(fusidic acid)处理的细胞显示出较慢的翻译延伸速率,而转录延伸速率没有降低,并且转录延伸随着(p)ppGpp的积累而减慢[23]。此外,当细胞在导致翻译减缓的氮限制条件下生长时,需要通过(p)ppGpp介导的转录减缓来协调转录与翻译速率[5]。因此,(p)ppGpp 可以在没有物理耦合的情况下协调核糖体和RNAP 之间的速率。这挑战了把RNAP和核糖体之间直接接触作为一般的协调机制的观点。另一项研究表明,(p)ppGpp能够防止嘌呤核苷酸的过度积累及其对5-磷酸核糖-1焦磷酸(5-phosphoribosyl-1-diphosphate, PRPP)合成的抑制;PRPP 是嘧啶核苷酸、色氨酸和组氨酸的前体分子,其缺失将导致细胞在营养限制条件下的生长显著缺陷[20]。因此,警报素可能还通过抑制嘌呤核苷酸的合成来确保色氨酸和组氨酸的可用性以维持基础翻译,进而间接协调转录-翻译。综上所述,当生长有利于高效的翻译延伸时,物理耦合可能很普遍,而压力或缓慢的翻译延伸会产生对警报素的依赖性以同步转录和翻译的速率。
2 转录-翻译耦合的分子机制
2.1 因子介导的物理耦合
2.1.1NusG(RfaH)介导的耦合
NusG 是细菌RNAP 的必要调节因子,大小为20.5 ku;凭借其能产生瞬时相互作用的双结构域:N 端结构域(NusG-NTD)、C 端结构域(NusGCTD)以及结构域之间的灵活接头,NusG 能够与不同的伴侣相互作用[24]。NusG 同时与核糖体和RNAP 的相互作用已经在体内和体外证明[25]。NusG-NTD 与RNAP 结合,而NusG-CTD 可以结合Rho 或核糖体蛋白uS10[26-27]。NusG-NTD 与RNAP的结合可防止RNAP长期停顿或回溯,从而提高整体转录速率[25,27]。Rho 因子与NusG-CTD 的结合将使Rho发生有利于其装载到RNA的构象变化,并同时将Rho因子加载到离RNAP仅一小段距离的新生RNA 上,从而促进Rho 依赖性转录终止[12,25]。核糖体蛋白uS10和Rho在NusG-CTD上共享相同的结合界面[25,27]。正常翻译时,转录与翻译耦合,NusG-CTD与uS10结合,因此无法与Rho结合;当翻译完成或受抑制时,核糖体的释放或停滞将导致NusG-CTD与Rho相互作用并促进Rho依赖的终止[25-27],因此NusG不仅自身结合RNAP和核糖体,而且在转录-翻译耦合过程中在RNAP 和核糖体之间形成物理联系[27]。
NusG 在耦合中的作用机制最近已通过NusG耦合的RNAP·70S 复合物(NusG 耦合表达体)的高分辨率结构得到阐明[28-29]。NusG 的存在将RNAP束缚在30S头部区域,以避免RNAP的β'亚基与由uS3、uS10、NusG和16S rRNA的螺旋33形成的腔之间的冲突[28]。NusG与RNAP和核糖体上的uS10 结合,证实了其作为分子桥的预期作用。NusG 接头长度在14到30 Å的范围变化以及NusG耦合的表达体呈现的高达30°的动态旋转[28]表明,NusG充当介导RNAP-核糖体灵活结合的弹性分子拴链。重要的是,由于核糖体蛋白uS10 与Rho 因子竞争NusG-CTD 上的重叠位点(其中NusG-CTD的F165在结合uS10方面发挥了关键作用),RNAP和核糖体通过NusG 的耦合抑制了Rho 因子的募集,同时抑制了其介导的转录终止[10]。因此,正在被有效翻译的mRNA 能够避免PTT,而那些没有被有效翻译的mRNA 是Rho 的目标;通过这种联系,基因特异性翻译调节因子可以充当基因特异性转录调节因子[14]。
NusG 介导的耦合可能会间接增强转录和翻译的相互关联。一方面,NusG 桥的位置使得核糖体P 位点和RNAP 活性位点之间出现的不同长度(38、41、42、44和47 nt)的新生间插mRNA与核糖体蛋白uS3的表面对齐[28-29]。预计这会最大限度地减少抑制转录和翻译速率的mRNA 二级结构的形成,从而降低了由翻译抑制等因素引起的耦合解除的可能。另一方面,NusG-CTD和核糖体之间的相互作用增加NusG-NTD和RNAP间的亲和力,减少NusG-NTD 从RNAP 解离的频率[28]。因此,在存在尾随核糖体的情况下,RNAP 与NusG 的结合会更稳定。
NusG 的旁系同源物RfaH 同样是一个能将RNAP和核糖体桥接的转录因子[30]。RfaH和NusG的N 端结构域(RfaH-NTD)完全相同,均与延伸中的RNAP 相互作用并减少转录暂停[31]。RfaH与NusG在RNAP 上共享相同的结合位点,导致它们以相互竞争的方式与RNAP结合[32]。通常情况下,RfaH的C端结构域(RfaH-CTD)折叠成α发夹并将RfaH-NTD的RNAP结合位点掩盖[31]。RfaH在转录前与非模板DNA中的ops序列结合,这将导致RfaH-CTD和RfaH-NTD的分离,从而使RfaH-NTD可以与RNAP结合;同时,RfaH-CTD将采用NusG的全β折叠结构并允许RfaH在和NusG相同的界面处招募uS10 并激活翻译[31-32]。与NusG 不同,RfaH 不结合Rho 因子,这可能与它们CTD中L1与L2环的序列差异有关[10]。因此,RfaH 以3 种方式阻碍Rho 依赖性转录终止[31,33]。首先,它通过调节RNAP和第一个尾随核糖体之间的紧密耦合来阻止Rho 因子到达RNAP;其次,它通过与NusG 竞争结合RNAP 来减少NusG 对Rho 依赖性终止的促进作用;第三,它通过稳定“闭合钳”形式的RNAP构象来减少RNAP的暂停。
2.1.2NusA协助NusG介导的耦合
NusA 是一种由495 个氨基酸(55 ku)组成的多结构域蛋白,其在细菌和古细菌中高度保守[34]。NusA 的N 端结构域(NusA-NTD)通过一个灵活的螺旋连接到3 个结合RNA 的亚结构域:S1、KH1 和KH2,形成中央SKK 结构域,与新生转录本的单链RNA 结合;连接到SKK 结构域的C 端是酸性重复序列1和2(AR1和AR2),迄今为止,这些重复序列只在E. coli中被鉴定出来[24]。RNA发夹结构所稳定的RNAP暂停由NusA和RNAP间的相互作用促进,这些相互作用有利于RNAP暂停构象的形成和稳定,并进一步延长了暂停时间[34]:NusA-NTD结合β亚基翼端螺旋(β-FTH);AR2结合α1 亚基C 端结构域(α1-CTD);NusA 的KH 结构域(NusA-KH)与ω 亚基的C 端螺旋结合以及NusA-NTD 与α2 亚基C 端结构域(α2-CTD)的结合[34]。相反地,在与其他Nus因子(NusA、B、E和G)的协同作用下,NusA促进了N蛋白依赖的抗终止过程并促使稳定的转录延伸复合体(transcription elongation complex,TEC)形成,从而引导进行性转录和终止位点的通读[35-36]。
NusG-NusA 耦合表达体的结构是利用纯化的E. coli因子重组得到的[29]。包含NusA 和NusG 的E. coli表达体的结构(NusG-NusA耦合表达体)与仅包含NusG 的结构(NusG耦合表达体)非常相似:NusG分别与核糖体30S头部和核糖体蛋白uS10相互作用;RNAP β'亚基的锌结合结构域(zincbinding domain,ZBD)与核糖体蛋白uS3接触;重要的是,NusA 可以同时与核糖体和RNAP 相互作用,形成灵活的分子桥[29]。不同于NusG-NusA耦合表达体中由NusG与核糖体30S头部的相互作用,在NusA耦合表达体中,NusA与核糖体30S体表面进行广泛的相互作用,这种相互作用是由NusA的KH1结构域插入核糖体蛋白uS2和uS5之间的裂缝中驱动的[29]。NusA-KH1(E218、E219、D242 和D246)的酸性残基与uS2(K105 和R108)和uS5(R45、R68和R69)的碱性残基的相互邻近可能支持这种相互作用[14]。除此之外,NusA采用的内部弯曲的扩展构型支持其作为RNAP和尾随核糖体的uS2/uS5 蛋白之间的“耦合受电弓”来促进表达体的组装,并允许RNAP 相对于核糖体30S 体旋转[34]。
根据结构测定,与NusG耦合表达体相比,NusG-NusA耦合表达体展现出更多的颗粒数量和更高的分辨率[29]。这表明NusA 可能促进NusG 介导的耦合形成或维持其稳定性。目前尚不清楚NusA独自在耦合中的作用,一个主要原因是缺少具有NusA但没有NusG的E. coli表达体结构。
2.2 非因子依赖的物理耦合
与因子介导的耦合相比,非因子依赖的耦合需要RNAP和核糖体间的直接相互作用。这种互作得到了部分实验数据的支持。Chakrabarti等[37]较早的研究表明,仅依赖RNAP和核糖体30S亚基间的结构相容性就能确保转录和翻译间的耦合。通过cryo-EM,Kohler[9]和Demo[38]两个团队分别解析了70S核糖体/30S核糖体亚基与RNAP相结合的复合体结构(由于前者是通过将翻译核糖体与转录停滞的RNAP碰撞而产生的,故其又被称作“碰撞表达体”);30S亚基与RNAP的互作细节也在同一年被Fan等[39]揭示。
Klohler、Demo和Fan三个团队的研究均表明,30S亚基在RNAP与核糖体的结合中发挥了关键作用;RNAP的mRNA出口位点都会停靠在30S亚基的mRNA入口位点,这确保了自mRNA经RNAP合成后到其抵达核糖体的解码中心的这段期间,Rho无法访问转录本并提前终止转录;并且NusG没有足够的长度桥接RNAP与核糖体,暗示因子介导的耦合无法与非因子依赖的耦合共存[9,38-39]。
不同的是,碰撞表达体中RNAP的mRNA出口位点始终停靠在30S亚基上mRNA的入口位点[9],而在Demo和Fan团队得到的30S亚基·RNAP复合体中,RNAP的mRNA出口位点起初均结合在核糖体的mRNA出口位点附近[38-39]。因此,参与和RNAP互作的核糖体蛋白也有明显不同(在碰撞表达体中主要为uS3、uS4和uS5,而在30S亚基·RNAP复合体中主要为uS1和uS2)[9,38-39]。鉴于核糖体上的mRNA出口位点靠近16S rRNA的Shine-Dalgrano结合区,30S亚基·RNAP复合体可能代表了翻译起始阶段两个大分子的结合情况。具体地讲,RNAP和30S亚基结合帮助16S rRNA的折叠和核糖体蛋白的组装,从而将翻译起始和转录延伸相互关联;30S起始复合物的形成将导致30S内部结构的重排和RNAP结合位点的重塑,RNAP从原来的核糖体结合位点(mRNA出口位点)解离并最终停靠在核糖体的mRNA入口位点附近[38-39](与碰撞表达体中的RNAP和核糖体的结合情况相符)。RNAP的重新定位充分体现了生物大分子的构象灵活性以及功能上合作的紧密性。
2.3 DksA和TufA辅助的间接耦合
转录因子DksA是一种RNAP结合蛋白,在E. coli中以相对恒定的浓度存在[21]。作为(p)ppGpp的辅助因子,DksA能够在严紧反应中放大(p)ppGpp依赖的转录调控的效果;DksA通过将其卷曲螺旋结构域插入到RNAP次级通道来和RNAP相互作用;这种互作导致次级通道扩展并影响RNAP核心和骨架组件的取向;DksA和RNAP的结合可能使RNAP对(p)ppGpp诱导的骨架-核心棘轮效应更加敏感,从而在转录调控过程中放大(p)ppGpp的信号[22]。
TufA 是E. coli中的一种翻译延伸因子,除在蛋白质合成中发挥作用外,其已经被证明在转录水平上调节与热休克和氧化应激等胁迫反应相关的蛋白质合成[40]。最近的文献报道在tufAmRNA 5'UTR 中存在折叠成两个相似发夹的结构区域SRⅠⅠⅠb。该结构化区域作为一种翻译起始增强子(structured enhancer of translation initiation,SETⅠ)提高了GTP对30S翻译起始复合物的亲和力,从而增加了ppGpp耐受性并允许有效的蛋白质合成[41]。根据本实验室对E. coli的翻译组测序(Ribosome profiling sequencing,Ribo-seq)结果,与野生型菌株相比,tufA基因缺失突变体总体转录表达量和翻译表达量的相关性下降14.75%,其中DksA蛋白的翻译水平下调55.6%(未发表数据)。所以,TufA可能在耦合形成前或翻译受阻期间通过上调DksA的表达来参与(p)ppGpp依赖的间接耦合。
2.4 转录-翻译耦合的阶段性模型
本文提出一个E. coli中转录翻译耦合的阶段性模型。与转录延伸相比,翻译起始是一个相对较长的过程,因此,RNAP可以在在尾随核糖体开始延伸之前独立地延长几十个核苷酸[42](图1a)。一旦尾随核糖体开始延伸,RNAP和核糖体就会通过新生的mRNA 远程连接,以间接耦合的方式相关联(图1b)。(p)ppGpp 在此过程合成维持基本翻译所需的蛋白质并降低转录延伸速率。TufA通过直接或间接的方式增强(p)ppGpp辅助因子DksA的表达,从而使(p)ppGpp介导的转录延伸降低效应进一步增强。某种调控作用使RNAP倾向于在起始密码子后的100 nt 内暂停[43],这可以让尾随核糖体赶上RNAP 并形成物理耦合。这种耦合由NusG 或RfaH因子桥接RNAP和核糖体的uS10蛋白来维持,并由NusA在RNAP与核糖体蛋白uS2、uS5间形成的桥接稳定(图1c)。转录或翻译延伸速率的变化会导致连接RNAP 和尾随核糖体的新生mRNA 的长度不同,进而引起几种耦合机制间的转变 (图1)。例如,转录暂停或RNAP回溯缩短了尾随核糖体和RNAP之间的距离,这可能导致两者在没有因子存在的情况下以碰撞的方式结合(图1d)。随着尾随核糖体推动停滞或回溯的RNAP向前运行,因子介导的耦合可以重新配置[17]。另一方面,翻译障碍会增加尾随核糖体和RNAP之间的距离。如果此时处于碰撞耦合模式下,耦合将转向间接关联转变;若此时处于因子耦合阶段,则这种耦合不会被轻易破坏,因此无法直接导致耦合向间接关联过渡。在这种情况下,较长的新生mRNA 可能在RNAP和核糖体之间形成突出到外侧的环,并在转录延伸减慢或翻译延伸加快的条件下得到恢复[12]。
3 转录-翻译耦合的生物学意义
如前所述,翻译故障将增加RNAP和核糖体之间的距离。当两者距离增加超过间接耦合调节的范围,转录-翻译耦合将被破坏。所以,转录-翻译耦合的解除实际上主要是由诸如稀有/过早终止密码子、聚脯氨酸序列、mRNA二级结构元件(如假节和茎环)等引起翻译减慢或停滞的因素造成的[44](图2a),如果这些故障没有被及时清除,将产生一系列严重后果。
早期的观点认为,转录-翻译耦合是细胞防止非功能性转录物在细胞质中积累的一种方式[45]。如前所述,当翻译受阻从而导致核糖体与RNAP解耦合时,Rho容易结合到rut位点并运行至RNAP分解TEC。特别地,NusG在此情况下可能进一步促进了mRNA对于Rho的招募,且不需要rut位点[10]。关于转录极性的最新发现也表明,在没有物理耦合核糖体的情况下,转录终止因子Rho在转录启动后早期通过与NusA 和NusG 的相互作用与RNAP 结合,使TEC 变成停滞不前的预终止复合体。这种状态有利于Rho 识别新生mRNA 中的rut位点,随后是Rho 环的闭合与移位以及TEC 的分解[46-47]。这些分子事件导致PTT和操纵子极性(图2b)。由于核糖体和Rho竞争NusG的相同结合界面,因此,耦合的核糖体会阻止Rho 介导的PTT。这与Zhu等[23]提出的看法一致:转录和翻译延伸之间的协调可以防止PTT,从而防止细胞在正常生长条件下合成无用的蛋白质。由此看来,合理配置资源似乎是转录-翻译耦合的部分功能。无论是翻译减缓导致的PPT,还是转录减缓导致的核糖体队列拥挤,都将引起成本的增加和能量的浪费[48]。
双超螺旋结构域模型表明DNA 在移动的RNAP后面呈负超螺旋,这预计将有利于R环的形成[49](图2c)。R 环是一种由双链DNA 中的一条链与mRNA 构成的异源双链核酸分子结构。在E. coli中,染色体R环与转录延伸的缺陷有关,并且被认为充当后续RNAP运动的障碍。停滞的TEC可能会干扰复制叉前进,从而导致叉断裂或崩溃[50]。R 环也可能介导细菌中染色体DNA 复制(组成型稳定DNA 复制) 的异常起始[51]。Gowrishankar和Harinarayanan[52]认为,所有细菌转录都倾向于形成R环,并且R环可以通过以下方式之一避免:类似于在rRNA和tRNA中的RNA二级结构的形成;翻译与转录的耦合;在mRNA 无法翻译的情况下,Rho和NusG介导的PTT。其中,转录-翻译耦合有助于防止拓扑异构酶Ⅰ缺陷(DNA呈负超螺旋)的菌株中出现R 环已经由Massé等[49]验证。
除翻译障碍外,当RNAP遇到物理障碍或结合了错误的核糖核苷三磷酸(ribonucleotide triphosphate,rNTP) 时,其也可能会暂停或回溯[19]。耦合允许核糖体解除TEC 的停滞或回溯,这对于避免复制体和RNAP 之间的冲突尤为重要(图2d)。这种冲突会进一步引起DNA 双链断裂以及基因组的不稳定[53]。Saxena等[25]的研究也强调了这一点:NusG 与uS10 结合界面的突变(NusG F165 或uS10 M88 和D97)将转录与翻译耦合解除并增加了对氯霉素的敏感性。这种表型被一种减少复制体-RNAP冲突的RNAP突变rpoB*35抑制。因此,减弱的NusG∶uS10相互作用会在翻译受到抑制时导致耦合破坏,进而引起RNAP回溯、复制阻滞和致命的DNA双链断裂的形成。
共转录翻译还保护新生转录物免受核糖核酸酶(ribonuclease,RNase)的攻击[54](图2e)。Ⅰost和Dreyfus表示[55],当被运行速率较快(约230 nt/s)的T7 RNAP 转录时,lacZ转录本的稳定性大大降低。T7 RNAP 转录lacZ基因的速度比核糖体解码lacZ基因的速度快大约8 倍,这种更高的速度会暴露一个RNase E切割位点;而当使用较慢(速率与核糖体相似)的E. coli酶时,该位点通常在转录后不久被核糖体屏蔽,阻止了RNase E对mRNA的特异性切割[55]。
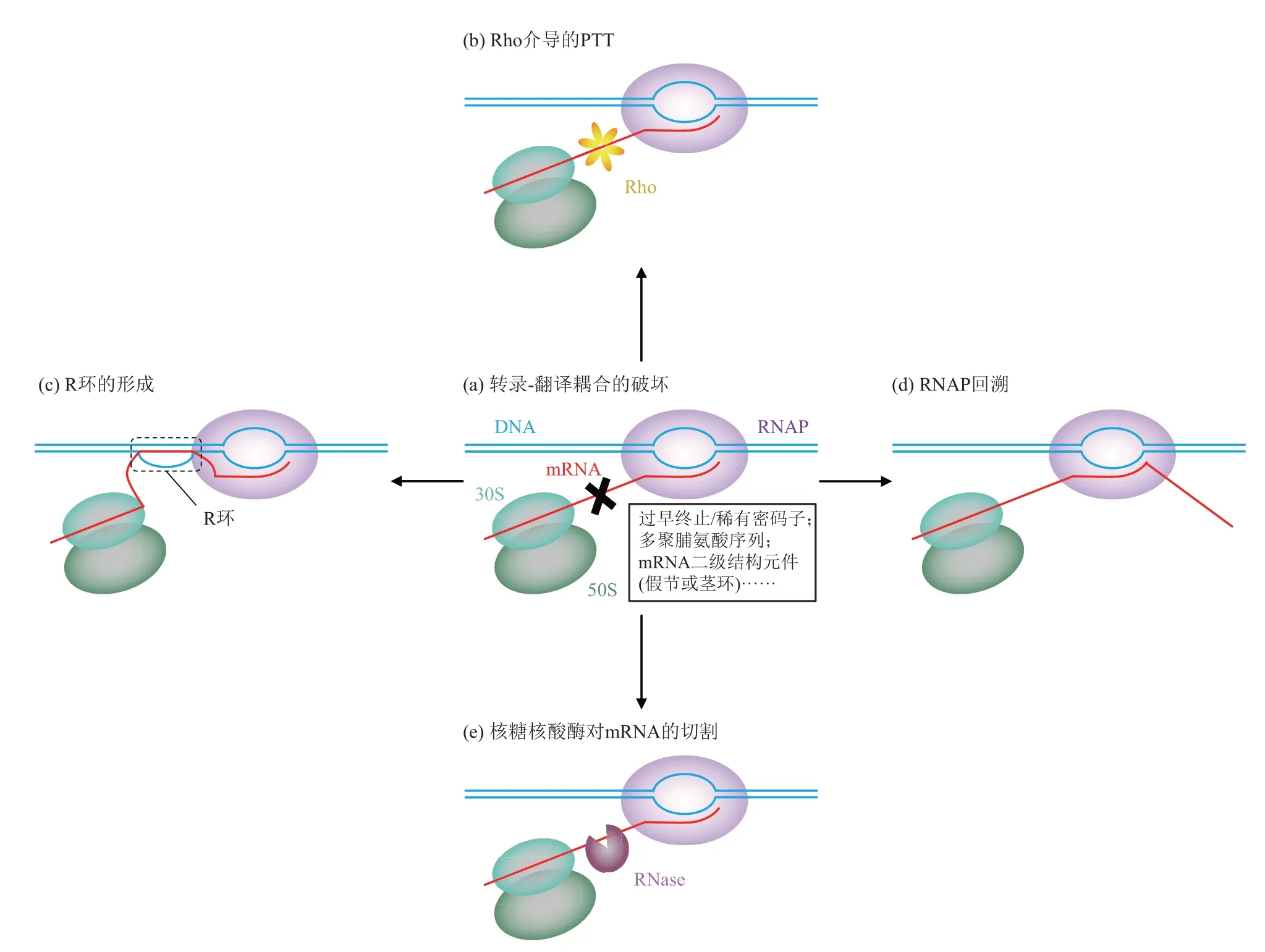
Fig. 2 The consequences of the disrupt of the transcription-translation coupling图2 转录-翻译耦合破坏的后果
4 总结与展望
转录-翻译耦合是人们对基因表达探索中的一个关键发现,其框架已经基本确立并走向完善。以E. coli为例,转录翻译-耦合以物理接触或间接(非物理接触)的方式合作进行,并且受到多种因素的调控。转录和翻译互相调控(转录极性、转录衰减和转录-翻译速率的同步)的事实进一步支持这种耦合。不同阶段的转录-翻译耦合机制对整个细胞功能意义重大,并在相应的生长条件下保持。当遇到影响转录或翻译的环境挑战时,细菌会相应地迅速平衡这两个过程的动力学以使转录和翻译相互协调。
尽管E. coli能将转录和翻译耦合起来,但这可能并不适用于所有原核生物。例如,在枯草芽孢杆菌(Bacillus subtilis)中发现了RNAP 转录远远领先于尾随核糖体的“失控转录”现象[56],表明耦合的RNAP-核糖体运动不是细菌的一般标志。另外,在肺炎支原体(Mycoplasma pneumoniae)中鉴定出的NusA耦合表达体显示出一个与已经表征的所有E. coli表达体存在差异的结构[57],说明不同生物体可能存在不同的耦合机制,亦反映了不同物种间基因表达调控机制的潜在多样性。
Bharti等[58]最近通过对来自1 800个细菌基因组的基因盒进行分析,鉴定出3个频率较高的基因盒,且每一个基因盒都编码一种连接转录和翻译的蛋白质(NusG、RpsD和NusA),暗示基因盒的存在可能在转录-翻译耦合机制中发挥不可忽视的调节作用。此外,转录组和翻译组学的联合分析能够从全局或者单个基因的角度展现转录与翻译之间的相关性或差异性[59],这或许能为找到和分析更多因素在转录-翻译耦合中的作用带来帮助。因此,通过将高通量组学(转录组和翻译组学)、分子生物学、结构生物学等技术联合运用,或许可以获得对转录-翻译耦合的机制、作用、必要性等方面更深层次的见解。
作为一种原核生物的特异性现象,转录-翻译耦合将为靶向抗菌药物的开发提供一个有吸引力的方向。鉴于多细胞过程的调控子可能作为未来抗菌药物的理想靶点[60],开发靶向耦合因子(如NusG、NusA和(p)ppGpp)的药物或许可以同时影响转录和翻译两个基因表达过程的动力学平衡。特别地,鉴于严紧反应在产生非遗传性抗性和持久细胞形成中起着关键作用,靶向(p)ppGpp 介导的转录-翻译耦合的间接调节显示出巨大的潜力,一种(p)ppGpp合成抑制物relacin已经被证明通过阻止细菌细胞进入稳定生长期来降低细菌活力[61]。传统的细菌感染治疗主要以必需基因或通路为靶标,可能会施加导致抗生素抗性唤醒的选择压力,进而引起耐药性菌株的泛滥。缺乏警报素的菌株在代谢上受到损害但仍能存活。因此,未来通过设计出靶向(p)ppGpp 代谢的药物将在大大降低细胞活力的同时减少耐药性菌株的产生,这对于抗菌治疗具有一定的借鉴意义。

