R-spondin2调控Wnt/β-catenin信号通路的机制及其对骨骼系统的影响*
晋俊杰 李 晶 胡广璇 吴若萌 衣雪洁**
(1)沈阳体育学院运动健康学院,沈阳 110102;2)辽宁师范大学体育学院,大连 116029)
R-spondin2(Rspo2)是RSPOs家族中的一员,该家族是一类富含半胱氨酸的分泌蛋白[1]。近年来,大量研究发现,Rspo2 通过Wnt/β 连环蛋白(catenin)信号通路调控骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)、成骨细胞(osteoblast,OB)、破骨细胞(osteoclast,OC)和软骨细胞等参与成体骨形成和骨骼疾病的发生发展,对Rspo2的研究可能成为一些骨骼疾病新的治疗方向。本文将对Rspo2增强Wnt/β-catenin信号通路的相关机制及其成体骨形成以及相关骨骼疾病的影响进行综述。
1 Rspo2的发现和蛋白质结构
RSPOs 家族有4 个成员(Rspo1~Rspo4),Rspo2 是2004 年在非洲爪蟾体中被Kazanskaya等[2]首次发现,它存在于所有脊椎动物及部分无脊椎动物中[3-4]。Rspo2 可通过调控Wnt/β-catenin信号通路来发挥其生物学功能。
Rspo2 蛋白长度为243 个氨基酸,其氨基酸序列在脊椎动物中具有高度保守性。其包含4个主要结构域[1]:a. 1 个N 端富含疏水氨基酸的信号肽(signal peptide,SP)序列;b. 2个相邻富含半胱氨酸的弗林蛋白酶样(furin-like cysteine-rich,FU-CR)的结构域;c. 1 个含有血小板反应蛋白1 型重复(thrombospondin type Ⅰ repeat,TSR)序列的结构域;d. 1个C端带正电负荷富含碱性氨基酸(basic amino acid-rich,BR)的结构域(图1)。每个结构域都有不同的功能,其中,SP 用于引导Rspo2 分泌到胞外。FU-CR1 与锌指环指蛋白3/环指蛋白43(zinc and ring finger 3/ring finger protein 43,ZNRF3/RNF43)相互作用,FU-CR2与富含亮氨酸重复序列的G 蛋白偶联受体(leucine-rich repeat containing G protein-coupled receptors,LGRs) 相互作用,2 个FU-CR 都可以增强Wnt 信号传导[4],是Rspo2蛋白结构中最保守的区域。FU-CR和TSR与Rspo2 的分泌水平和结合受体能力密切相关。TSR 可能与黏结蛋白聚糖(syndecans)相互作用,BR 可能与硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycans,HSPGs)相互作用,二者共同发挥作用使Rspo2 可以结合细胞膜表面和细胞外基质(extracellular matrix,ECM)[4],从而很难检测到游离Rspo2 蛋白。并且TSR 和BR 结构域影响RSPO 激活的强度,其缺乏会降低Wnt/β-catenin 信号通路传导的效率[5]。

Fig. 1 The structural diagram of Rspo2 protein (created with BioRender.com)图1 Rspo2蛋白结构图(使用BioRender.com绘制)
2 Rspo2与经典Wnt/β-catenin通路的关系
随着RSPOs 家族受体LGR4/5/6、 ZNRF3/RNF43、含GTP酶激活蛋白质1的ⅠQ基序(ⅠQ motifcontaining GTPase-activating protein 1,ⅠQGAP1)和HSPGs 的发现,RSPOs 通过Wnt/β-catenin 信号通路发挥其生物学功能的作用被证实。
2.1 Wnt/β-catenin信号通路概述
Wnt信号通路在胚胎发育和组织内稳态中起重要作用,调控许多生命过程,包括免疫、应激、细胞癌变、细胞凋亡、细胞形态与功能的分化及维持,是细胞生物学和分子生物学研究的一大热点。
Wnt信号通路主要包括3条途径[6]:a. β-catenin介导的经典途径;b. JNK 介导的Planer 细胞极性(PCP)途径;c. Ca2+介导的Wnt/Ca2+途径。其中Wnt/β-catenin通路,即经典Wnt信号通路研究最为深入。Wnt/β-catenin 通路的主要成分包括:配体(Wnt 家族分子)、跨膜受体(卷曲蛋白(frizzled,Fzd)家族分子和低密度脂蛋白受体相关蛋白5/6(low density lipoprotein receptor-related protein,LRP5/6))、 胞浆调节蛋白 ( 蓬乱蛋白(dishevelled, Dsh/Dvl)、 肠腺瘤样息肉蛋白(adenomatous polyposis coli, APC)、 轴蛋白(Axin)、糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)、β-catenin 等)以及核转录因子(T 细胞因子/淋巴增强因子(Tcf/Lef)家族)等。Wnt配体与细胞膜上Fzd和LRP5/6共受体相结合形成Wnt-Fzd-LRP5/6 复合体,招募Dsh/Dvl,使LRP5/6 磷酸化并活化,继而招募APC、Axin、GSK-3β 与β-catenin 形成的复合体,抑制复合体中GSK-3β 对β-catenin 的磷酸化作用,未磷酸化的β-catenin 在细胞质内大量聚积[7]并转运至细胞核中,结合Tcf/Lef 因子形成转录激活复合体,激活下游特定靶基因的转录[8-9](图2)。
2.2 Rspo2对Wnt/β-catenin信号通路的调控机制
Wnt/β-catenin通路在不同的生物学过程中起着重要作用,例如胚胎发育、调节间充质细胞分化和骨生理学等。Hao等[10]提出Rspo2调控Wnt/β-catenin通路机制:RSPOs-富含亮氨酸重复序列的G 蛋白偶联受体4/5 (leucine-rich repeat-containing G protein-coupled receptor 4/5, LGR4/5)-ZNRF3/RNF43 信号传导单元调控Wnt/β-catenin 通路(图3)。LGR4/5 是Rspo2 的高亲和受体[11],ZNRF3/RNF43 是通过泛素化和后续串联反应降解经典Wnt 信号通路细胞膜上Fzd 受体,发挥经典Wnt信号通路的负反馈调节作用[12-13]。Wnt蛋白可以与Fzd 受体和LRP5/6 共受体结合激活经典Wnt通路,胞质内β-catenin 聚积后转移进入细胞核与Tcf转录因子作用,激活ZNRF3/RNF43基因表达产生相应蛋白质并转运至细胞膜上。当没有Rspo2存在时,ZNRF3/RNF43 通过Dvl 识别Fzd,诱导Fzd泛素化和降解,从而抑制Wnt/β-catenin通路;而当有Rspo2 存在时,Rspo2 与其受体LGR4/5 和细胞膜ZNRF3/RNF43 同时结合,诱导ZNRF3/RNF43泛素化和降解,阻断Fzd受体泛素化和降解,增强Wnt/β-catenin 信号通路。当ZNRF3/RNF43 发生降解时,Rspo2-LGR4 也可以通过招募ⅠQGAP1 诱导LRP5/6 磷酸化增强β-catenin 活性,提高Wnt/β-catenin 通路调节细胞的黏附和迁移能力[14]。此外,研究发现[15],Rspo2 还可以通过与HSPGs 和ZNRF3/RNF43相互作用,诱导细胞膜表面ZNRF3/RNF43降解来增强Fzd受体积累,增强Wnt信号通路。除了作为Wnt 激动剂,还有研究表明,Rspo2也充当骨形态发生蛋白(bone morphogenetic protein,BMP)拮抗剂,Rspo2 是BMP 受体1A 型(BMPR1A)/ALK3 的高亲和力配体,它与ZNRF3结合以触发BMPR1A的内化和降解。这表明Rspo2是双功能配体,其可以通过ZNRF3 激活Wnt 并抑制BMP信号传导[16]。
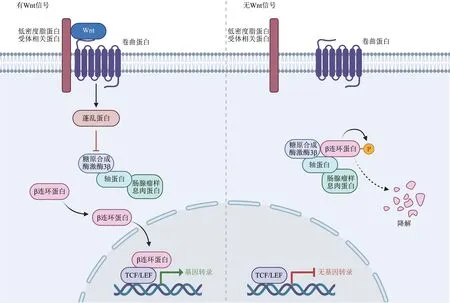
Fig. 2 Wnt/β-catenin signal pathway diagram (created with BioRender.com)图2 Wnt/β-catenin信号通路图(使用BioRender.com绘制)
Rspo2 是一种分泌蛋白,其通过激活并增强Wnt信号通路传导而发挥其生物学功能。然而有趣的是,Rspo2 不仅仅对Wnt 信号通路有激活作用,Reis 等[17]对非洲爪蟾的研究中发现,Rspo2 在形态学上以及在基因靶标和途径介质的水平上都起着Wnt 拮抗剂的作用。在此过程中,Rspo2 不影响Dvl 磷酸化和Fzd 活性,也不与RNF43/ZNRF3 和LGR4/5 结合,而是直接抑制Wnt 蛋白诱导的TCF3/TCF7L1 磷酸化,导致靶基因不能被激活,从而造成对Wnt信号通路的拮抗作用。这一发现与之前研究结果有所不同,需要未来进一步的研究来证实。

Fig. 3 Rspo2 regulates Wnt/β-catenin signaling pathway (created with BioRender.com)图3 Rspo2调控Wnt/β-catenin信号通路(使用BioRender.com绘制)
3 Rspo2通过Wnt/β-catenin信号通路调控骨代谢
Wnt/β-catenin信号通路是目前研究最广泛且与基础骨生物学直接相关的信号通路,而Rspo2是经典Wnt/β-catenin通路的一类新激活剂,其通过减少Wnt受体周转来积极调节经典Wnt信号传导,从而增加β-catenin的稳定性来展现出对骨代谢的调控作用。Rspo2在骨骼发育过程中突出表达[18],并有助于肢体形成[19],特别是远端手指的形成[20]。
3.1 Rspo2与成骨细胞
骨形成是新骨发生和成熟的过程,分为类骨质的合成、分泌和类骨质的矿化两大过程。OB 能够通过分泌Ⅰ型胶原与羟基磷灰石形成类骨质,类骨质逐渐成熟并形成大量钙盐和磷酸盐,矿化形成新骨[21-23]。OB 是存在于骨组织中,起到接受刺激和发挥效应作用的细胞,其来源于BMSCs,随着发育依次分化为前OB和OB,OB在分化的最终阶段包埋于矿化的骨基质中成为骨细胞。在骨骼受到损伤时,机体首先反应是OB增殖、成熟,之后形成新生的骨组织。Wnt/β-catenin信号通路在骨骼发育及代谢平衡中发挥重要作用,包括BMSCs 的定向分化[24]、OB的谱系决定、分化和矿化,是骨形成的关键信号通路[25-27]。
BMSCs定向分化的OB在骨形成、维持和重建中发挥着重要作用[28]。Wnt/β-catenin 通路可通过促进 Runt 相关转录因子 2 (Runt related transcription factor 2,Runx2)和骨钙素的表达,促进BMSCs 向OB 分化,亦可抑制C/EBPα、PPARγ和Sox9基因的表达,抑制BMSCs向软骨细胞和脂肪细胞的分化,还能通过调控Myc、cyclin D、c-Jun和Fra-1的表达,来促进OB的增殖[29]。
Wnt蛋白是一类富含半胱氨酸的分泌型糖蛋白家族,到目前为止在哺乳动物染色体中已鉴定出19 种 Wnt 蛋白家族成员,其中Wnt/β-catenin 信号通路涉及到的主要有Wnt1、Wnt3a、Wnt5a 和Wnt10b等[30]。Wnt1可通过Wnt/β-catenin途径提高成骨相关转录因子Runx2、碱性磷酸酶、Ⅰ型胶原骨桥蛋白和骨钙素的水平来促进成骨作用[31]。Wnt3a 在体内可以激活β-catenin,在体外Wnt3a 蛋白可以抑制OB 的凋亡[32]。Wnt6、Wnt10a 和Wnt10b 通过Wnt/β-catenin 途径促进间充质干细胞成骨分化并抑制其向脂肪细胞的分化[33]。过表达Wnt10a 可提高β-catenin 的相对表达量,进而抑制3T3-L1 前脂肪细胞向成熟脂肪细胞分化并诱导其向成骨分化[33]。BMP 能诱导BMSCs 向OB 分化,Wnt/β-catenin 信号通过TCF/LEF 直接诱导OB 中BMP-2 的表达,增强BMP-2 的转录活性,并且β-catenin 能够增强BMSCs 对BMP-2 的反应,诱导其向OB分化,促进成骨[34]。Bennett等[35]培育骨钙素启动子Wnt10b 过表达的转基因小鼠,发现股骨骨密度、骨体积分数和骨小梁数较野生型小鼠显著增高,而其是由OB数量增多引起的。
Rspo2 可以通过Wnt/β-catenin 信号通路来调控骨形成。Knight 等[20]从1 个月大的WT 和Ocn-Cre+Rspo2f/f小鼠中分离BMSCs,通过茜素红染色发现来自Ocn-Cre+Rspo2f/f小鼠的BMSCs 显示矿化减少,而且小鼠的整体体型和骨量减小,基因表达分析和免疫组织化学分析显示Ocn-Cre+Rspo2f/f中的β-catenin 信号传导减少,以上说明Rspo2 经过Wnt/β-catenin 信号通路可调控OB 生成和矿化,从而控制骨量。Rspo2缺乏导致矿物质沉积和骨形成率降低,从而导致小梁越来越少,总骨量减少,骨强度降低。除此之外,Rspo2还在牙周韧带组织和牙髓干细胞中发挥作用。Gong 等[36]发现,Rspo2通过调节Wnt/β-catenin 信号传导诱导牙髓干/祖细胞的牙源分化。Arima 等[37]通过对未成熟牙周韧带组织和细胞施加机械拉伸负荷发现Rspo2表达上调,之后再分别用Rspo2 和Dickkopf 相关蛋白1(DKK1)处理,发现细胞经Rspo2 处理后增强了β-catenin 的核易位、活化以及OB 的矿化结节,所以受机械负荷的牙周韧带组织的矿化可以通过Rspo2和DKK1进行精细控制,以防止牙周韧带组织过度矿化。在MC3T3E1前体OB中,Wnt11显著增加OB 相关蛋白牙本质基质蛋白1(dental matrix protein 1,Dmp1)、磷酸调节内肽酶同系物(phosphate-regulating endopeptidase homolog,Phex)、骨唾液蛋白(bone sialoprotein,Bsp)和Rspo2 的表达,Wnt11 过表达增加β-catenin 积累并促进 BMP 诱导的碱性磷酸酶 (alkaline phosphatase,ALP)表达和矿化,而Rspo2 的敲低抑制Wnt11介导的OB成熟,这些研究表明,Wnt11通过β-catenin 发出信号激活Rspo2 表达是OB 成熟所必需的[38]。Rspo2 在Wnt 刺激的前OB 中高表达,并且其过表达诱导相同细胞中的OB分化,支持了其作为OB生成的正向调节剂的假定作用。之后Zhu 等[39]进一步研究发现,体外实验中Rspo2通过激活MC3T3-E1细胞中的Wnt信号通路来促进成骨,而随着LGR4 的功能破坏,Rsop2 的这种作用在细胞中消失了。值得注意的是,在体实验发现给予外源性Rspo2 挽救了卵巢切除(ovariectomy,OVX)小鼠的骨质流失并改善了骨微结构,以上结果表明,在Rspo2激活Wnt/β-catenin 信号传导来调节骨代谢的过程中,LGR4 是作为Rspo2 促进成骨的关键受体[39]。
3.2 Rspo2与破骨细胞
OC来源于单核-巨噬细胞系,是一种多核巨噬细胞,通过单核前体细胞融合形成,是唯一的骨吸收细胞,与骨代谢及骨重建密切相关。
Wnt/β-catenin 通路主要通过OPG/RANK/RANKL 通路间接参与骨吸收的生理和病理过程[40]。OPG/RANK/RANKL通路是调节OC功能的关键信号通路,RANKL与OC表面或OC前体细胞上的RANK结合诱导OC的分化和激活,而OPG竞争性阻断RANKL 与RANK 结合,抑制OC 进一步分化成熟[41]。Wnt/β-catenin信号能够刺激OB上调OPG表达,增加OPG/RANKL的比例,抑制OC分化和活性,从而抑制骨吸收[42]。对骨溶解大鼠模型使用GSK-3β 抑制剂以激活Wnt/β-catenin 通路,发现OPG 表达增强,OB 数量显著减少,骨量增加[43]。在OB发育后期,Wnt3b和β-catenin的表达增高,RANKL 的活性被抑制,OC 的数量和活性均降低。Wnt16能通过Wnt/β-catenin通路和Wnt/c-JNK通路抑制OC前体细胞分化并间接作用于OB,导致OB分泌OPG增加[44]。β-catenin对OC形成起着关键的双相和剂量依赖性调节作用。Sui 等[45]构建了OC 中β-catenin 过表达的小鼠模型,通过CT 断层扫描和组织形态学分析观察到小鼠生长迟缓和骨量降低,表明OC中β-catenin的激活促进了OC 形成,导致骨质流失。由此,推断Wnt 蛋白在OC不同阶段可能都具有调控功能。
Zhu 等[39]用Rspo2 处理共培养的OB 和OC,发现上清液中OPG 水平升高,RANKL/OPG 的比率降低,而破坏LGR4后该比率则显著升高,几乎完全阻断了Rspo2对RANKL/OPG的负面影响。用抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色也表明在添加有Rspo2的共培养体系中OC 细胞数量显著减少,之后用BMSCs与LGR4敲除细胞共培养时发现Rspo2不影响OC 的数量。在没有OB 情况下,Rspo2 对OC 分化没有直接抑制作用。这些结果表明,LGR4功能正常的OB 在Rspo2 介导的OC 生成抑制中起着关键作用。
3.3 Rspo2与软骨细胞
软骨细胞在软骨骨化过程中按静止软骨区域、增殖软骨细胞区域、软骨细胞成熟/肥大区域顺序分化,然后被OB取代。增殖软骨区域的软骨细胞表达转录因子Sox9,分泌ⅠⅠ型胶原(collagen type ⅠⅠ,CⅠⅠ)和蛋白聚糖(aggrecan,Acan)等基质蛋白[46],成熟/肥大区域的软骨细胞则表达另一个转录因子Runx2[47]。Takegami 等[48]发现,Rspo2 基因敲除的小鼠模型中软骨细胞的β-catenin的含量减少,而Sox9 和CⅠⅠ的含量增加。通过对ATDC5 软骨细胞系Rspo2 的过表达和敲除对比研究,发现Rspo2激活Wnt/β-catenin信号通路抑制增殖软骨细胞Col2a1、Sox9、Acan 表达但不抑制成熟/肥大软骨细胞Runx2表达。上述结果支持Rspo2激活软骨细胞Wnt/β-catenin信号通路促进软骨内成骨过程中增殖软骨细胞向肥大软骨细胞分化。
4 Rspo2在骨相关疾病中的作用
4.1 脊柱后纵韧带骨化
脊柱后纵韧带骨化(ossification of the posterior longitudinal ligament,OPLL)是一种常见的脊柱疾病,由后纵韧带异位骨化(heterotopic ossification,HO)引起。韧带的HO是一种动态病理过程,包括创伤/损伤、炎症、间充质基质细胞(mesenchymal stromal cells,MSC)募集和软骨分化,最后是骨化[49]。值得注意的是,HO的常见过程是软骨内骨化[49],而有文献[48]报道Rspo2与软骨内骨化的调节有关,Rspo2 可以激活经典Wnt途径来促使增殖性软骨细胞分化为肥厚软骨细胞,而不是OB。有趣的是,最近有文献报道,炎症和重复性的机械过载会导致韧带的微损伤、退化和随后的HO[50],这与人韧带细胞中炎症因子和机械载荷会诱导Rspo2 产生的报道相一致[51]。最初Nakajima等[52]研究发现,Rspo2是OPLL的易感基因,之后Chen等[53]发现,BMSC来源的细胞外囊泡(BMSC-derived extracellular vesicles,BMSCEVs)含有miR-497-5p,BMSC-EVs 可以将miR-497-5p带到韧带成纤维细胞中,通过抑制Rspo2表达来加速韧带成纤维细胞的成骨分化,从而加速OPLL。而最近Tachibana 等[51]观察到OPLL 患者中的Rspo2 表达降低,Rspo2 可以抑制人韧带细胞的软骨分化,深入研究发现Rspo2是由炎症因子或机械载荷通过Rac1-NF-κB 途径诱导产生,但机械载荷和NF-κB在Rspo2的表达和调控中的意义还需要进一步研究来揭示。
4.2 骨关节炎
骨关节炎(osteoarthritis,OA)是导致软骨退化、滑膜炎症、软骨下骨重塑和骨赘形成的慢性疾病。OA 的病因非常复杂,包括关节损伤、肥胖、衰老和遗传因素等[54]。OA 患者的Rspo2mRNA 和蛋白质表达降低。Rspo2 siRNA降低了正常患者的OB 矿化,而重组Rspo2 能够增加骨关节炎患者的OB 矿化,OA 患者细胞中β-catenin 稳定性也降低,重组Rspo2能够将这种稳定性恢复到正常水平[55]。Zhang 等[56]用Rspo2 或抗Rspo2 对CⅠOA(关节内注射胶原酶诱导的OA)小鼠进行处理并观察关节滑膜组织中的巨噬细胞,发现滑膜巨噬细胞M1可以通过Rspo2 发生极化从而加重CⅠOA;Okura等[57]发现,Mianserin(一种四环类抗抑郁药)通过抑制软骨细胞中Rspo2 与其受体LGR5 的结合,抑制Wnt/β-catenin信号传导,并减少OA大鼠模型中的关节病变;Li 等[58]发现,抑制丙酮酸激酶M2(PKM2)表达导致Rspo2表达明显下降,随后阻断Wnt/β-catenin 信号传导, 在白介素-1β(Ⅰnterleukin 1β,ⅠL-1β)刺激的大鼠软骨细胞中防止内质网(ER)应激介导的细胞凋亡和炎症损伤,并且可能代表OA 的新治疗靶点;Knights 等[59]发现,滑膜成纤维细胞可以分泌Rspo2 并对创伤后OA 产生一定作用。由于在OA 中软骨和软骨下骨都会受到损伤,于是Lee 等[60]将原代软骨细胞和人OB系SaOS-2放在分化培养基中进行培养,并对RSPO、LGRs以及软骨生成和成骨特异性标志物的表达进行了分析,发现晚期OA组织样本显示靠近软骨下骨的区域中Rspo1 和LGR6 的表达增加,而Rspo2和LGR5的表达在关节软骨的深层区域重叠,从第7天到第14天,分化中的软骨细胞显示Rspo2和LGR5的表达增加,而从第2天到第14天,经历分化的OB 显示Rspo1 和LGR6 的表达增加。在肿瘤坏死因子α(TNF-α)刺激条件下,Rspo2 和Rspo1分别恢复了炎症、软骨和成骨标志物的抑制表达,并且在这两种情况下,β-catenin的稳定性也有所恢复。以上结果表明,RSPOs 软骨细胞和OB之间的相互作用可能为治疗炎症性疾病提供新思路。此外,Wnt 和BMP 信号串扰的机制是目前研究的焦点,在人间充质基质细胞中起重要作用,miR-181a 是参与调节软骨和软骨内分化之间平衡的关键microRNA,研究发现[61],在人MSCmiR-181a中激活的BMP信号传导表现为Sox9蛋白的积累和SMAD1/5/9 的磷酸化增加,以及伴随miR-181a 模拟物诱导的经典Wnt 信号减少,符合RSPO2 丢失的预期效应,从而表明miR-181a 靶向MSC 中的Rspo2 mRNA,并且观察到健康人软骨组织中miR-181a 和miR-218 表达水平之间的紧密相关性在OA 中被破坏,这突出了Wnt-BMP 信号交互作用对预防OA的重要性。
4.3 类风湿性关节炎
类风湿性关节炎(rheumatoid arthritis,RA)是一种全身性的自身免疫性疾病[62],以周身小关节受累为主要特征,具有侵蚀性、多发性、慢性及系统性等[63],其主要病理表现为,关节滑膜慢性炎症、血管翳形成,以及进行性、持续性的炎症破坏关节软骨、韧带及肌腱,导致关节畸形及功能丧失[64]。目前RA 的具体病因及发病机制尚不明确,随着对RA研究的深入, 其发病机制的有关研究主要集中在滑膜细胞异常的信号转导方面。成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)是RA最重要的病理特征,FLS产生炎性因子,促进细胞质降解,导致软骨和骨的持续性破坏[62]。Wnt/β-catenin 信号通路参与RA 慢性炎症过程。最初Xiao 等[65]发现,RA 患者FLS 中β-catenin 表达会因经典Wnt通路的激活提高,而β-catenin可反过来继续激活Wnt/β-catenin 信号通路,从而有助于RA患者中FLS 的稳定激活。之后Du 等[66]观察到,Wnt/β-catenin 通路的激活将会增强ⅠL-1β、TNF-α的表达, 促进基质金属蛋白酶(matrix metalloproteinases,MMP)生成,继而导致ECM降解并引起关节软骨破坏。值得注意的是,Rspo2作为经典Wnt通路的激动剂,是否可以通过Wnt通路对FLS中的炎症因子以及RA发挥调控作用尚未见报道。众所周知,女性RA 症状比男性更严重,并且占RA 总患者的大多数(约75%)。Kudryavtseva 等[67]发现,RA 中存在的性别差异,可能与参与软骨降解(Adamts12)以及经典与非经典Wnt 通路(Cthrc1、Rspo2 和Sdc2)的基因有关。综上所述,关于Rspo2 与RA 之间关系的研究文献较少,二者之间的具体分子机制还需进一步研究来证明。
5 结论与展望
Rspo2是一种基质细胞蛋白,能与基质蛋白及多种细胞受体(Lgr4/5/6、ZNRF3/RNF43、HSPGs和ⅠQGAP1 等) 相互作用来发挥生物学效应。Rspo2 与人类四肢骨骼发育畸形和缺陷密切相关,能够通过Wnt/β-catenin信号通路对骨骼系统产生调控作用,并参与一些骨骼相关疾病如OPLL、OA和RA的发生发展。
值得注意的是,最新研究发现,Rspo2可以通过未知受体直接作用于TCF3,TCF3不与β-catenin结合,通过抑制TCF3 磷酸化来阻断Wnt 靶标活化,最终对Wnt起拮抗作用。这与之前的研究结论有所不同,也为Rspo2在骨骼中与Wnt/β-catenin信号通路的相互作用提供了新的研究思路。除此之外,有关Rspo2 与骨之间的研究仍存在许多空白点,需要未来进一步研究探讨,例如:a. Rspo2在人韧带细胞中受NF-κB 诱导产生,而受NF-κB 调控的炎症因子ⅠL-1β、TNF-α等是否可以调控Rspo2尚未报道;b. RSPOs 家族成员之一Rspo1 是一种BMSCs 分泌的力学敏感蛋白,可以通过经典Wnt通路参与机械应力调控OB 分化和骨形成,而Rspo2与机械力之间是否也在存在该机制尚未见确切报道。运动是改善骨骼疾病的一种常规手段,Rspo2参与调节多种骨骼疾病的发生发展过程,那么运动是否可以通过Rspo2相关分子机制来调控骨并改善骨骼疾病尚未见报道,未来可以进一步深入研究来了解Rspo2在骨骼发育中的分子机制。

