富马酸替诺福韦酯和富马酸丙酚替诺福韦序贯联合聚乙二醇干扰素α-2b治疗慢性乙型肝炎患者的疗效比较①
蔡 纲,高庆娥,史元建
(淄博市第四人民医院(淄博市传染病医院),山东 淄博 255022)

富马酸替诺福韦酯(tenofovir alafenamide fumarate,TDF)和富马酸丙酚替诺福韦(tenofovir alafenamide fumarate,TAF)均为《慢性乙型肝炎防治指南(2022年版)》推荐的一线抗HBV药物[7]。两者皆为替诺福韦(tenofovir,TFV)的前体药,通过水解成TFV而发挥抗病毒作用。由于TAF只对靶细胞中的特定酶敏感,如肝细胞中的羧酸酯酶1,因此相比于TDF,TAF具有较低的全身暴露量风险和较好的靶细胞内抗病毒作用。两者的药物动力学研究结果表明,TAF组血浆TFV水平较TDF组低89.0%,在靶细胞中TFV浓度较TDF组高7.6倍[8]。由于TDF和TAF的药代动力学及TFV组织分布在人体内存在差异,它们抑制体内不同组织器官中HBV病毒的效能也会有所区别。这种差异可能进一步影响到免疫系统对TAF靶细胞(如肝细胞)内外HBV的反应。例如,人体免疫系统更易识别肝组织外的HBV相关抗原,因为肝脏具有免疫耐受性,特别是在慢性乙肝患者中[9]。本次研究的目的是为了评估这些差异是否会在与干扰素联合使用时,对免疫应答和抗病毒疗效产生影响。
1 资料与方法
1.1 一般资料
选取2020年7月至2021年10月淄博市第四人民医院(淄博市传染病医院)门诊就诊及住院的慢性乙型肝炎患者,共160例,根据用药方案不同分成实验组和对照组各80例,单用核苷类药物(TAF25mg,qd或TDF300mg,qd)第24周后,加用长效干扰素治疗72周,观察比较实验组(TAF序贯加用干扰素组)和对照组(TDF序贯加用干扰素组)的疗效。本次研究已获得本院医学伦理委员会批准,所有患者均已签署知情同意书。共有128例患者完成了研究(实验组62例,对照组66例)。实验组中男41例,女21例;年龄19~55岁,平均(36.6±9.6)岁;病程1~16年(9.5±3.1年);对照组中男42例,女24例;年龄18~58岁,平均(37.4±10.2)岁;病程1~17年(10.5±3.5年)。两组的性别、年龄、病程长短对比差异无统计学意义(P>0.05),具有可比性。入组时乙肝相关指标见表1。

表1 128例患者治疗前观察指标
1.2 纳入及排除标准
1.2.1 纳入标准:①HBsAg阳性持续6个月以上;②未系统接受过抗病毒治疗;③谷丙转氨酶(ALT)值≥正常值上限(以实验室参考值上限40U/L为准)。
1.2.2 排除标准:①合并其它肝病,如:严重的脂肪肝或酒精性肝病者;②合并肝硬化、肝性脑病或肝癌者;③合并HIV、HCV或其他嗜肝病毒或寄生虫感染者;④有精神类疾病或意识障碍者;⑤妊娠期、哺乳期或近期有生育需求的妇女;⑥合并有较严重的心力衰竭、糖尿病等基础疾病者;⑦合并有系统性红斑狼疮、强制性脊柱炎等自身免疫性疾病者;⑧患者正在参加其他药物试验者。
1.2.3 脱落标准:①在研究过程中,因个人原因无法采集到数据者;②依从性差或治疗过程中出现药物过敏以及严重不良反应者;③治疗期间同时服用了治疗慢性乙肝的其他抗病毒药物的患者。
1.3 方法
1.3.1 对照组:单用TDF300mg口服(po)每日1次(qd)治疗24周后,加用聚乙二醇干扰素α-2b 180μg皮下注射(ih)每周1次(qw)治疗,再持续治疗72周。
1.3.2 观察组:对照组单用TAF25mg口服(po)每日1次(qd)治疗24周后,加用聚乙二醇干扰素α-2b 180μg皮下注射(ih)每周1次(qw)治疗,再持续治疗72周。
1.4 观察指标
对比两组患者第24周、48周、72周、96周的HBV-DNA阴转率(定量<检测上限20IU/mL)、HBeAg阴转率、HBsAg阴转率、HBsAg滴度、HBVDNA定量、谷丙转氨酶(ALT)值的差异。
1.5 统计学方法
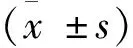
2 结果
共有128例参与者完成了研究,其中实验组62例,对照组66例。
2.1 HBsAg转化率比较
第24周时,两组转化率均为0.00%。第48周时,实验组3.23%(2/62)稍高于对照组1.52%(1/66),但差异不显著。第72周时,实验组14.52%(9/62)高于对照组7.58%(5/66),差异不显著(P>0.05)。第96周时,实验组25.81%(16/62),对照组12.12%(8/66),差异显著(P<0.05),见图1。

图1 两组HBsAg转化率的比较
2.2 HBsAg滴度比较
治疗前两组滴度相近。第24周,实验组(1930.57±414.85)IU/mL,对照组(1921.82±401.24)IU/mL,差异不显著。第48周,实验组(1090.52±289.12)IU/mL,对照组(1159.51±309.23)IU/mL,差异不显著。第72周,实验组滴度降至(381.65±89.43)IU/mL,对照组(419.73±95.54)IU/mL,差异显著(P<0.05)。第96周,实验组(110.56±41.24)IU/mL,对照组(182.64±51.35)IU/mL,差异显著(P<0.01),见图2。

图2 两组HBsAg滴度的比较
2.3 HBVDNA阴转率比较
第24周时,实验组HBVDNA清除率30.65%(19/62),对照组27.27%(18/66),差异不显著。第48周,实验组54.84%(34/62),对照组50.00%(33/66),差异不显著。第72周,实验组72.58%(45/62),对照组65.15%(43/66),差异不显著。第96周,实验组91.94%(57/62),对照组80.30%(53/66),差异不显著(P=0.058),见图3。
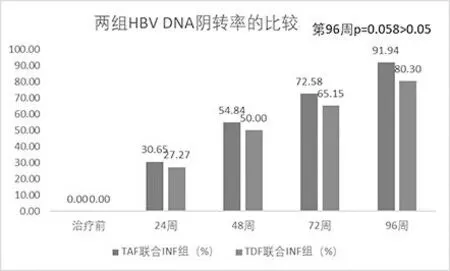
图3 两组HBVDNA阴转率的比较
2.4 HBVDNA定量比较
第24周,实验组HBVDNA定量为(4.88±1.89)log10IU/mL,对照组(4.91±1.81)log10IU/mL;第48周,实验组(3.45±1.55)log10IU/mL,对照组(3.52±1.64)log10IU/mL。第72周,实验组(2.38±1.18)log10IU/mL,对照组(2.51±1.33)log10IU/mL。第24至72周,两组HBVDNA浓度逐渐降低,但差异均不显著。第96周,实验组(1.25±.62)log10IU/mL,对照组(1.61±0.73)log10IU/mL,差异显著(P<0.05),见图4。

图4 两组HBVDNA定量的比较
2.5 HBeAg转化率比较
第24周时,实验组e抗原转化率为4.44%(2/45),对照组为6.38%(3/47)。第48周时,实验组28.89%(13/45),对照组27.66%(13/47)。第72周时,实验组46.67%(21/45)高于对照组38.30%(18/47)。第24至72周,两组转化率逐渐增加,但差异不显著。第96周,实验组66.67%(30/45),对照组48.94%(23/47),差异不显著(P=0.085),见图5。

图5 两组HBeAg转化率的比较
2.6 谷丙转氨酶(ALT)值比较
第24周时,实验组ALT值为(80.12±20.35)U/L,对照组为(77.36±18.47)U/L。第48周时,实验组(55.78±16.64)U/L,对照组(56.92±17.11)U/L。初始至48周,两组ALT水平降低,差异不显著。第72周,实验组(40.12±12.75)U/L,对照组(44.18±14.26)U/L,差异显著(P<0.05)。第96周,实验组(28.24±10.98)U/L,对照组(34.09±12.73)U/L,差异显著(P<0.01),见图6。

图6 两组谷丙转氨酶(ALT)值的比较
3 讨论
通过本次研究,我们观察到TDF和TAF序贯联合聚乙二醇干扰素α-2b对慢性乙型病毒性肝炎患者的治疗效果存在一定的差异。具体来说,实验组在96周时的HBsAg转化率、HBsAg滴度降低、HBVDNA定量以及ALT水平的改善上均优于对照组,而在HBVDNA清除率和HBeAg转化率上两组间的差异不具统计学意义。这些结果表明,TAF可能是一个更适合联合长效干扰素的抗病毒药物。
3.1 药物动力学与疗效
TDF和TAF虽然都是TFV的前体药物,但由于TAF对特定酶(如肝细胞中的羧酸酯酶1)的敏感性较高,因此在药物动力学和TFV组织分布上存在差异。TAF组血浆中的TFV水平较TDF组低,而在靶细胞中的TFV浓度较TDF组高,这可能是本实验中TAF组在抗病毒效果、尤其是HBsAg转化率和HBsAg滴度降低上优于TDF组的主要原因。同时,TAF的较低全身暴露量也可能减少了全身性不良反应[10],有利于提高患者的信心、治疗依从性和生活质量。
3.2 免疫应答
聚乙二醇干扰素α-2b作为一种重要的抗病毒药物,通过诱导抗病毒蛋白产生[11]、增强免疫细胞抗病毒应答和调节免疫细胞活性[12]等机制,与TDF或TAF联合应用可产生协同抗病毒效应。相比于TDF,TAF联合长效干扰素更有效的免疫机制可能为:TAF能更强的抑制靶向细胞(如肝细胞)内的HBV病毒复制,抵消HBV在肝细胞内的免疫耐受作用;TAF对靶细胞外的病毒作用相对较弱,有助于其发挥免疫原性的类疫苗作用[13]。HBV可以存活于患者的肝外组织(如血液、淋巴[14]、肾脏[15]等)中,肝组织外的HBV病毒活力相对较低但仍有复制,且与肝外恶性肿瘤的发生相关[16]。肝脏是免疫耐受器官,肝外组织的免疫耐受能力通常弱于肝脏,肝外HBV可能更容易被干扰素激发免疫应答识别。然而,值得注意的是,干扰素的抗病毒效果可能受多种因素影响,包括患者的治疗疗程、基线病毒载量、HBsAg基线水平[17,18]和个体免疫状态等,这也可能是本研究中某些指标(如HBeAg转化率)两组间差异不显著的原因。
3.3 研究局限
本研究的主要局限之一是样本量相对较小,可能影响了结果的统计学意义。未来需要在更大的患者群体中验证这些发现。此外,研究期限为96周,其中单独使用TAF或TDF时间24周,可能无法完全评估长期服用TDF和TAF的患者序贯加用长效干扰素治疗的效果和安全性。未来的研究可能需要延长单独使用TAF或TDF的时长,以便更准确地评估序贯加用干扰素的时机及这两种治疗策略的长期效益和风险。
综上所述,TAF序贯联合聚乙二醇干扰素α-2b可能是一种更为有效和安全的慢性乙型肝炎治疗方案。然而,鉴于本研究的局限性,还需要更多的临床研究以验证这些初步发现,并进一步探讨TDF和TAF联合干扰素治疗慢性乙型肝炎的最佳应用策略。

