错配修复蛋白表达在胃癌中的临床病理特征及与Ki67、P53相关性的研究①
郝丽莉,梁秀冰,黄世勇,黄小杏,李江,黄远涛,曾庆苏
(阳江市人民医院病理科,广东 阳江 529500)
胃癌位居中国恶性肿瘤发病率和死亡率第3位,严重危害国人的生命和健康[1]。由于早期症状不典型、筛查体系不完善,中国约70%的胃癌患者确诊时已处于局部进展期,治疗方案有限,预后不良[2]。既往胃癌精准治疗研究多在辅助治疗方案的基础上添加免疫或靶向药物来改善胃癌预后,但患者获益有限。最新研究表明,胃癌患者的预后并不单纯取决于病理分期、治疗方案等因素,分子分型也与胃癌预后存在明显的相关性[3]。微卫星不稳定(microsatellite instability,MSI)是由于微卫星重复序列的插入或缺失导致基因序列长度的改变所引起,从而引发肿瘤的发生[4]。错配修复蛋白家族主要有MLH1,MSH2,MSH6和PMS2四种蛋白,四种MMR蛋白无缺失者认为MMR表达正常(pMMR),有一个及以上MMR蛋白表达缺失则认为MMR表达缺陷(dMMR),为微卫星高度不稳定(MSI-H)。
Ki67是一种与细胞增殖特异相关的核抗原,在研究中发现,多种肿瘤组织中存在Ki67的表达,可以通过观察肿瘤细胞的增殖活性和增殖指数等参数来评估其表达情况,与预后密切相关,常作为判断肿瘤预后参考指标之一[5]。P53基因是肿瘤抑制基因中最为关键的抑癌基因之一,它位于17号染色体短臂上,参与了调控细胞凋亡、细胞周期阻滞以及DNA损伤修复等生物过程[6]。错配修复蛋白在胃癌中的表达及与Ki67、P53相关性研究阳江地区未见报道。
1 材料与方法
1.1 研究对象及分组情况
选取阳江市人民医院2020年1月至2022年12月收治的93例胃癌患者,所有患者均符合胃癌的诊断标准,经临床、组织病理和免疫组化确诊;无其他恶性肿瘤及肿瘤家族史;术前未进行放化疗,其中男62例,女31例;年龄 38~79岁,平均(65±10)岁。
分组:根据4种MMR蛋白表达是否缺失将胃癌分为两组:若免疫组化检测结果显示无MMR蛋白缺失,判读为MMR表达正常(pMMR)组,提示微卫星稳定(MSS);若结果显示任意一种MMR蛋白表达缺失,判读为MMR表达缺陷(dMMR)组,提示微卫星高度不稳定(MSI-H)。
1.2 仪器与耗材
LBP-5548全自动免疫组化染色机 (广州安必平公司);恒温水箱(上海跃进医疗器械厂);LBP-5196自动抗原修复仪(广州安必平公司);全自动脱水机(日本樱花公司);石蜡切片机(德国徕卡公司);半自动组织包埋机(德国徕卡公司);恒温烤箱(上海跃进医疗器械厂);光学显微镜(日本Olympus公司);MLH1、MSH2、MSH6 、PMS2、Ki67及P53鼠抗人单克隆抗体(广州安必平公司)。
1.3 免疫组织化学染色
免疫组化法检测胃组织四种错配修复蛋白(MLH1、MSH2、MSH6和PMS2)、Ki67及P53蛋白的表达。标本用10%中性福尔马林固定,石蜡包埋切片。免疫组化步骤:所有标本脱样品中,在4℃下过夜孵育,二抗孵育,使用DAB进行显色,然后进行复染,脱水和透明处理,最后进行封片,再用PBS代替一抗作为空白组对照。所有操作均严格按照SP试剂盒的说明书进行。
1.4 结果判定标准
由3名经验丰富的副主任医师对染色后的标本进行双盲读片。MLH1、MSH2、MSH6和PMS2、Ki67、P53阳性标准:定位于细胞核,细胞核内如若存在明显的黄色或棕黄色颗粒被视为是阳性。Ki67判读标准[7]:随机选择5个高倍镜下的视野,计算每100个细胞中的阳性细胞的数量,然后取平均值。阳性细胞的比例<10%,为阴性(-);阳性细胞的比例10%~25%,为弱阳性(+);阳性细胞的比例25%~75%,为中等阳性(++);阳性细胞的比例>75%,为强阳性(+++)。P53阳性标准:细胞核内呈现清晰的黄色或棕黄色颗粒为阳性,P53表达≥60%判读为阳性,为突变型。
1.5 统计学方法
采用SPSS26.0统计分析软件进行分析,在描述临床病理特征的构成比时,采用n(%)这一指标。数据分析采用χ2检验,多样本分析运用Pearson相关分析技术进行检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化
胃癌组织中MLH1、MSH2、MSH6、PMS2、Ki67、p53均定位于肿瘤细胞核,见图1。
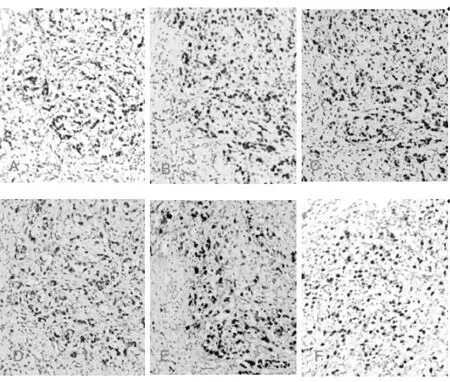
图1 免疫组化法检测MLH1、MSH2、MSH6、PMS2、Ki67、P53蛋白在胃低分化腺癌中的表达(×100)
2.2 MSI与胃癌病理特征的关系
93例胃癌中26例MMR蛋白表达缺失(27.96%),其中MLH1、MSH2、MSH6及PMS2表达缺失分别为21例(22.58%)、0例、0例及25例(26.88%),MLH1与 PMS2均缺失20例(21.51%),见表1。MLH1与PMS2常成对表达缺失,MLH1与PMS2蛋白在胃癌中表达的相关性,见表2。dMMR组胃癌与(年龄、性别、肿瘤大小、肿瘤位置、分化程度、TNM分期、脉管内癌栓、神经侵犯、淋巴结转移、远处转移等均不相关,无统计学意义(P>0.05),见表3。
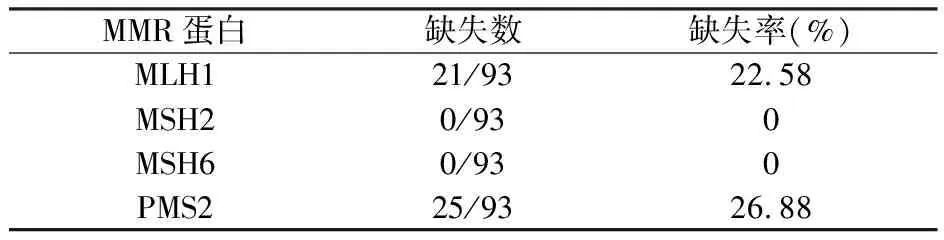
表1 胃癌组织中错配修复(MMR)蛋白的表达缺失情况
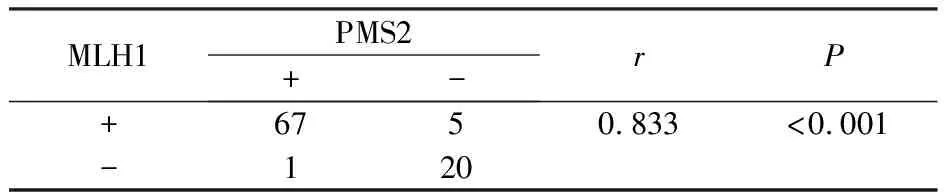
表2 MLH1与PMS2蛋白在胃癌中表达的相关性
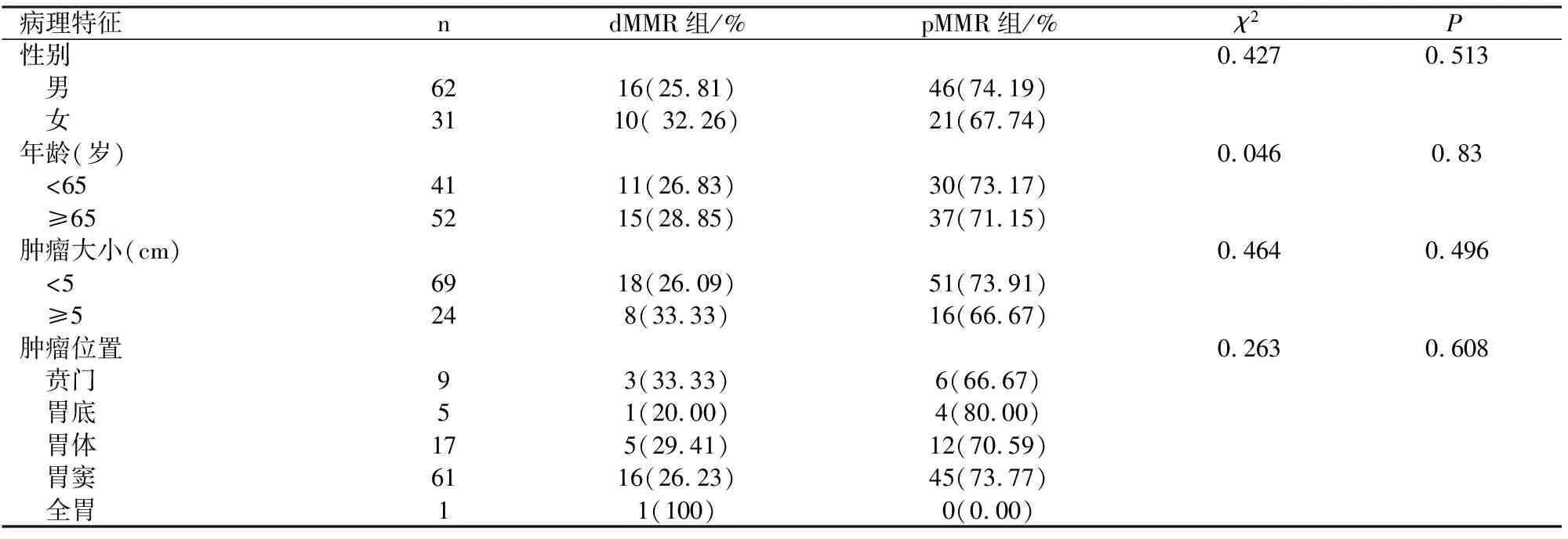
表3 MSI与93例胃癌病理特征的关系
2.3 Ki67、P53蛋白表达与胃癌病理特征的关系
dMMR组胃癌中Ki67蛋白表达均≥30%,说明微卫星不稳定性胃癌与Ki67蛋白表达水平呈正相关(r=0.271,P<0.01),dMMR组与P53表达无相关性,见表4。
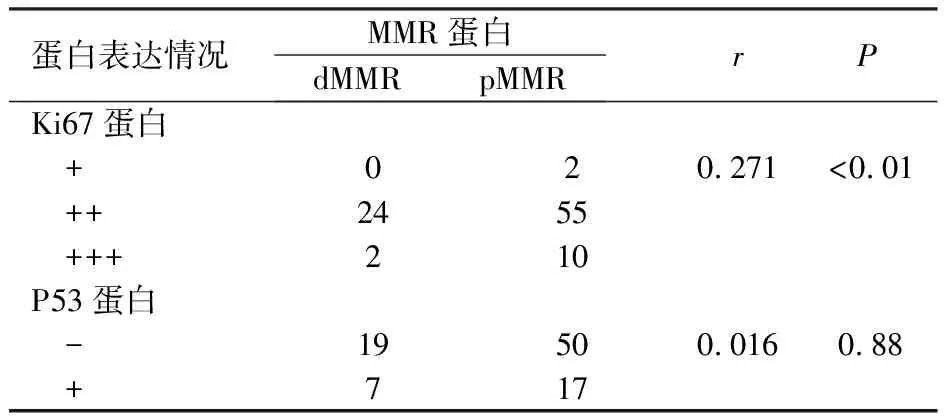
表4 胃癌中dMMR、pMMR组Ki67、P53表达的相关性
3 讨论
本实验通过研究pMMR组与dMMR组胃癌患者的临床病理特征,发现dMMR组与临床特征无统计学意义。MLH1与PMS2蛋白在胃癌中表达的相关性,同时MLH1和PMS2的成对缺失可能对胃癌的早期诊断有所帮助。Ki67是一种核蛋白质由MKI-67基因编码,又称之为MKI-67,提示细胞的增殖活性[8],它反应的增殖活性与肿瘤生物学行为有关而成为一种反映细胞增殖状态的理想标记物[9]。本实验研究揭示了在MMR蛋白表达缺失的病例中Ki67蛋白的表达水平显著增加,超过了30%,微卫星不稳定性与Ki67蛋白的表达水平也被证实与之存在正向关联。肿瘤的进展主要是由于P53基因突变,大约50%的癌症患者被发现携带这一突变[10]。本研究中P53的阳性率为12.9%,并不高,P53阳性表达与MMR缺失无相关性,本实验结果与其他文献报道的研究结果有所差异。
综上,关于MSI与Ki67、P53蛋白关系的研究目前较少,因MSI型胃癌中Ki67表达较高有相关性,进一步说明MSI与Ki67对评估胃癌的恶性程度有协同作用。本研究体现阳江地区胃癌患者的病理特征,样本量少,尚需大样本数据的验证及进一步深入研究。

