迷迭香酸对子痫前期大鼠炎症和内皮功能障碍的影响
张 媛,鲁 杨,彭迎春,刘颖燕,章乐霞,杨 洋(乐山市人民医院妇产科,乐山 64000;西安市人民医院,西安市第四医院生殖医学中心;通讯作者,E-mail:yangyang9840056@63.com)
子痫前期(preeclampsia,PE)是一种妊娠期特有的妊娠期高血压合并症,是导致孕产妇和围产儿死亡、早产和胎儿生长受限的主要原因,其发病机制复杂,目前缺乏有效的治疗方法[1,2]。PE的发生发展与炎症反应过度激活和氧化应激产物水平增加有关,抗炎和抗氧化在PE治疗中起重要作用[3]。血管内皮功能障碍是PE发病的中心环节[4,5]。正常情况下,细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)和白细胞功能相关抗原(leukocyte function-related antigen-1,LFA-1)的表达水平较低,无法使内皮黏附中性粒细胞[6]。然而,肿瘤坏死因子-α、干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-1(interleukin-1,IL)和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP)等促炎细胞因子的增加可激活PE患者血管内皮和白细胞上的黏附分子配体,从而上调ICAM-1、VCAM-1和LFA-1的水平,导致内皮细胞与中性粒细胞黏附并诱导内皮损伤[7]。因此,改善内皮功能障碍是治疗PE的有效途径。迷迭香酸(rosmarinic acid,RA)是一种来自唇形科植物的水溶性天然酚酸类化合物,如迷迭香、鼠尾草、罗勒等。RA具有多种药理活性,包括抗炎、抗氧化、抗菌、抗病毒等[8,9]。研究表明,RA通过降低内皮素-1和血管紧张素转换酶活性以及增加一氧化氮水平来降低果糖诱导的高血压[10]。RA通过调节磷酸烯醇式丙酮酸羧激酶和葡萄糖转运蛋白4的表达来改善链脲佐菌素诱导的1型糖尿病或高脂饮食诱导的2型糖尿病大鼠的高血糖和胰岛素敏感性[11]。然而,目前尚无文献报道RA在PE中的应用效果。本研究通过观察RA对PE大鼠收缩压、24 h尿蛋白、胎鼠体质量和死亡率、PE大鼠胎盘和肾脏组织形态、血清氧化应激指标、血清炎症细胞因子、胎盘黏附因子、胎盘TLR4信号通路的影响,探讨RA治疗PE大鼠模型的效果,及其对炎症和内皮功能障碍的影响。
1 材料与方法
1.1 材料
1.1.1 实验试剂 迷迭香酸(R4033)购自美国Sigma公司;L-NAME(ST1555-10g),苏木精-伊红(HE)染色试剂盒(C0105M)、过碘酸雪夫(PAS)染色试剂盒(C0142M)、RIPA裂解液(P0013C),BCA试剂盒(P0012S)、BeyoECL Plus(P0018S)购自上海碧云天生物技术公司;超氧化物歧化酶(SOD)试剂盒(A001-3-2)、丙二醛(MDA)试剂盒(A003-1-2)购自南京建成生物工程研究所;IL-1β ELISA试剂盒(ER1094)、IL-6 ELISA试剂盒(ER0042)、IFN-γ ELISA试剂盒(ER0012)、MCP-1 ELISA试剂盒(ER0047)购自武汉菲恩生物科技有限公司;ICAM-1(ab171123)、LFA-1(ab52895)、VCAM-1(ab174279)、Toll样受体4(TLR4)(ab217274);髓样分化因子88(MyD88)(ab2064)、GAPDH(ab181602)一抗和山羊抗兔IgG H&L(HRP)(ab6721)二抗购自美国Abcam公司。
1.1.2 实验仪器 ZS-Z无创尾动脉血压测量分析系统(北京众实迪创科技发展有限责任公司);ZH-B6大鼠代谢笼(安徽正华生物仪器设备有限公司);7600-020型全自动生化分析仪(日本日立公司)。
1.1.3 实验动物 7~8周龄SPF级成年Sprague-Dawley(SD)大鼠(雄性:体质量270~310 g;雌性:体质量210~240 g)购自西安交通大学实验动物中心,生产许可证SCXK(陕)2020-001。所有大鼠均不限制食物和水,并在(22±3)℃、(60±3)%湿度和12 h光暗循环的环境中饲养。将大鼠按照雌雄2∶1比例同笼饲养,观察到雌鼠阴道中精子并有阴栓脱落为孕第0天。本研究大鼠实验操作遵循实验动物福利伦理审查指南标准执行,经过西安市人民医院伦理委员会审查通过(审批号202203161703)。
1.2 方法
1.2.1 PE大鼠建模 参考文献[12]方法建立PE大鼠模型。孕第11天开始,对大鼠连续4 d每天皮下注射1 mL的左旋硝基精氨酸甲酯(L-NAME,200 mg/kg),孕第15天测量收缩压(SBP),SBP升高30 mmHg以上表示建模成功。
1.2.2 大鼠分组及处理 孕第15天时,将30只成功建模的大鼠随机分为3组:模型组、50RA组和100RA组,每组10只;另取10只同期孕鼠作为对照组。孕第15天时,对照组和模型组大鼠每天灌胃1 mL的0.9%氯化钠溶液,50RA组和100RA组大鼠分别给予1 mL的剂量为50 mg/kg和100 mg/kg的RA治疗处理,各组大鼠均连续灌胃7 d处理。参考文献[13,14]设定RA的使用剂量。
1.2.3 SBP的测定 孕第21天时,应用无创尾动脉血压测量分析系统测量各组大鼠收缩压(systolic blood pressure,SBP)。
1.2.4 24 h尿蛋白的测定 孕第21天时,使用ZH-B6大鼠代谢笼收集尿液,将大鼠尿液离心(4 ℃,2 000 r/min,15 min)取上清。通过全自动生化分析仪测定24 h尿蛋白。
1.2.5 胎鼠体质量和死亡率的测定 孕第21天时,用2%戊巴比妥钠(50 mg/kg)麻醉孕鼠,剖宫取出胎鼠,统计各组胎鼠体质量和死亡率。
1.2.6 胎盘和肾脏组织学染色 孕第21天时,分离大鼠胎盘和肾脏,组织标本在4%多聚甲醛中固定48 h,石蜡包埋,切成4 μm厚切片。按照试剂盒说明,胎盘组织进行HE染色,肾脏组织进行PAS染色。
1.2.7 血清SOD和MDA的检测 孕第21天时,大鼠眼眶静脉丛采血0.5 mL,离心(4 ℃,3 000 r/min,15 min)取血清。按照试剂盒说明检测大鼠血清SOD和MDA水平。
1.2.8 血清炎性细胞因子的检测 孕第21天时,使用ELISA试剂盒检测大鼠血清中炎性细胞因子IL-1β、IL-6、IFN-γ和MCP-1的水平。
1.2.9 Western blot检测ICAM-1、LFA-1、VCAM-1、TLR4和MyD88蛋白表达水平 使用RIPA裂解缓冲液提取大鼠胎盘组织匀浆中的总蛋白,并使用BCA试剂盒测定蛋白浓度。蛋白质(45 μg/泳道)通过10%的SDS-PAGE分离并转移到聚偏二氟乙烯膜上。在与抗ICAM-1(1∶1 000)、LFA-1(1∶2 000)、VCAM-1(1∶1 000)、TLR4(1∶2 000)、MyD88(1∶2 000)一抗在4 ℃过夜孵育。随后,将膜与山羊抗兔IgG H&L(HRP)(1∶2 000)二抗在室温下孵育2 h。使用BeyoECL Plus显色,并使用Image J软件分析光密度。GAPDH(1∶2 000)作为内参蛋白。
1.3 统计学分析
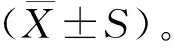
2 结果
2.1 RA对PE大鼠SBP和24 h尿蛋白的影响
孕第21天时,与对照组相比,模型组大鼠SBP和24 h尿蛋白水平均升高(P<0.05);与模型组相比,50RA组和100RA组大鼠的SBP和24 h尿蛋白水平均降低(P<0.05,见表1)。

表1 RA对孕21 d PE大鼠SBP和24 h尿蛋白水平的影响Table 1 Effects of RA on SBP and 24 h urine protein le-vels in PE rats at the 21st day of pregnancy
2.2 RA对胎鼠体质量和死亡率的影响
与对照组相比,模型组胎鼠体质量降低(P<0.05);与模型组相比,50RA组和100RA组胎鼠体质量均升高(P<0.05,见表2)。与对照组相比,模型组胎鼠死亡率升高(4.92%vs29.82%,P<0.05);与模型组相比,50RA组和100RA组胎鼠死亡率均降低(29.82%vs17.46%,13.33%,P<0.05);各组间胎鼠死亡率差异有统计学意义(χ2=9.928,P=0.019,见表2)。
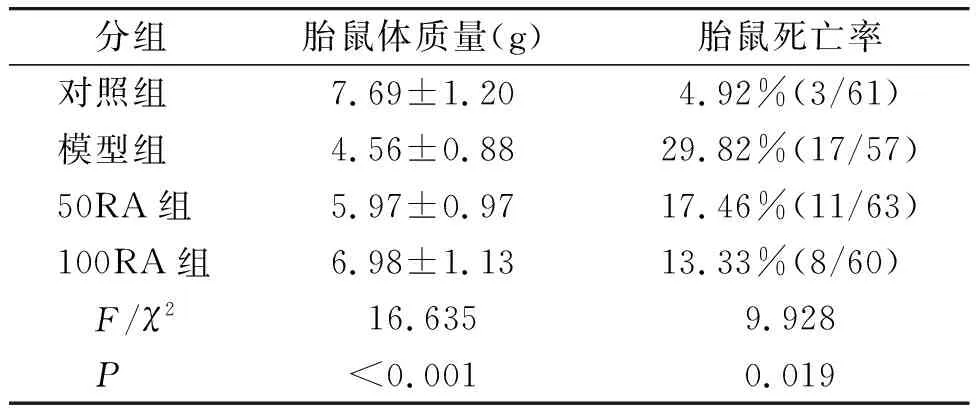
表2 RA对胎鼠体质量和死亡率的影响Table 2 Effects of RA on body weight and mortality of fetal rats
2.3 RA对PE大鼠胎盘和肾脏组织形态的影响
孕第21天时,胎盘组织HE染色显示,对照组大鼠胎盘血运丰富,形态正常;模型组大鼠胎盘绒毛数量减少,结构异常,坏死;50RA组和100RA组大鼠的胎盘形态较模型组明显改善(见图1)。孕第21天时,肾脏组织PAS染色显示,对照组大鼠肾小球形态正常,结构完整;模型组大鼠肾小球肥大,边界不清晰,肾小球系膜基质堆积,肾小球基底膜增厚;50RA组和100RA组的大鼠肾脏形态较模型组明显改善(见图1)。

图1 RA对孕21 d PE大鼠胎盘和肾脏组织形态的影响 (×400)Figure 1 Effects of RA on placenta and kidney morphology of PE rats at pregant day 21 (×400)
2.4 RA对PE大鼠血清氧化应激指标的影响
各组大鼠孕第21天时血清SOD和MDA水平差异有统计学意义(P<0.001)。与对照组相比,模型组的血清SOD水平降低,MDA升高(P<0.05);与模型组相比,50RA组和100RA组的血清SOD水平均升高,MDA均降低(P<0.05,见图2)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与50RA组比较,&P<0.05。图2 RA对孕21 d PE大鼠血清SOD和MDA水平的影响Figure 2 Effect of RA on serum SOD and MDA levels in PE rats at pregant day 21
2.5 RA对PE大鼠血清炎症细胞因子的影响
孕第21天时,与对照组相比,模型组大鼠的血清IL-1β、IL-6、IFN-γ和MCP-1水平均升高(P<0.05);与模型组相比,50RA组和100RA组大鼠的血清IL-1β、IL-6、IFN-γ和MCP-1水平均降低(P<0.05,见图3)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与50RA组比较,&P<0.05。图3 RA对孕21 d PE大鼠血清IL-1β、IL-6、IFN-γ和MCP-1水平的影响Figure 3 Effect of RA on serum IL-1β, IL-6, IFN-γ and MCP-1 levels in PE rats at pregant day 21
2.6 RA对PE大鼠胎盘黏附因子的影响
孕第21天时,与对照组相比,模型组大鼠胎盘组织中ICAM-1、LFA-1和VCAM-1的蛋白表达水平均升高(P<0.05);与模型组相比,50RA组和100RA组大鼠胎盘组织中ICAM-1、LFA-1和VCAM-1的蛋白表达水平均降低(P<0.05,见图4)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与50RA组比较,&P<0.05。图4 Western blot检测RA对孕21 d PE大鼠胎盘组织中ICAM-1、LFA-1和VCAM-1的蛋白表达水平的影响Figure 4 Effect of RA on protein expression levels of ICAM-1, LFA-1 and VCAM-1 in placental tissue of PE rats at pregant day 21 by Western blot
2.7 RA对PE大鼠胎盘TLR4信号通路的影响
孕第21天时,与对照组相比,模型组大鼠胎盘组织中TLR4和MyD88的蛋白表达水平均升高(P<0.05);与模型组相比,50RA组和100RA组大鼠胎盘组织中TLR4和MyD88的蛋白表达水平均降低(P<0.05,见图5)。
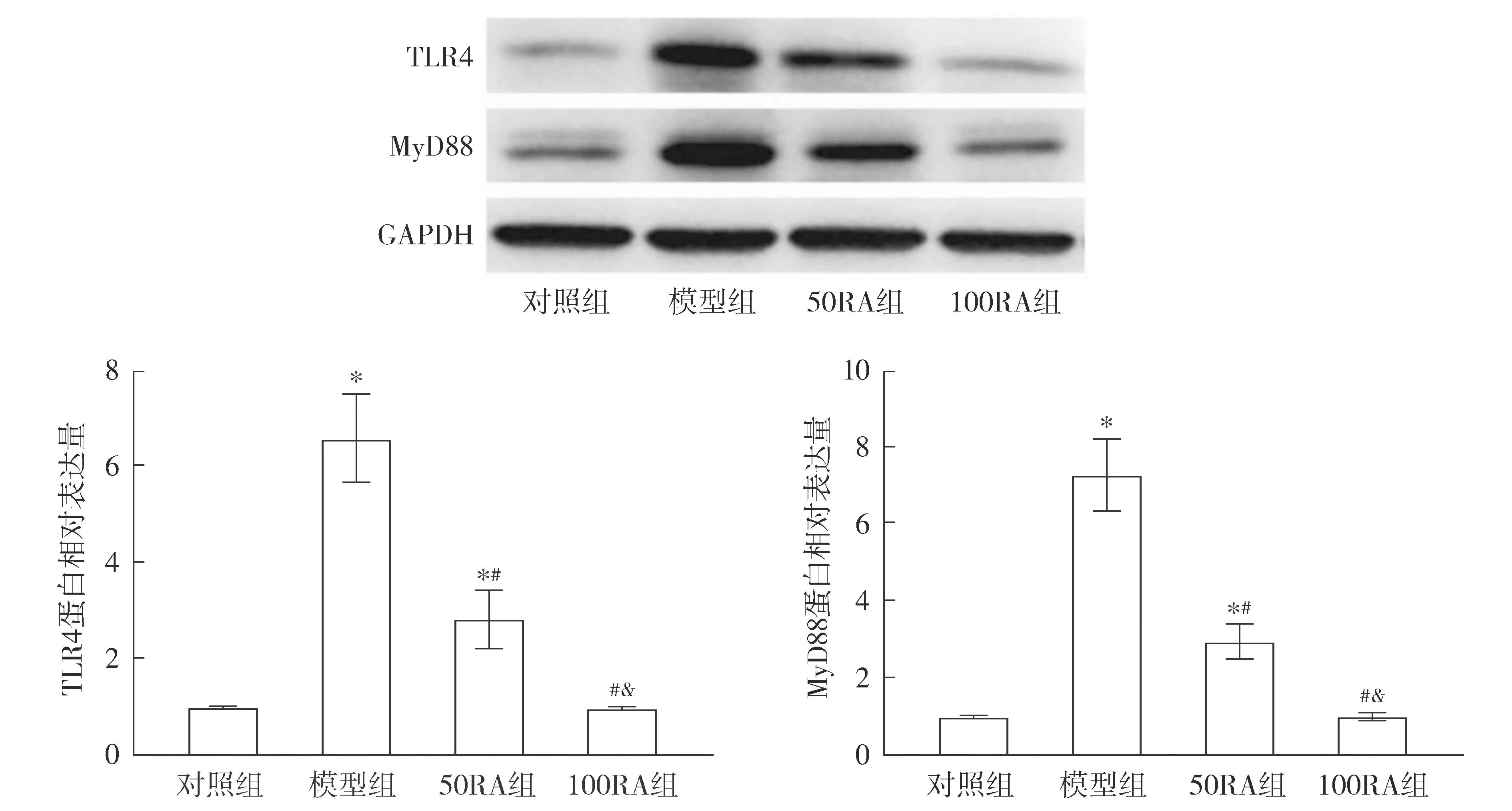
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与50RA组比较,&P<0.05。图5 Western blot检测RA对孕21 d PE大鼠胎盘组织中TLR4和MyD88的蛋白表达水平的影响Figure 5 Effect of RA on protein expression levels of TLR4 and MyD88 in placental tissue of PE rats at pregant day 21 by Western blot
3 讨论
氧化应激、炎症、免疫和血管内皮功能障碍已经成为治疗PE的创新靶点[15]。探索靶向这些异常途径的新药物可能会产生更有效的治疗效果。目前有许多预防和治疗PE的候选药物正在研究中,包括质子泵抑制剂[16]、二甲双胍[17]、他汀类药物[18]、白藜芦醇[19]、褪黑素[20]等,然而,这些药物大多数具有副作用。阻碍PE新药研发的一个重要问题是新药对母婴的安全性。RA是一种天然酚酸类化合物,目前广泛用于食品和化妆品行业,具有良好的安全性[21]。此外,RA具有降压、降糖、抗糖尿病等作用[10,11]。本研究推测RA可能是治疗PE的高安全性潜在药物,因此,本研究首次探索了RA治疗PE大鼠模型的效果。L-NAME诱导PE大鼠模型是一种诱导实验性高血压的方法,其病情类似于临床PE。本研究结果表明,50 mg/kg和100 mg/kg的RA均降低了PE大鼠SBP和24 h尿蛋白水平,提高了胎鼠体质量,降低了胎鼠死亡率,改善了胎盘和肾脏组织形态,这些结果说明RA在治疗PE方面具有较高的潜力。
氧化应激和炎症是PE发生发展的关键因素,PE发展过程中的低氧环境可以促使过多的活性氧、炎症因子释放到母体循环中[22],损伤胎盘内皮,引起内皮功能障碍[23]。大量研究证实,抗氧化酶SOD在PE患者中降低[24],而脂质氧化代谢物MDA升高[25]。IL-1β、IL-6、IFN-γ和MCP-1是参与PE胎盘炎症的主要因子[26,27]。本研究表明,50 mg/kg和100 mg/kg的RA均抑制了PE大鼠的氧化应激和炎症,表现为血清SOD水平升高,MDA降低,以及血清IL-1β、IL-6、IFN-γ和MCP-1水平降低。因此,RA的抗氧化和抗炎作用可能是治疗PE的主要机制。内皮调节血管扩张能力,内皮功能障碍表现为血管的收缩和舒张动态平衡功能被破坏,从而引起高血压,这是PE的主要临床特征[28]。血管收缩增强损害了脑、心、肝和肾等主要器官的血液供应,在肾脏中主要表现为尿蛋白排泄增加,称为蛋白尿[29]。黏附因子(如ICAM-1、LFA-1和VCAM-1)与内皮功能障碍密切相关,黏附因子的大量分泌可导致内皮细胞与中性粒细胞黏附并诱导内皮损伤[6,7]。本研究表明,50 mg/kg和100 mg/kg的RA均抑制了PE大鼠胎盘组织中ICAM-1、LFA-1和VCAM-1的蛋白表达,表明RA可能通过减少胎盘组织的黏附因子来减轻PE大鼠的内皮功能障碍。目前,其他学者也报道了RA对内皮功能的保护作用。例如,RA通过激活腺苷酸活化蛋白激酶(AMPK)通路减轻过氧化氢引起的大鼠主动脉环内皮功能障碍[30];RA可减轻糖尿病引起的大鼠主动脉血管功能障碍[13]。因此,RA治疗PE的机制与其内皮功能保护作用有密切关联。
TLR4信号通路在人类各种疾病病理损伤中发挥重要作用[31]。MyD88是重要的细胞内衔接蛋白,可作为TLR4信号级联的效应器,MyD88的激活可促进炎症[32]。TLR4信号通路也是参与PE形成的重要通路[33]。TLR4信号通路不仅参与炎症和氧化应激的调控,而且其过度激活也会损伤内皮功能[34]。目前,大量学者认为TLR4信号通路是治疗PE的重要靶标[35,36]。本研究表明,50 mg/kg和100 mg/kg的RA均抑制了PE大鼠胎盘组织中TLR4和MyD88的蛋白表达,从而抑制了TLR4信号通路的激活。其他文献已经报道了RA对TLR4及其下游信号分子表达的抑制作用[37,38]。因此,本研究认为RA可能通过减轻TLR4信号通路介导的炎症、氧化应激和内皮功能障碍来发挥其对PE的治疗作用。
综上所述,本研究表明RA有效减轻了PE大鼠的临床症状,RA可能通过减轻TLR4信号通路介导的炎症、氧化应激和内皮功能障碍来发挥其对PE的治疗作用。因此,RA作为治疗PE的新型天然药物,可能具有较高的开发价值。

